
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 12
- •Вопрос 13
- •Вопрос 14
- •Вопрос 15
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Вопрос 29
- •Вопрос 30
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Вопрос 34
- •Вопрос 35
- •Вопрос 36
- •Вопрос 37
- •Вопрос 38
- •Вопрос 39
- •Вопрос 40
- •Вопрос 41
- •Вопрос 42
- •Вопрос 43
- •Вопрос 44
- •Вопрос 45
- •Вопрос 46
- •Вопрос 47
- •Вопрос 48
- •Вопрос 49
- •Вопрос 50
- •Вопрос 51
Вопрос 32
Энтальпия и энергия Гиббса, их физический смысл, связь между ними.
Сумма
внутренней энергии и произведения
объёма вещества на внешнее давление
наз. энтальпией: Н
= U
+ pV.
Энтальпия, подобно объему, давлению,
температуре и внутренней энергии, явл.
характеристикой состояния системы.
Абсолютные значения Н
не известны, т.к точно не известна
величина внутренней энергии U.
Научное и прак. значение имеет изменение
энтальпии в ходе процесса, т.е разность:
 .
.
Энергия
Гиббса
− это термодинамический потенциал
следующего вида:
 ,
где U
− внутренняя
энергия,
P −
давление,
V −
объем,
T −
абсолютная температура,
S −
энтропия.
Энергию Гиббса можно понимать как полную
химическую
энергию
системы (кристалла, жидкости и т. д.)
,
где U
− внутренняя
энергия,
P −
давление,
V −
объем,
T −
абсолютная температура,
S −
энтропия.
Энергию Гиббса можно понимать как полную
химическую
энергию
системы (кристалла, жидкости и т. д.)
При
постоянных температуре и давлении: TΔS
≥ ΔU
+ РΔV
+ Aпол
 Aпол
≥ ΔU
+ РΔV
– TΔS
= U2
+
РV2
− TS2
−(U1
−
РV1
−
TS1)
(*). Отсюда:
Aпол
≥ ΔU
+ РΔV
– TΔS
= U2
+
РV2
− TS2
−(U1
−
РV1
−
TS1)
(*). Отсюда:
 наз. энергией Гиббса. ΔG
≤ −Апол
. Из определении этой функции следует,
что абсолютное её значение неизвестно,
изменение этой функции при переходе от
начального состояния к конечному не
зависит от пути перехода.
наз. энергией Гиббса. ΔG
≤ −Апол
. Из определении этой функции следует,
что абсолютное её значение неизвестно,
изменение этой функции при переходе от
начального состояния к конечному не
зависит от пути перехода.
Физический смысл энтальпии и энергии Гиббса: физический смысл энтальпии: ее изменение — это тепло, подведенное к системе в изобарическом процессе (при постоянном давлении).
Энергия Гиббса в равновесном процессе с точностью до знака равна полезной работе, которую может совершить система.
Вопрос 33
Энергия Гиббса как термодинамическая функция состояния. Определение и свойства. Вычисление стандартной энергии Гиббса процесса по справочным данным. Критерий самопроизвольного протекания реакций.
Энергия
Гиббса
− это термодинамический потенциал
следующего вида:
 ,
где U
− внутренняя
энергия,
P −
давление, V −
объем, T −
абсолютная температура, S −
энтропия. Энергию Гиббса можно понимать
как полную химическую энергию системы
(кристалла, жидкости и т. д.).
,
где U
− внутренняя
энергия,
P −
давление, V −
объем, T −
абсолютная температура, S −
энтропия. Энергию Гиббса можно понимать
как полную химическую энергию системы
(кристалла, жидкости и т. д.).
Свойства: однозначная, конечная, непрерывная функция. Из её определения. следует, что абсолютное её значение неизвестно, изменение этой функции при переходе от начального состояния к конечному не зависит от пути перехода.
−Aпол ≥ ΔG.
Значит ΔG для обратимого процесса равно полезной работе системы. Физический смысл энергии Гиббса вытекает из соотношения (*) – энергия Гиббса в равновесном процессе с точностью до знака равна полезной работе, которую может совершить система. В случае протекания неравновесных процессов энергия Гиббса будет (с обратным знаком) равна максимально возможной полезной работе, которую может совершить система.
Вычисление стандартной энергии Гиббса процесса по справочным данным: по следствию из закона Гесса энергия Гиббса химической реакции может быть найдена:
ΔGхим.реакции = ∑niGi(продуктов) − ∑njGj(исх. в-в) .
Вопрос 34
Критерий самопроизвольного протекания реакций, энтальпийный и энтропийный факторы процесса. Какие реакции протекают самопроизвольно в водных растворах?
При постоянных температуре и давлении: ΔG ≤ −Апол. . При отсутствии полезной работы получаем: ΔG ≤ 0. Из этого соотношение следует, что при протекании обратимых хим. реакций ΔG = 0, а при протекании реальных, самопроизвольных процессов она уменьшается. Иными словами, при Р = const, Т = const самопроизвольно протекают только процессы, сопровождающиеся уменьшением энергии Гиббса. Пределом протекания процесса будет состояние с минимальным значением G при данных условиях. После достижения минимума G перестает изменяться и ΔG = 0, система находится в состоянии равновесия.
ΔG
= ΔН – ТΔS.
 самопроизвольное течение процесса (ΔG<
0) возможно при:
самопроизвольное течение процесса (ΔG<
0) возможно при:
-
ΔН<0 и ΔS>0 ;
-
ΔН>0 и ΔS>0, если ТΔS > ΔН ;
-
ΔН<0 и ΔS<0, если |ΔН| > |ТΔS|.
Чем отрицательней ΔG, тем проще, в более мягких условиях идет процесс.
Энтальпийный и энтропийный факторы процесса:
Если ΔН<0 отражает стремление к объединению частиц в более крупные агрегаты, то ΔS>0 отражает стремление к беспорядочному расположению частиц, к их дезагрегации. Переход системы в состояние с минимальной энергией когда ΔS=0, если же ΔН=0, то система самопроизвольно переходит в наиболее неупорядоченное состояние. Каждая их этих противоположных тенденций, количественно выражаемых ΔН и ΔS зависит от природы вещества и условий протекания процесса (т-ра, давление, соотношение между реагентами и т.д).
Произведение
ТΔS
(кДж/моль) явл. энтропийным фактором
процесса, ΔН – энтальпийным фактором.
В состоянии равновесия: ΔН = ТΔS.
Это уравнение явл. условием равновесия,
характеризует такое состояние данной
системы, когда скорости протекающих в
ней противоположных процессов становятся
равными. Из этого уравнения
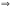
 :
расчет изменения энтропии в равновесном
процессе возможен из непосредственно
измеряемых величин. ΔН фазового перехода
можно определить экспериментально с
помощью калориметра.
:
расчет изменения энтропии в равновесном
процессе возможен из непосредственно
измеряемых величин. ΔН фазового перехода
можно определить экспериментально с
помощью калориметра.
