
- •Ядро: синтез днк і теломераза
- •1.1. Компоненти ядра
- •Ядерна оболонка і ядерний матрикс
- •Хромосоми
- •Днк хромосом
- •5´Кінець 3´кінець
- •3´Кінець 5´кінець
- •Гістони і організація днк в хромосомах
- •Метафазні хромосоми
- •Негістонові білки хромосом
- •1.2. Реплікація основної частини днк
- •Місце реплікації днк в клітинному циклі Схеми мітоза і мейозу
- •Мітотичний цикл
- •Типи клітин по здатності до поділу.
- •Вихід клітин з мітотичного циклу
- •Загальна характеристика реплікації днк Основні принципи
- •Особливості механізму
- •Компоненти ферментного комплексу
- •Реплікація теломерних відділів днк Основні уявлення Суть проблеми кінцевої недореплікації
- •Теломери і теломераза
- •Експерименти Карреля і Хейфлика Початкові ідеї Вейсмана
- •Спростування першого постулату Вейсмана Каррелем
- •Спростування Карреля Хейфликом
- •Теломерная теорія старіння Основні положення теорії
- •Факти, що підтверджують теорію
Теломери і теломераза
Теломерна ДНК має певний склад, а для підтримки її довжини, як правило, використовується спеціальний фермент - теломераза.
Розглянемо низку важливих питань, що стосуються теломер і теломерази.
Структура теломер
Нуклеотидна структура теломерних послідовностей ДНК нам вже відома. Вищі рівні організації утворюються за рахунок специфічних білків.
Мабуть, ці білки, на відміну від звичайних гістонів, не утворюють нуклеосомні глобули. Нуклеосомна структура в достатньо коротких теломерах не виявлена. Хоча довгі теломери мишей мають нуклеосомну організацію.
Найвідоміші серед теломерних білків - білок Rар1 (у дріжджів) і його аналог білок ТRF1 (у ссавців).
Очевидно, завдяки цим білкам, теломери мають щільну упаковку, тобто відносяться до фракції гетерохроматина.
У свою чергу, така структура робить теломери дуже стабільними. Зокрема, теломерні повтори недоступні для теломерази упродовж більшої частини клітинного цикла. Очевидно, в S-фазі у відповідь на деякий сигнал білок ТRF1 дисоціює від теломери - починається її подовження. Потім же він знову зв'язується і тим самим попереджає надлишкове зростання теломери.
З тієї ж причини теломерні ділянки ДНК малодоступні для інших ферментів - ДНК-метилаз і ендонуклеаз. У зв'язку з останньою обставиною, при мейозі в області теломер дуже низька частота дволанцюгових розривів.
Нарешті, за допомогою теломерних білків теломери кріпляться до компонентів ядерного матриксу в т. ч., можливо, до ядерної ламіни (пластинці, пов'язаній з внутрішньою ядерною мембраною). Чи дійсно в усіх клітинах теломери прикріплені до ядерної мембрани, поки не цілком ясно. Але, принаймні, на ранніх і середніх стадіях профази мейозу такий зв'язок, безперечно, існує.
Вважають також, що теломерна ДНК утворює декілька петель (у вигляді "пелюсток ромашки"), фіксованих на матриксі; і у міру укорочення теломер число "пелюсток" поступово зменшується.
Функції теломер
Тепер обговоримо відомі функції теломер.
1. Деякі функції можна умовно позначити як механічні.
а) Так, тільки що було сказано, що теломеры беруть участь у фіксації хромосом до ядерному матриксу. Це важливо для правильної орієнтації хромосом в ядрі, і ця обставина особливо проявляється в мейозі.
На зиготенній стадії профази мейозу відбуваються направленні переміщення кінців хромосом на поверхні ядерної мембрани - так, що кінці гомологічних хромосом змикаються і з них починається спаровування (кон'югація) цих хромосом строго однорідними ділянками.
б) Крім того, теломери зчіплюють один з одним кінці сестринських хроматид (що утворюються в хромосомі після S -фази). Можливо, це зчеплення відбувається за рахунок гібридизації теломер сестринської ДНК.
В той же час структура теломер така, що допускає розходження хроматид в анафазі. Проте можлива мутація (на рівні гена теломеразної РНК; див нижче), яка змінює нуклеотидну послідовність теломер; тоді розбіжність хроматид блокується.
2. Функції другої групи - стабілізаційні.
а) Найважливіша з них нам вже знайома: якщо в клітині немає теломерази (чи ALT), то наявність теломер оберігає від недореплікації генетично значущі відділи ДНК.
б) Якщо ж в клітині є теломеразна активність, то з’являється ще одна можливість стабілізації кінців разірванних хромосом.
Так, при випадковому розриві хромосоми утворюються фрагменти, на одному або на обох кінцях яких немає теломерних повторів. У відсутність теломерази ці фрагменти зливаються і деградують, що блокує клітинний цикл і приводить клітину до загибелі.
У присутності ж теломерази до місць розриву приєднується теломерна ДНК. Це стабілізує хромосомні фрагменти і дозволяє їм функціонувати.
Зокрема, цей феномен виявлений у хворих α-талассемиєю: в генах α-глобіну відбуваються розриви хромосоми 16q, і до пошкодженого кінця додаються теломерні повтори.
3.Вплив на експресію генів.
Ще одна цікава властивість теломер позначається як ефект положення: активність генів, розташованих поряд з теломерами, понижена (репресована). Такий ефект часто позначається як мовчання транскрипції, або сайленсинг.
При значному ж укороченні теломер ефект положення пропадає і прителомерні гени активуються.
а) Сайленсинг може бути результатом дії білків (таких, як Rapl або TFR1), що взаємодіють з теломерами. Тим більше, як вже відзначалося, ці білки знижують доступність теломерної ДНК для цілого ряду ферментів.
б) З іншого боку, ефект положення може бути обумовлений близькістю до ядерної оболонки. Так, по гіпотезі А. М. Оловнікова, в цій оболонці можуть розташовуватися Са2+ -канали, і потік іонів Са2+ впливає на взаємодію білків з довколишніми генами.
Ефект положення може торкнутися і внутрішніх генів, якщо який-небудь з таких генів стає транспозоном (геном, здатним до переміщення в іншу ділянку ДНК) і вбудовується в теломерну область. Чи якщо відбувається розрив хромосоми і утворення на кінцях розриву теломерних повторів : за допомогою останніх стає можливо зв’язeвання теломерних білків і прикріплення до ядерної мембрани.
4. "Рахункова" функція.
Теломерні відділи ДНК виступають годинниковим пристроєм (т. з. реплікометра), який відраховує кількість поділів клітини після зникнення теломеразної активності. Дійсно, як вже відзначалося, кожний поділ призводить до укорочення теломери на 50-65 н. п.
Причому набагато важливіше для клітини не те, скільки поділів вже пройшло, а скільки ще залишилося до критичного укорочення теломери. Тому можна сказати і так, що теломерний пристрій визначає кількість поділів, які здатна зробити нормальна клітина у відсутність теломерази.
Досягаючи ж критично короткої довжини, теломери втрачають можливість виконувати усі або більшість вищеперерахованих функцій. Порушується клітинний цикл, і кінець кінцем клітина гине.
Механізм дії теломерази
Із сказаного витікає дуже важлива біологічна роль теломеразы.
Теломераза подовжує G-ланцюг кожної теломери. Розберемося в механізмі цього процесу.
Ключову роль грає той факт, що з теломеразою пов'язана т. з. теломеразна РНК завдовжки близько 450 нуклеотидів. Її середня коротка ділянка комплементарна півтори теломерним повторам:
(3´)................АУЦ ЦЦА АУЦ...................(5´).
Лівий триплет цієї РНК (АУЦ) використовується для зв’язування (шляхом гібридизації) з крайнім теломерним напівповтором G-ланцюга ДНК (рис .1.19).
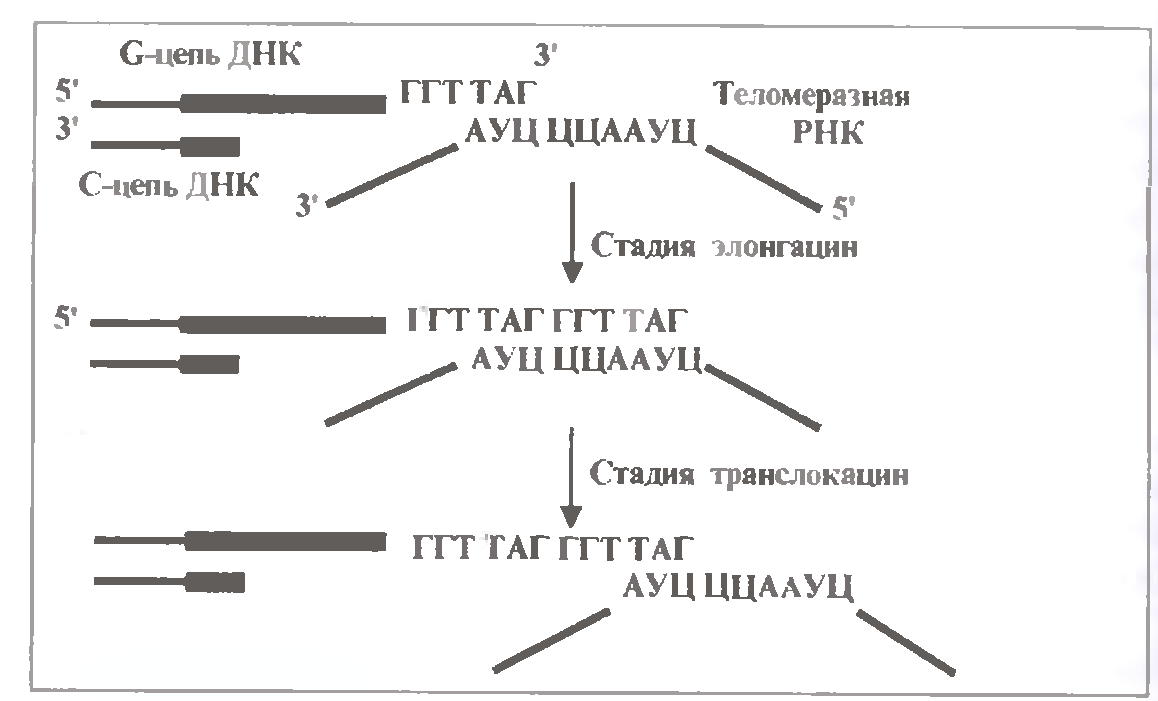
Інший же гексануклеотид (ЦЦААУЦ) служить в якості матриці для подовження 3'-кінця β-ланцюга на один теломерний повтор. А саме послідовне включення нуклеотидів (відповідно до структури матриці) каталізується білковими субодиницями теломерази.
Отже, теломераза виступає як зворотна транскриптаза - фермент, що здійснює синтез ДНК на РНК-матриці. В той же час напрям подовження ланцюга ДНК залишається звичайним: 5´ → 3'.
Процес утворення нового теломерного повтору позначають як елонгацію.
Потім відбувається транслокація - переміщення ферменту разом зі своєю РНК по подовжуваному ланцюгу ДНК на один повтор "лівіше", тобто до 3'-концу. Очевидно, в процесі транслокації РНК втрачає зв'язок з ДНК, а потім її встановлює, взаємодіючи з крайньою "половинкою" тільки що синтезованого повтору.
Потім ланцюг ДНК подовжується ще на один повтор. І так далі.
Таким чином, цикл роботи теломерази включає дві стадії - елонгацію і транслокацію. Чергуючи їх, фермент прибудовує до старого ланцюга декілька десятків або сотень теломерних повторів.
При цьому виявляється, що теломерна РНК - не лише матриця, але і важлива частина каталітичної машини : при заміні в ній декількох нуклеотидів відбувається не синтез "неправильних" повторів, а втрата теломеразою своєї активності.
Методи визначення активності теломерази
Визначають наявність теломерази в тому або іншому біологічному об'єктіза допомогою двох основних методів.
У т. з. прямому методі в інкубаційну суміш, окрім дослдіжуваного зразка, вносять праймер G -ланцюга (олігонуклеотид, зщо тримає декілька теломерных повторів) і мічені дНТФ. Праймер виступає в ролі G -цепи, з якою зв'язується і доторую потім подовжує теломераза. Про наявність активності судять по включенню радіоактивності до складу олігонуклеотида.
Другий, непрямий, метод - т. з. TRAP-аналіз (Telomer Repeat Amplification Protocol); він використовує ПЦР - полимераз-ную ланцюгову реакцію. Тут в суміш, окрім зразка, теж добавляют G -праймер і мічені нуклеотиди. Але, крім того, до суміші вносять С-праймер і термостійку бактерійну ДНК-полимеразу. Завдяки цьому, в ході ПЦР відбувається багатократне "клонування" (чи ампліфікація) подовженого тіломеразой олігонуклеотида.
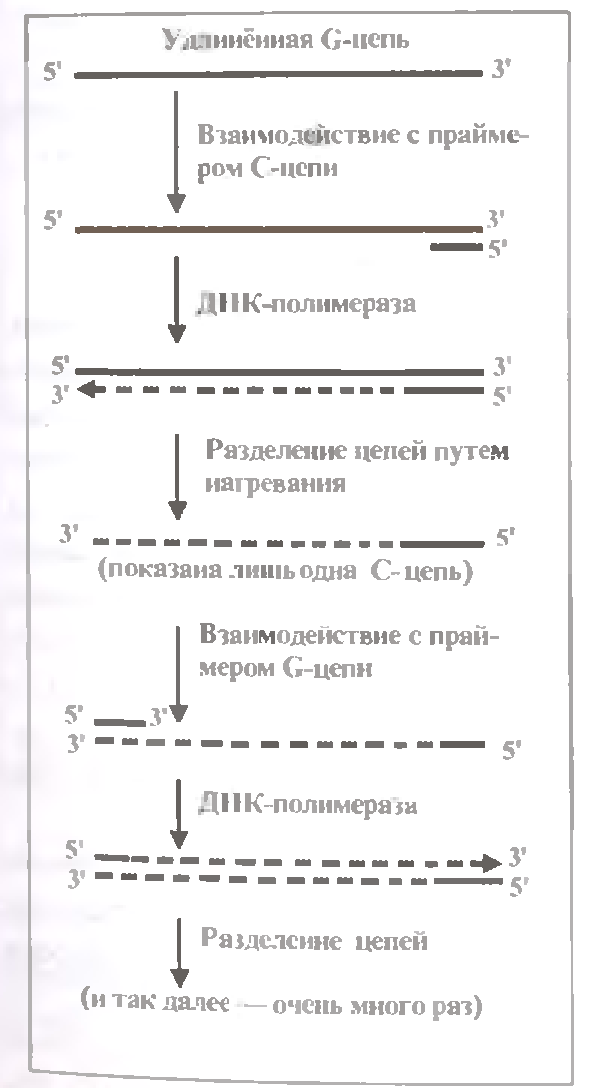
Принцип ПЦР показаний на мал. 1.20.
З подовженою С-цепью взаємодіє С-праймер, після чого він нарощується ДНК-полимеразой (использующей С-цепь як матрицы). Утворюється двухце-почечная ДНК. Її ланцюги разівделяют нагріванням.
З подовженою С-цепью взаємодіє С-праймер, який потім нарощується ДНК-полимеразой. Утворюющуюся дволанцюжковий ланцюг знову розділяють нагреваниїм - в середовищі з'являється дополнительная подовжена С-цепь. Але тепер вона синтезирована вже не теломеразой, а ДНК-полимеразой - шляхом двустадийного копіювання першої С-цепи.
І так далі. Многократале чергуються цикли, вклющо сподіваються взаємодії С-или С-праймера з соответствующей поодиноким ланцюгом, полімеразного копіювання цього ланцюга і розподілу двох
Усе це відбувається в одній пробірці, оскільки термостабильная ДНК-полимераза витримує нагрівання у кінці кожного з численних циклів.
У результаті кількість С-цепей амплифицируется (множитьця) приблизно в 10' разів, і, відповідно, в стільки ж раз повышается чутливість методу.
Продукти реакції піддають гель-электрофорезу і підлозісподіваються спектру радіоактивних смуг, відповідних подовженийным олигонуклеотидам.
З появою ТКАР-аналізу різко полегшилося виявлення теломеразы в різних об'єктах. Проте і досі, в основному, йдеться лише про якісне виявлення активності. Стандартного ж способу виміру рівня активності до последнего часу не існувало.
Крім того, оцінюючи ті або інші результати, потрібно мати на увазі можливість артефактів. Одні обставини методического характеру можуть маскувати теломеразную активність; інші, навпаки, - давати псевдопозитивні результати.
Поширення теломерази
Адекватне застосування вищевикладених методів позволяет вирішити, в яких клітинах є і функціонує теломера-за, а в яких клітинах її немає. Це, мабуть, ключове питання усієї "теломеразной біології". Дійсно, саме в нім криється зв'язок цієї проблеми із старінням і канцерогенезом.
За початковими уявленнями А. М. Оловникова, у взрослого людини теломеразная активність має бути лише в клітинах зародкового шляху (у лінії статевих клітин). У усіх же соматичних клітинах вона відсутня і з'являється тільки у разі їх пухлинного переродження.
Експериментальні дослідження, здавалося, повністю підтвердили ці представлення.
Так, уперше теломераза була відкрита в 1985 р. у одноклеточних эукариот. Потім її виявили в пухлинних клітинах человека, а ще пізніше - в яєчниках. У нормальних соматичних тканинах теломеразную активність детектувати не вдавалося.
Усе це перетворило колишні гіпотетичні погляди практически на аксіому; причому багато і до цих пір рахують цю аксиому абсолютно непорушною.
Проте насправді положення значно змінилося після появи високочутливого TRAP аналізу. З його допомогою теломеразную активність стали виявляти в самых різних тканинах і органах тварин і людини.
При цьому в характері поширення теломераазы є цілком певна закономірність, якщо учитывеать спосібность відповідних клітин до ділення (п. 1.2.1.3) 4. Це видно з таблиці. 1.1.
Таблиця 1.1. Поширення теломеразы в нормалыаных клітинах і
тканинах організму
Митотичес-кие клітини (чи ткаии, такі клітини, що містять)
Клітини, тканина або орган а) Лімфоцити (у лімфовузлах, мін
далинах, периферичної крові) б) Ендометрій в) Епідерміс г) Слизова
оболонка товстої кишки (нижні відділи крипт) д) Яєчники (фолікулярні
клітини; вклад вносять також мейотические клітини - ооциты) е) Слизова
оболонка шлунку ж) Слизова оболонка сечового міхура
Вірогідність обнаружен ияя теломераз ний актривности, %
3100
60
50 (при і інсоляції зростає)
35
25
15 а) Легені (епітеліальний компонент)
16
Умовно пост-митотические клітини б) Підшлункова залоза
14 в) Печінка
8 г) Щитовидна залоза
0
Постмитоти-ческие клітини (тканини) д) Передміхурова залоза а) Мозок
0 (але в сстволовых клеткхах є)
0 б) М'язові тканини (за непрямими даними)
0
а) З найбільшою постійністю (серед нормальньых соматических клітин) теломераза виявляється в органаж кроветворенію - кістковому мозку, лімфовузлах і т. д.
Причому в кістковому мозку її активність практично отсутствует в початкових стовбурових клітинах (очсень, що діляться, рідко), але Досягає високого рівня в наступних, комутованийных і
що активно діляться, клітинах, а потім знову зникає.
У клітинах периферичної крові (гранулоцитаж і лимфоцитах) теломераза виявляється знову. Правда, тут активність невелика, але вона значно збільшується (до уровкя такий в пухлинах) при
стимуляції ділень лімфоцитів різними митогенами.
Дещо рідше, але все-таки дуже часто теломеразу находят в епітелії шкіри і слизових оболонок самих різних органів. І тут, як з'ясовано, вона локалізується в пролифери рующих клітинах.
Зокрема, в ендометрії пік теломеразной активності доводиться на кінець фази проліферації (що проходить під кінтролем естрогену), а в наступну фазу секреції активність швидко падає.
Аналогічно йде справа в інших епітеліальних тканинах: клітини, вступаючі в термінальне диференціювання, активность теломеразы втрачають.
б) З істотно меншою частотою виявляють фермент в органах з умовно постмітотичними клітинами - печені, підшлунковій залозі. Можливо, сюди можна віднести і респіраторні відділи легенів, де альвеолоциты II, як считануть, здатні до ділень і трансформації в альвеолоциты I (основні клітини, що вистилають стінки альвеол).
Є активність і в стовбурових клітинах передміхурової залози (хоча в цілому тканина залози практично неактивна).
в) І, нарешті, в мозку і в м'язових тканинах, де черенявляющее більшість складають постмітотичні клітини або волокна (що остаточно втратили здатність ділитися), теломераза стабільно не виявляється.
Усе це і дає основу говорити про наявність досить простого зв'язку : теломераза є в багатьох з тих соматических клітин, які здатні до ділень.
Такий висновок в корені суперечить тій, що раніше склалася парадигме (що постулювала, що в усіх соматичних клітинах дорослого організму теломеразы немає).
Правда, потрібно відмітити, що наявність вказаної активності в клітинах, що діляться, далеко не завжди рятує теломеры від постатечного укорочення. Так, відмічено укорочення теломер і в кровотворних клітинах, і в лімфоцитах - у міру увеличения числа ділень (у культурі) або календарного віку животного (in vivo).
Очевидно, справа пояснюється низькою активністю теломеразы або її гальмуванням якими-небудь інгібіторами (ніби білийно TRF1, блокуючого теломеры; п. 1.3.2.1).
Але як би то не було, в принциповому питанні про распространении теломеразы усе далеко не так однозначно, як це представлялося спочатку.
ТЕЛОМЕРАЗА І СТАРІННЯ
Теломерная теорія старіння була сформульована А. М. Оловниковым, виходячи з двох обставин - проблеми кінцевої недореплікації ДНК (п. 1.3.1.1) і т. н. ефекту Хей-флика, виявленого для клітинних (чи тканинних) культур.
Відкриття цього ефекту в 1961 р. принципово ізмінило загальні уявлення про природу старіння. Ще через 10 років, як вже сказано, ефект послужив основою для формулировки теломерной теорії старіння. І, нарешті, сам метод изучения клітин в культурі досі активно використовується в самых різних дослідженнях - в т. ч. по теломеразной проблематике.
Тому зупинимося коротко на суті робіт Хейфлика і його не менш знаменитого попередника - Алексиса Карреля.
