
- •Ядро: синтез днк і теломераза
- •1.1. Компоненти ядра
- •Ядерна оболонка і ядерний матрикс
- •Хромосоми
- •Днк хромосом
- •5´Кінець 3´кінець
- •3´Кінець 5´кінець
- •Гістони і організація днк в хромосомах
- •Метафазні хромосоми
- •Негістонові білки хромосом
- •1.2. Реплікація основної частини днк
- •Місце реплікації днк в клітинному циклі Схеми мітоза і мейозу
- •Мітотичний цикл
- •Типи клітин по здатності до поділу.
- •Вихід клітин з мітотичного циклу
- •Загальна характеристика реплікації днк Основні принципи
- •Особливості механізму
- •Компоненти ферментного комплексу
- •Реплікація теломерних відділів днк Основні уявлення Суть проблеми кінцевої недореплікації
- •Теломери і теломераза
- •Експерименти Карреля і Хейфлика Початкові ідеї Вейсмана
- •Спростування першого постулату Вейсмана Каррелем
- •Спростування Карреля Хейфликом
- •Теломерная теорія старіння Основні положення теорії
- •Факти, що підтверджують теорію
Компоненти ферментного комплексу
Як вже відзначалося, в процесі реплікації ДНК бере участь складний ферментний комплекс, що включає, по деяким оцінкам, 15-20 білків.
Але функція і механізм дії доки виявлені не для усіх цих білків, тому в нижченаведеному описі фігурує "лише" 12 найменувань.
Для зручності викладу розділимо перераховувані білки на 3 групи (мал. 1.11).
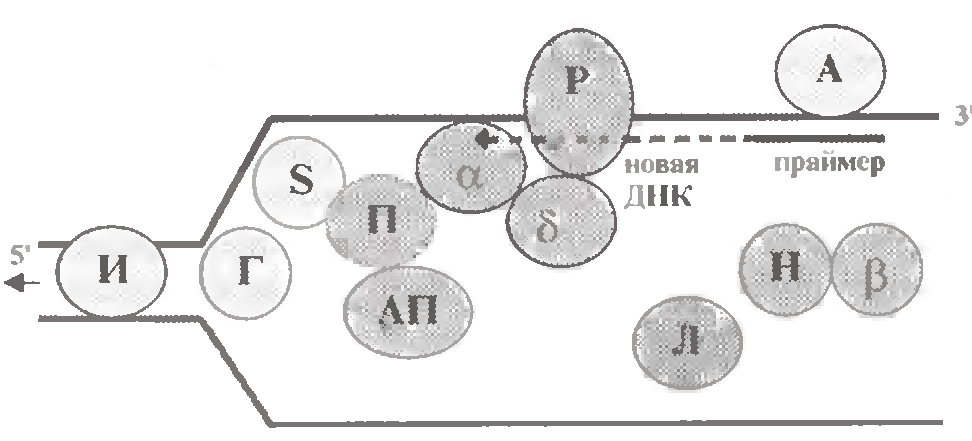
Білки, що готують батьківську ДНК до реплікації
а) Точки початку реплікації на молекулі ДНК мають специфичну послідовність основ, багату парами А-Т.
Процес починається з того, що з кожною такою послідовністю зв'язується декілька молекул спеціальних впізнавальних білків. У бактерій такі білки називаються DnaA (як перші білки, що ініціюють реплікацію). Тому на мал. 1.11 білок, що впізнає, позначений буквою А.
Можна уявити різні причини, по яких можлива взаємодія білків, що впізнають, з точками початку реплікації. Серед цих причин:
- сама поява в ядрі білків, що впізнають, або їх певна модифікація;
- звільнення точок початку реплікації від деяких блокуючих елементів;
- поява в ядрі якихось третіх чинників, необхідних для даної взаємодії; і т. д.
Наявні дані свідчать на користь першого варіанта. Але у будь-якому випадку ясно, що тут - одна з ключових ланок, контролюючих початок реплікації.
Білки, що впізнають, що забезпечують зв'язування ДНК-реплікуючого комплексу, мабуть, далі не переміщуються разом з ним по ДНК.
б) Одним з "першопроходців" виступає фермент геліказа (від helix - спіраль; на мал. 1.11 позначений буквою Г). Він забезпечує розплітання в районі реплікативної вилки подвійної спіралі батьківської ДНК : остання відокремлюється на одноланцюгові ділянки.
На це витрачається енергія гідролізу АТФ - по 2 молекули АТФ на розподіл 1 пари нуклеотидів.
Мабуть, одночасно відбувається також витіснення даної ділянки ДНК із зв'язку з гістонами і іншими хромосомними білками.
в) Проте розплітання спіралі на деякій ділянці створює суперспіралізацію перед цією ділянкою.
Річ у тому, що кожна молекула ДНК в цілому ряді місць зафіксована на ядерному матриксі. Тому вона не може вільно обертатися при розплітанні якоїсь своєї ділянки. Це і викликає суперспіралізацію, а з нею - утворення структурної напруги, блокуючої подальше розплітання подвійної спіралі.
Проблема вирішується за допомогою ферментів топоізомераз (І на мал. 1.11). Очевидно, вони функціонують на ще нерозплетеній ділянці ДНК, тобто там, де виникає суперспіралізація.
Так звана топоізомераза I розриває один з ланцюгів ДНК, переносить її проксимальний кінець на себе (мал. 1.12).

Це дозволяє дистальній ділянці ДНК (від місця розплетення до місця розрива) обертатися навколо відповідного зв'язку цілого ланцюга, що і попереджує утворення супервитків. Згодом кінці розірваного ланцюга знову замикаються: один з них переноситься з ферменту на другий кінець. Отже процес розриву ланцюга топоізомеразою зворотній.
Є також топоізомераза II (бактеріальна топоізомераза II називається гіразою). Цей фермент розриває відразу обидва ланцюги ДНК, знову-таки переносячи відповідні кінці на себе. Це ще ефективніше дозволяє вирішувати проблему супервитків при розплітанні ДНК.
г) Отже, «підтримуваний» топоізомеразами, фермент геліказа здійснює локальне розплітання подвійної спіралі ДНК на дві окремі нитки.
З кожною з цих ниток відразу зв'язуються спеціальні SSB -белки (від англ. Single Strand Binding Proteins; S на мал. 1.11). Останні мають підвищену спорідненість до одноланцюгових ділянок ДНК і стабілізують їх в такому стані.
Відмітимо: тим самим ці білки відрізняються від гістонів, які зв'язуються в першу чергу з дволанцюговими ділянками ДНК.
Ферменти полімеризації
а) Спеціальний білок виконує функції активатора праймази (АП на мал. 1.11). Після чого праймаза (П), використовуючи як матрицю відповідну ділянку одноланцюгової ДНК, синтезує коротку РНК-приманку, або праймер.
б) Далі в справу вступають ДНК-полімерази. У еукаріот відомо 5 різних ДНК-полімераз. З них β - і ε-полімерази беруть участь в репарації ДНК, γ-полімераза в реплікації мітохондріальної ДНК, а α- і δ-полімерази - в реплікації ядерної ДНК.
При цьому, по деяких припущеннях, α-полімераза пов'язана і з праймазой, і з δ-полимеразою, а остання, у свою чергу, з білком PCNA (від англ. Proliferating Cell Nuclear Antigen; P на мал. 1.11).
Цей білок виконує роль "прищепки", яка кріпить комплекс полімераз до реплікуємого ланцюга ДНК. Вважається, що в "застібнутому" стані він, як кільце, обхоплює ланцюг ДНК (мал. 1.13).
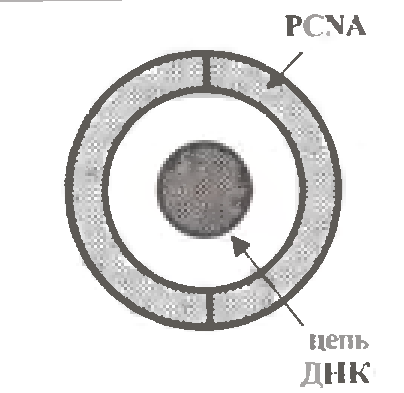
Тим самим попереджується передчасна дисоціація полімераз від даного ланцюга.
Зрозуміло, що ДНК-полімерази здійснюють послідовні включення дезоксирибонуклеотидів в ланцюг ДНК, що будується, - комплементарно нуклотидам батьківського ланцюга.
Але, крім того, ці ферменти, мабуть, мають і ряд інших важливих активностей. Для еукаріотичних ДНК-полімераз розподіл даних активностей ще не цілком ясно. Тому приведемо відомості відносно аналогічних бактеріальних ферментів.
У бактерій основну "роботу" по реплікації ДНК виконує ДНК-полімераза III, що має структуру димера. Саме з нею пов’язаний "зажим" типу білка PCNA.
Окрім ДНК-полімеразної активності, ДНК-полімераза III має ще одну - 3´→5'- екзонуклеазної. Остання спрацьовує в тих випадках, коли припустилась помилка і в ланцюг, що будується, включений "неправильный" нуклеотид. Тоді, розпізнавши дефект спаровування основ, фермент відщеплює із зростаючого (3´-) кінця останній нуклеотид, після чого знову починає працювати як ДНК-полімераза.
Таким чином, відбувається постійний контроль системи за результатом своєї діяльності.
в) Як ми знаємо, нові ланцюги ДНК утворюються спочатку у вигляді фрагментів - відносно коротких (фрагментів Оказаки) і дуже довгих. І кожен з них починається з праймерної РНК.
Коли ферментний комплекс, що рухається по батьківському ланцюгу, доходить до РНК-приманки попереднього фрагмента, "зажим", що зв'язує ДНК-полімеразу III з батьківським ланцюгом ДНК, розкривається, і цей фермент зупиняє роботу.
У дію вступає ДНК-полімераза I (як і раніше йдеться про бактеріальні ферменти). Вона приєднується до 3´-кінця зростаючого фрагмента (мал. 1.14).
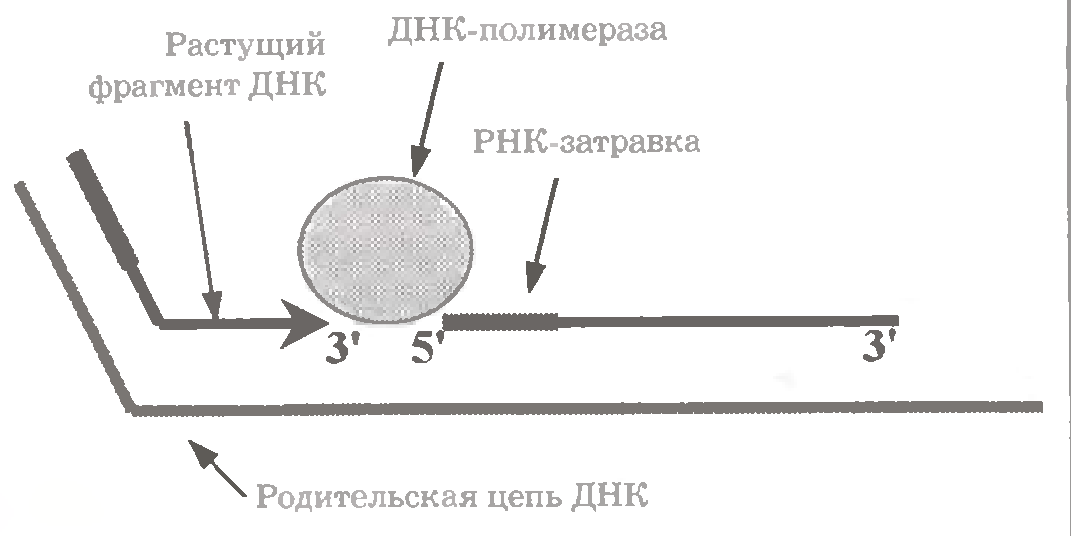
При цьому фермент вже не має стійкого зв'язку з цим фрагментом і з батьківським ланцюгом, та зате володіє навіть не двома, а трьома активностями.
Перша з них - "передня", або 5´ → 3´ - екзонуклеазна активність: послідовне відщеплення нуклеотидів з 5´-кінця РНК-приманки попереднього фрагмента.
На місце, що звільняється, фермент включає дезоксирибонуклеотиди, приєднуючи їх, як завжди, до 3'- кінця "свого" фрагмента (ДНК-полімеразна активність).
І, нарешті, подібно до ДНК-полімеразі III, він "не забуває" перевіряти і при необхідності коригувати свою діяльність - за допомогою "задньої", або 3´ → 5 '- екзонуклеазної активності, спрямованої на подовжуваний фрагмент.
Функція ДНК-полімерази I вичерпується, коли зростаючий фрагмент впритул доходить до дезоксирибонуклеотидів попереднього фрагмента.
Що стосується еукаріот, то тут функціональним аналогом бактеріальної ДНК-полімерази III є, мабуть, комплекс α- і δ-ДНК-полімераз; при цьому коригуюча 3´ → 5´ -екзонуклеазна активність властива δ-ДНК-полімеразі.
Функції ДНК-полімерази I теж розподілені між двома ферментами: 5' → 3'- екзонуклеазна активність (видалення РНК-приманки) здійснюється, ймовірно, спеціальною нуклеазою (Н на мал. 1.11), а ДНК-полімеразна активність (забудовування "проломів") - ДНК-полімеразою β (тій, що бере участь і в репарації).
г) Говорячи про ферменти полімеризації, не можна не сказати про найважчу з пов'язаних з ними проблем. Йдеться про синтез ланцюга ДНК, що запізнюється : як ми знаємо, напрям цього синтезу протилежний загальному напряму поширення реплікативної вилки.
Є, принаймні, дві гіпотези, що пояснюють ці протиріччя.
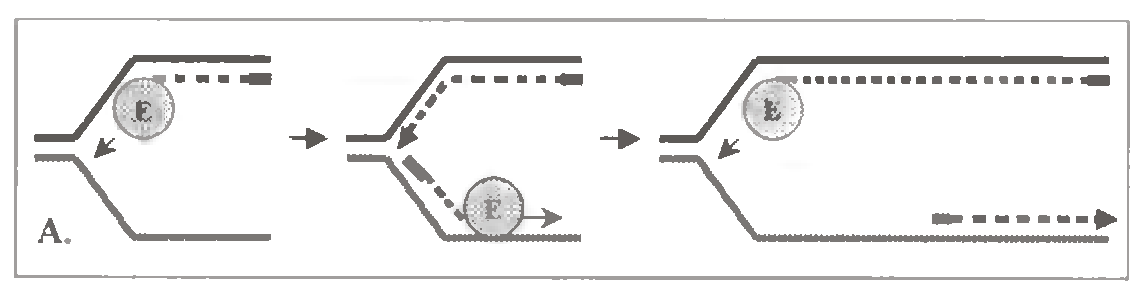
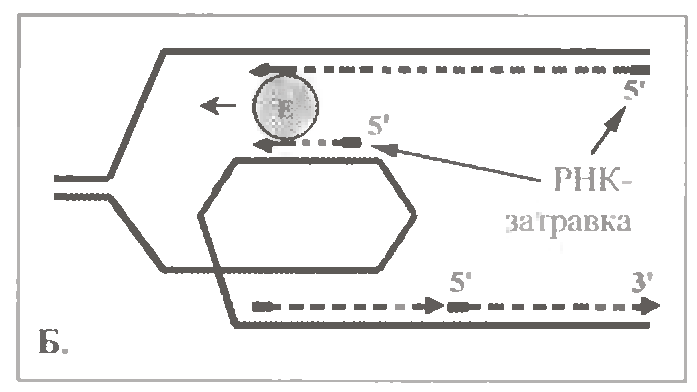
По одній з них (мал. 1.15, А), ферментний комплекс періодично припиняє утворення лідируючого ланцюга, переходить на другий батьківський ланцюг і синтезує черговий фрагмент Оказаки ланцюга, що запізнюється. Потім знову повертається на перший батьківський ланцюг і продовжує подовжувати лідируючий ланцюг ДНК, що будується.
За іншою версією (мал. 1.15, Б), на другому ланцюзі батьківської ДНК (матриці ланцюга, що запізнюється) в процесі реплікації формується петля. Тому напрям утворення фрагмента Оказаки на внутрішній ділянці петлі починає співпадати з напрямом руху полімеразного комплексу. Тоді останній може практично одночасно утворювати відразу обидва ланцюги ДНК - і що лідирує, і що запізнюється.
Можливо, з цим пов'язаний той факт, що бактеріальна ДНК полимераза III є димером, а у еукаріот α- і δ-ДНК-полімерази утворюють єдиний комплекс. Але і при такому механізмі ланцюг, що запізнюється, як неважко переконатися, не може утворюватись безперервно, а тільки у вигляді фрагментів.
Ферменти, що завершують реплікацію ДНК
В результаті дії усіх попередніх ферментів кожний новосинтезований ланцюг виявляється таким, що складається з фрагментів, що впритул примикають один до одного.
"Зшивання" сусідніх фрагментів здійснюється ДНК-лігазою (Л на мал. 1.11). Як і ДНК-полімерази, цей фермент утворює міжнуклеотидний (фосфодиефирний) зв'язок.
Але якщо в полімеразній реакції одним з учасників є вільний дНТФ (дезоксирибонуклеозидтрифосфат), то в ДНК-лигазній реакції обидва учасники - кінцеві дНМФ (дезоксирибонуклеозидмонофосфати) у складі "зшитих" фрагментів.
З цієї причини енергетика реакції інша, і вимагає зпряжений гідроліз молекули АТФ.
Відмітимо також, що ДНК-лігаза "зшиває" тільки такі одноланцюгові фрагменти, які знаходяться у складі дволанцюгової ДНК.
Але і це ще не усе. Молекула ДНК виявиться реплікованою не повністю, якщо не станеться спеціальний процес реплікації її кінців, або теломерних ділянок.
У цьому процесі ключову роль грає фермент теломераза, до якого останніми роками прикована увага багатьох дослідників. Тому розглянемо цей фермент і пов'язані з ним питання детальніше.
