
- •6.040102 Біологія
- •Витяги з окх, опп спеціальності Мета та завдання навчальної дисципліни
- •Програма навчальної дисципліни
- •3. Структура навчальної дисципліни
- •Конспект лекційного заняття
- •1. Предмет і значення органічної хімії
- •2. Теорія хімічної будови органічних сполук.
- •3. Хімічна будова органічних сполук.
- •4. Вивчення будови і властивостей органічних сполук
- •5. Класифікація органічних молекул
- •Конспект лекційного заняття
- •1. Номенклатура органічних сполук
- •2. Правила складання назв органічних сполук
- •Ізомерія органічних сполук
- •Просторова будова органічних молекул
- •Конспект лекційного заняття
- •Основні характеристики ковалентного зв’язку в органічній молекулі
- •Поняття про взаємний вплив атомів
- •Індукційний ефект в органічних молекулах
- •4. Мезомерний ефект в органічних молекулах
- •Конспект лекційного заняття
- •Конспект лекційного заняття
- •1. Гомологічний ряд алканів та циклоалканів.
- •2. Номенклатура та ізомерія
- •1. У молекулі вуглеводню вибирають основний – найдовший і найскладніший (який має найбільше число відгалужень) – карбоновий ланцюг:
- •Крім того для насичених вуглеводнів характерна ізомерія положення замісників.
- •3. Хімічні та фізичні властивості.
- •4. Добування алканів та циклоалканів.
- •Конспект лекційного заняття
- •1. Гомологічний ряд та ізомерія алкенів.
- •Добування та застосування алкенів.
- •Фізичні та хімічні властивості алкенів.
- •Гомологічний ряд та ізомерія алкадієнів
- •Добування та застосування алкадієнів
- •Фізичні та хімічні властивості алкадієнів
- •Гомологічний ряд та ізомерія алкінів.
- •Добування та застосування алкінів.
- •Фізичні та хімічні властивості алкінів.
- •Конспект лекційного заняття
- •Моногалогенопохідні насичених вуглеводнів або галогеналкіли
- •Дигалогенопохідні насичених вуглеводнів
- •Окремі представники полігалогенопохідних
- •Галогенопохідні ненасичених вуглеводнів
- •Лекція №8 Нітросполуки аліфатичного ряду Основні поняття
- •План лекційного заняття
- •Література :
- •Конспект лекційного заняття:
- •Сульфокислоти і сульфохлориди
- •Аміни аліфатичного ряду
- •Моноаміни
- •Конспект лекційного заняття
- •1. Номенклатура та ізомерія спиртів
- •2. Добування та застосування
- •3. Властивості спиртів.
- •Ненасичені спирти
- •Двоатомні спирти, або гліколі
- •Триатомні спирти, або гліцерини
- •Конспект лекційного заняття
- •Конспект лекційного заняття
- •Конспект лекційного заняття
- •Конспект лекційного заняття
- •Вимоги безпеки перед початком роботи
- •Вимоги безпеки після закінчення роботи
- •Вимоги безпеки в екстремальних ситуаціях
- •2.Хімічний посуд і лабораторне обладнання
- •Лабораторна робота №1 Якісний елементний аналіз органічних сполук
- •Лабораторна робота №2 Одно-, двох- і трьохатомні спирти. Етери.
- •Лабораторна робота №3 нітросполуки і аміни аліфатичного ряду
- •Лабораторна робота №4 Етиленові вуглеводні ( алкени ).
- •Лабораторна робота №5 Ацетиленові вуглеводні ( алкіни )
- •Лабораторна робота №6 Дієнові вуглеводні (алкадієни). Каучуки
- •28.Розпізнавання каучуків.
- •Лабораторна робота №7 Альдегіди і кетони аліфатичного ряду
- •Лабораторна робота №8 Дикарбонові кислоти та їх похідні
- •Лабораторна робота №9 Гідрокси- і амінокислоти
- •Лабораторна робота №10 Кетокислоти.Ацетооцтовий естер
- •Лабораторна робота №11 Терпени
- •Лабораторна робота № 12 Моносахариди
- •Лабораторна робота №13 оліго- і полісахариди
- •Лабораторна робота № 14 Бензен і його гомологи
- •Лабораторна робота № 15 Галогено-, нітро- і сульфопохідні бензенового ряду
- •Лабораторна робота № 16 феноли і ароматичні спирти
- •Лабораторна робота 17 Ароматичні альдегіди і кетони
- •Лабораторна робота № 18 Ароматичні карбонові кислоти
- •Лабораторна робота №19 Ароматичні аміни
- •Лабораторна робота № 20 Діазо- і азосполуки
- •Лабораторна робота № 21 п’ятичленні гетероцикли з одним гетеро атомом
- •Лабораторна робота№ 22 Шестичленні гетероцикли з одним гетероатомом
- •Навчально – методичні матеріали для проведення самостійних робіт
- •Засоби діагностики навчальних досягнень студентів Методи навчання
- •Завдання для мкр
- •4. Написати основні способи добування сульфокислот і сульфохлоридів Завдання для ккр
- •Іі. Алкани, алканоли, та аміни аліфатичного ряду та їх похідні
- •Ііі. Ненасичені вуглеводні
- •VII. Ароматичність. Галогено-, нітро- і сульфопохідні бензолу і його гомологів. Феноли.
- •VIII. Поліциклічні ароматичні вуглеводні. Ароматичні аміни та оксосполуки. Карбонові кислоти ароматичного ряду
- •IX. Гетероциклічні сполуки
Поняття про взаємний вплив атомів
Важливою властивістю ковалентних зв’язків, яка визначає можливість, легкість і напрямок перебігу реакцій, є їх поляризація; Вона полягає у перерозподілі густини електронного заряду вихідної молекули під впливом замісника або зовнішнього електромагнітного поля. Це виражається у зміні величини дипольних моментів як окремих зв’язків, так і всієї молекули. Зміщення електронної густини ковалентного зв’язку, зумовлене, наприклад, різною здатністю атомів, що його утворюють, притягати і утримувати електронний заряд, спричинює (індукує) поляризацію сусідніх зв’язків. Розрізняють два механізми такої поляризації – шляхом індукційного та мезомерного ефектів. Останній називається також ефектом спряження.
Індукційний ефект в органічних молекулах
Індукційний ефект – вид взаємного впливу атомів, який проявляється у постійній поляризації простих -зв’язків у молекулі по ланцюгу під впливом замісника. Завдяки різниці в електронегативності зв’язок між таким замісником і С-атомом відповідного вуглеводню поляризується. Це зумовлює поляризацію сусідніх зв’язків, яка передається по ланцюгу атомів у молекулі. Здійснюється індукційний ефект в одному напрямку і швидко згасає в міру віддалення від замісника, що його викликав. Це виражається у поступовому зменшенні величини часткового заряду атомів уздовж ланцюга і пояснюється малою рухливістю електронів -зв’язку. Наприклад, у молекулі 1-хлорпропану +<+<+:

Якщо замісник електроноакцепторний, тобто зміщує електронну густину на себе, то ефект вважають негативним і позначають -І. У випадку електронодонорного замісника його ефект вважають позитивним і позначають +І. За силою і напрямом індукційного ефекту замісники можна розташувати в ряді
-І-ефект (СН3)3N+ > NO2 > СN > СО > Р > Сl > Вг > І > > ОН > NН2 > Н;
+I-ефект Н < СН3 < С2Н5 < ізо-С3H7 < n-С3H7 < С(СН3)3.
Стандартом для порівняння в цих рядах є Гідроген. Індукційний ефект впливає на властивості органічних сполук, що можна проілюструвати на прикладі зміни константи іонізації у хлорзаміщених масляної кислоти, де хлор виявляє -І-ефект:
Масляна кислота.........................1,54 10-5
-Хлормасляна кислота.............1,39 10-5
-Хлормасляна кислота................8,9 10-5
-Хлормасляна кислота................3,0 10-5.
Прикладом впливу індукційного ефекту на напрямок хімічних реакцій є приєднання галогеноводнів до несиметричних етиленових і ацетиленових вуглеводнів за правилом Марковникова, що зумовлене -І-ефектом алкільних радикалів:

Індукційний ефект проявляється в різних фізичних і хімічних властивостях сполук. Особливо позначається його вплив на силі кислот і основ. Вище було розглянуто, як заміна одного атома Гідрогену в оцтовій кислоті на Хлор привела до посилення кислотних властивостей. Заміна другого і третього атомів Гідрогену в метильній групі атомом Хлору ще сильніше підвищує силу кислот:
|
Ка |
СН3СООН |
1,82·10-5 |
СН2СlСООН |
155·10-5 |
СНСl2СООН |
5000·10-5 |
ССl3СООН |
30000·10-5 |
Ця властивість індукційного ефекту одержала назву адитивність (англ. addition – доповнення, додавання).
Зміщення електронів σ-зв’язків по мірі віддалення від замісника, що його викликав, зменшуються. Індукційний ефект поступово затухає по мірі розповсюдження. Це видно при порівнянні констант дисоціації монохлормасляних кислот:
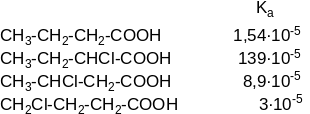
Оскільки карбоксильна група (–СООН) проявляє –І-ефект, то перша константа дисоціації двохосновних кислот буде тоді більша, коли дві карбоксильні групи будуть розташовані ближче одна до одної:

Сила основ залежить від їх здатності сполучатися з протоном кислоти за рахунок неподіленої електронної пари, яку має кожна основа:
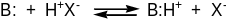
Природно, що вплив електронної природи замісників на силу основ протилежний їх впливові на силу кислот. Електронодонорні замісники підвищують основні властивості, а електроноакцепторні – зменшують їх. Саме тому триметиламін є більш сильною основою, ніж амоніак, трифеніламін є дуже слабою основою, а (CF3)3N взагалі не проявляє основних властивостей.
Наявність полярних зв’язків чітко проявляється в дипольних моментах сполук. Дипольним моментом μ називається добуток величини заряду на відстань між електричними центрами тяжіння позитивних і негативних зарядів у молекулі. Дипольний момент виражається в одиницях Дебая (D). Один Дебай дорівнює 1·10-18 електростатичних одиниць.
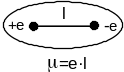
Вимірювання дипольних моментів великої кількості органічних сполук показало, що дипольні моменти гомологічних аліфатичних сполук з однією функціональною групою дуже близькі між собою і, очевидно, визначаються цією групою. Дипольні моменти всіх нормальних одноосновних карбонових кислот від оцтової до стеаринової однакові і дорівнюють 0,8 D. Дипольні моменти одноатомних аліфатичних спиртів мають значення в межах 1,6-1,7 D, дипольні моменти кетонів складають 2,8 D.
Дипольний момент є величиною векторною, тому дипольний момент молекули знаходять як векторну суму дипольних моментів усіх зв’язків даної молекули з врахуванням її геометричної будови. Деякі симетричні молекули не мають дипольного моменту не зважаючи на те, що містять полярні зв’язки. Це означає, що вектори взаємно врівноважуються. Дипольний момент хлорметану дорівнює 1,86 D. Він являє собою рівнодіючу трьох зв’язків С–Н і одного зв’язку С–Сl. У дихлорметану дипольний момент зменшується до 1,59 D, бо вектори двох зв’язків С–Сl направлені в просторі під кутом, близьким до 109°:

Хлороформ (СНСl3) має ще менший дипольний момент (1,0 D), а у ССl4 він відсутній.
Експериментально знайдені величини дипольних моментів сполук можуть дати інформацію про взаємне розташування замісників. Так, наприклад, у динітробензолів пара-ізомер не буде мати дипольного моменту, в той час як орто-ізомер буде мати значний дипольний момент:

Етери (R–O–R), як і вода, мають дипольні моменти, що вказує на їх ангулярну (кутову) будову. Амоніак і всі аліфатичні аміни – полярні сполуки, що є наслідком пірамідальної будови їх молекул.
Окрім індукційного ефекту, що діє вздовж міжатомних зв’язків, існує прямий електростатичний вплив замісника, що діє через простір, на реакційні центри в молекулі. Такий вплив одержав назву ефекту поля (F). У цьому випадку загальний індукційний ефект у ненасичених системах складається з трьох складових: індукційних зміщень σ- і π-електронів, а також ефекту поля:
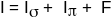
Для насичених сполук, де немає π-електронів, цей вираз спрощується:

Окрім постійного І-ефекту в молекулі під час реакції може виникнути додаткове зміщення електронів внаслідок зміни оточуючого середовища – динамічний індукційний, або індуктомерний ефект. Цей ефект відображує здатність молекули до поляризації.
