
- •Глава 1
- •17 Т/.Ялв
- •Глава 2
- •Глава 3
- •Глава 4
- •Глава 5
- •Глава 6 общая
- •Глава 7
- •Глава 8
- •§ 1Р
- •Глава 9
- •Глава 10 предсердные пароксизмалыные и хронические тахикардии
- •55 Лет, перенес инфаркт миокарда
- •II степени.
- •Глава 11
- •Глава 12
- •I радным ва проведением
- •Глава 13 синдромы предвозбуждения желудочков. Синдром wpw
- •Глава 14
- •Глава 15
- •Глава 16 нарушения
- •Глава 17 фибрилляция и трепетание предсердий
- •Глава 18 парасистолия
- •Глава 1. Система образования и проведения импульса в сердце (проводящая система сердца) ....................••••• 8
- •Глава 7. Изменения автоматизма са узла (синусовые тахикардия, бради-кардия, аритмия) ......................... 142
- •Глава 8. Аритмии, связанные с проявлением активности латентных водителей ритма (кроме тахикардии) ................... 150
- •Глава 10. Предсердные пароксизмальные и хронические тахикардии . . . 203
- •Глава 11. Ав реципрокные пароксизмальные и хронические тахикардии . . 222
- •Глава 12. Желудочковые тахиаритмии: тахикардии, фибрилляция, трепетание .....................••••••••• 277
- •Глава 13. Синдромы предвозбуждения желудочков. Синдром wpw. . . .339
- •Глава 14. Нарушения функций са узла. Синдром слабости са узла. Са блокада. Остановка (отказ) са узла. Остановка предсердий. Межпредсердные блокады ............................. 364
- •Глава 15. Атриовентрикулярные блокады .............. 393
- •Глава 16. Нарушения внутрижелудочковой проводимости — блокады ножек пучка Гиса и их разветвлений ................... 424
- •Глава 17. Фибрилляция и трепетание предсердий ........... 447
- •Глава 18. Парасистолия ..................... 481
Глава 2
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ АРИТМИЙ И БЛОКАД СЕРДЦА (КЛАССИФИКАЦИЯ И ХАРАКТЕРИСТИКА)
К сердечным аритмиям к широком смысле относят изменения нормальной частоты, регулярности и источника возбуждения сердца, а также расстройства проведения импульса, нарушения связи и (или) последовательности между активацией предсердий и желудочков.
Все еще недостаточно познанные причины многочисленных тахи- и брадиаритмий могут быть в самом общем виде объединены в 3 класса:
I. Сдвиги нейрогениой, эндокринной (гуморальной) регуляции, изменяющие течение электрических процессов в специализированных или сократительных миокардиальных клетках.
II. Болезни миокарда, его аномалии, врожденные пли наследственные дефекты с повреждением элект-рогенпых мембран или с разрушением клеточных структур.
III. Сочетанные регуляторныс и органические заболевания сердца.
Нейрогенные аритмии. Нейроген-ным аритмиям мы, в соответствии с их значением и отечественной традицией, уделяем специальный комментарий; другие этиологические факторы представлены при описании отдельных аритмических форм. В этой монографии нет необходимости специально рассматривать вопросы нервно-гуморальной регуляции сердечного ритма, изложенные в известных работах, вышедших в нашей
стране в 70—80-х годах [Уделытов М. Г., 1975; Косицкий Г. И., 1980, 1987; Баевский Р. М., 1981, 1984, 1986; Трубецкой А. В., 1982; Исаков И. И., 1984; Орлов В. В., 1985; Теплов С. И., 1986; Фролькис В. В., 1986; Меерсон Ф. 3., 1981, 1987; Покровский В. М. и др., 1991]. Однако не будет лишним еще раз подчеркнуть, что тесная связь и взаимодействие между двумя отделами вегетативной нервной системы (симпатическим и парасимпатическим) обеспечивает высокий уровень адаптации ритма сердца к потребностям организма. Мы уже упоминали, что ото взаимодействие не сводится только к антагонизму, но, при определенных условиях, носит синергичес-кий характер, на что, в частности, обратил внимание М. Г. Удельнов (1961, 1975).
Кажется естественным предположение, что факторы, изменяющие физиологические соотношения меж-'ду блуждающим и симпатическим нервами, могут явиться причиной нарушения сердечного ритма и проводимости. Как экспериментальные данные, так и клинический опыт подтверждают этот тезис.
В экспериментальных условиях у животных можно вызвать практически любую из известных форм аритмий — от простой синусовой тахикардии до ФЖ, — воздействуя на некоторые отделы мозга: кору, лимбические структуры и в особенности на гипо-таламо-гипофизарнуго систему, с т«>-торой тесно связаны находящиеся в ретикулярной формации продолговатого мозга центры симпатической и парасимпатической регуляции сердечной деятельности [Аршавский В. В. и др., 1976; Ульянинский Л. С. и др., 1978; Бердичевская Е. М., 1981; Buss Т., Evans M., 1984]. Иногда аритмическим сокращениям сердца способствуют и спинальные нервные центры, если они высвобождаются из-под супраспиналъного контроля [Лебедев С. А., 1981].
Приближаются к экспериментальным результаты, получаемые при
стимуляции вегетативных нервов у больных во время хирургических операций па сердце [Murphy D. et al., 1985]. В частности, раздражение симпатических нервов может вызвать ускоренные ритмы АВ соединения и неполную АВ диссоциацию, тогда как стимуляция блуждающего нерва способствует появлению медленных выскальзывающих ритмов А В соединения, что, на фоне угнетения автоматизма СА узла, сопровождается полной АВ диссоциацией [Michel-son E., Medina R., 1985]. Более выраженная «аритмогенность» свойственна левому симпатическому нерву сердца [Schwartz P., 1984].
Клиницистам хорошо известны пейрогенные аритмии. Еще М. В. Яновский (1908) привлек внимание к случаям резкого замедления ритма сердца у больных с опухолями мозга или кровоизлияниями в центры блуждающего нерва. В последующем неоднократно публиковались сообщения о расстройствах сердечного ритма, связанных с заболеваниями головного мозга, особенно часто с нарушениями мозгового кровообращения [ИльинскийБ. В., Астраханцева С. П., 1971; Burch G., 1978].
Большой интерес вызывают спонтанные, психогенные по своей природе, аритмии у больных неврозами, психопатиями, вегетативной дисто-нией [Губачов Ю. М. и др., 1976, 1984; Березин Ф. Б. и др., 1978; Ильина И. Л. и др., 1978; Корвасарский Б. Д., 1980; Маколкин В. И., Аббаку-мов С. А., 1980; Вейн А. М. и др., 1981, 1987; Тополянский В. Д. и др., 1986]. Число аритмий психосоматического генеза в наше время возрастает (их отдельные формы мы рассматриваем в соответствующих главах); возможно, что за терминами «первичная электрическая болезнь сердца», «идиоматические аритмии», к которым прибегают, чтобы объяснить природу аритмий у лиц, не имеющих органических изменений в сердце, скрываются во многих случаях психосоматические (психокардиальные) расстройства сердечного ритма.
Исключительное значение в гепезе аритмий имеет психосоциалъный стресс (дистресс), в особенности тонический [Parker G. et al., 1990]. Состояние страха понижает, например, порог ранимости миокарда желудочков на 40—50%. По данным P. Reich и соавт. (1981), психологический стресс предшествует 20—30% случаев угрожающих жизни сердечных аритмий. Аритмогенные механизмы стресса весьма сложны и пока не выяснены. Вполне возможно, что характерный для него нейровегетативный дисбаланс с выраженной стимуляцией симпатико-адреналовой системы порождает различные аритмии, в их числе самые тяжелые, благодаря прямому воздействию катехолами-нов на миокард [Чазов Е. И., 1971; Янушкевичус 3. И. и др. 1976, 1979; Ганелина И. Е., 1977; Швалев В. Н. и др., 1979; Чурина С. К., 1983; Ви-херт. А. М. и др., 1985; Мазур Н. А., 1985; Cannon V. (Кэннон В.), 1927; Verrier R., 1980, 1987; Lown В., 1981, 1987; Brodsky M. et al., 1987; Schwartz P. et al., 1987; Follick M. et al., 1988]. Еще один проаритмогенный эффект гиперадреналинемии опосре-дуется гипокалиемией — явлением, получившим название «стресс-гипо-калиемия». При этом падение концентрации ионов К+ в плазме происходит быстро, в течение 5 мин, тогда как ее восстановление затягивается на 60—90 мин и завершается значительно позже нормализации уровня адреналина в плазме. У больных, имеющих изменения миокарда, остро возникающая при психоэмоциональных воздействиях гипокалиемия создает угрозу развития самых опасных желудочковых тахиаритмий, в особенности ФЖ — механизма внезапной смерти [Brown M., 1985; Lau-ler D., 1985; Morganroth J., 1985]. Блокаторы р-адренергических рецепторов могут предотвращать гипока-лиемию, вызываемую адреналином, и в какой-то степени — аритмии, зависящие от стресс-гипокалиемии [Brown M., 1985].
Становится общепризнанным и
представление о стресс-ишемии как механизме желудочковых аритмий при остром инфаркте миокарда [Ме-ерсон Ф. 3., 1987; Розенштраух Л. В., 1987]. Заслуживают внимания данные R. Verrier (1987), показывающие, что непосредственно в после-стрессовом периоде сохраняется большая опасность появления угрожающих жизни больных желудочковых тахиаритмий. J. Skinner и J. Reid (1981) сумели с помощью холодовых воздействий на избирательные зоны мозга животного обнаружить нервные тракты, опосредующие аритмо-генные эффекты стресса на сердце. Блокада холодом входной таламиче-ской системы или ее стимулов, идущих от фронтальной коры к стволу мозга, замедляла или предотвращала развитие ФЖ во время стресса.
Фармакологическая или хирургическая симпатэктомия устраняет влияние различных типов стресса на ритм сердца (см. гл. 12); усиливает электрическую устойчивость миокарда к стрессорным влияниям активация блуждающего нерва: тормозится процесс высвобождения норадрена-лина из окончаний симпатических нервов и ослабевает реакция адрено-рецепторов на катехоламины.
Нейрогенными являются бради- и тахиаритмий, связанные с различными фазами сна, нередко регистрируемые у здоровых людей [Аршавский В. В. и др., 1976; Снисаренко А. А., 1976; Варонецкас Г. А., Жемайтите Д. И., 1986; Тихоненко В. М., 1987; Motta J., Guilleminault С., 1985]. В развитии этих нестойких нарушений ритма сердца играет роль лимбико-гипоталамический комплекс [Otsii-ka К., 1985, 1986]. По-видимому, о значении вегетативной нервной системы для возникновения некоторых форм тахиаритмий можно судить по частоте синусового ритма, непосредственно предшествующей эпизоду аритмии [Coumel P. et al., 1987].
Часто встречаются аритмии и блокады сердца рефлекторного генеза. Как будет показано ниже, вагусныо рефлексы при кашле, глотании ни-
щи, натуживании, перемене положения тела могут провоцировать преходящую остановку СА узла, АВ узловую блокаду, экстрасистолию, фиб-рилляцию (трепетание) предсердий, тахикардии [Дощицин В. Л., 1979; Кушаковский М. С., 1984, 1986; Соп-mel P. et al., 1982; Bernasconi M. et al., 1985; Talwar К. et al., 1985]. Поразительным является случай возникновения полной АВ блокады под влиянием зрительного образа пищи [Drake Ch. et al., 1984]. Идет ли речь о простом совпадении? На этот вопрос надо ответить отрицательно, поскольку картина повторялась. Авторы справедливо объясняют такое необычное нарушение проводимости вагуспым рефлексом, связанным с глотанием слюны.
Еще одно звено в цепи доказательств возможного нейрогенного происхождения аритмий — эффективность ряда препаратов, воздействующих на ЦНС, а также блокато-ров периферических р-адренергиче-ских и мускариновых холинорецепто-ров при лечении и профилактике нарушений сердечного ритма и проводимости.
И все же, какими бы ни были при чины аритмий и блокад, сколь слож ными не казались бы пути патологи ческих воздействий на сердце, их ко нечный результат — нарушения фундаментальных био электрических процессов, разыгрывающихся на мембранах спе циализированных клеток [Ходоров Б. И., 1975; Кринский В. И., 1978;
Розенштраух Л. В., 1981, 1982, 1986; Букаускас Ф. Ф., 1983, 1987; Исаков И. И., 1984; Кукушкин Н. И., 1984; Кушаковский М. С., 1984; Самойлов В. О., 1986; Hoffman В., Сга-nefield Р., 1960; Мое G. et al., 1966-1984; Cranefield P., 1975, 1978; Hoffman В., Rosen M., 1981; Wit A., Ro-sen M., 1983; Zipes D. et al., 1983, 1985; Rosen M., 1988].
Растет число сообщений о том, что активность саркоплазматического ре-тикулума в кардиомиоцитах тоже может быть генератором аритмий. В частности, подчеркивается значение ос-цилляторного высвобождения ионов Са++ из саркоплазматического рети-кулума для возникновения желудочковых аритмий во время острой ишемии или реперфузии миокарда. На фоне избытка внутриклеточного Са++ этот процесс активирует транзитор-ный входящий деполяризующий ток (Ti) с флюктуацией мембранного потенциала и образованием постпотенциалов [Богданов К. Ю. и др., 1986; Kass R., Tsien R., 1982; Noble D., 1985; Scholz Н. и Meyer W., 1986; Thandroyen F. et al., 1988].
Ниже приводится составленная нами на основании имеющихся в литературе экспериментальных данных классификация электрофизиологических механизмов сердечных аритмий и блокад и их краткая характеристика. Разумеется, мы отдаем себе отчет в сложности этой развивающейся проблемы и адресуем этот обзор в основном клиницистам-кардиологам.
IT
Нарушения образования импульса:
1) изменения нормального автоматизма СА узла; автоматическая активность замещающих водителей ритма;
2) анормальный автоматизм гипополяризованных специализированных и сократительных клеток;
3) трштерная (наведенная, пусковая) активность специализированных и сократительных клеток: ранние и задержанные постдеполяризации. . Нарушения проведения импульса:
1) простая (физиологическая) рефрактерность;
2) удлинение (патологическое) периода рефрактерности;
3) понижение максимального диастолического потенциала (потенциала покоя) клеточной мембраны; превращение быстрого электрического ответа в медленный;
4) изменения межклеточного электротонического взаимодействия;
а) декрементное (затухающее) проведение;
б) неравномерное проведение;
в) скрытое антеро- и ретроградное проведение;
г) однонаправленная блокада;
д) повторный вход — re-entry: упорядоченное, macrore-entry; случайное re-entry, microre-entry, leading circle; отраженное, reflected re-entry; суммация и ингибирование; 5) фрномен «щели» (окна) в проведении (gap); 0) сверхнормальное (супернормальное) проведение. Т11. Комбинированные нарушения образования и проведения импульса:
1) парасистолическая активность:
а) защитная блокада входа в парацентр;
б) блокада выхода из парацентра;
в) модулирование активности парацентра (изменение частоты или характера его деятельности): ускорение, замедление, подчинение более частому ритму (навязывание ритма, entrainment, linking), подавление, или исчезновение (annihilation — аннигиляция);
2) гипополяризация мембраны автоматических клеток+ускорение диастолической деполяризации (замедление проводимости);
3) гипополяризация мембраны автоматических клеток+смещение порогового потенциала возбуждения к более положительному значению (замедление проводимости).
ФИЗИОЛОГИЧЕСКИЙ (НОРМАЛЬНЫЙ) АВТОМАТИЗМ СА УЗЛА И ЛАТЕНТНЫХ ЦЕНТРОВ
Автоматизмом (а в т о м а т и -о и) называют способность специализированных клеток миокарда спонтанно вырабатывать импульсы (ПД). В основе этого явления лежит мед-лонная диастолическая деполяризация, постепенно понижающая мембранный потенциал до уровня порогового (критического) потенциала, с которого начинается быстрая регенеративная деполяризация мембраны, или фаза О ПД.
В 80-х годах произошли перемены в понимании природы ионных токов, вызывающих спонтанную диастоли-ческую деполяризацию в клетках СА узла и в других автоматических клетках. Изменению взглядов способствовала разработка метода приготовления «малых препаратов» С А узла, на которых' была применена техника фиксирования потенциала — voltage-clamp current [Noma A., Irisawa ТТ., 1976], и создание усовершенствованных методик (patch-clamp current n др.), позволяющих анализировать ионные токи в отдельных клетках
[Пидопличко В. И., Верхратский А. ТТ., 1989; SigworthF. el al., 1980; Brown A. el al., 1981; Reiiler IT. et al., 1985]. В соответствии с современной моделью автоматической (ттейсмекер-пой) активности DiFrancesco—Noble, спонтанная диастолическая деполяризация обязана своим происхождением ионным механизмам, среди которых прежде всего следует назвать неспецифический ток if, переносимый преимущественно ионами Na H, входящими в клетку. Впервые открытый в СА узле кролика, лтот тон окапался во многих отношениях: близким к току i к, которому прежде отводилась ведущая роль в формировании автоматизма в волокнах ITyp кинье. Вопреки старой точке зрения, ток 1|<,,как и ток ir, оказался входящим током, активируемым при гиперполяризации мембраны отрицательнее, чем —50, —60 мВ. Совпадают не только границы активации dthx двух токов, но и их зависимость от изменений внеклеточной концентрации ионов Na+ и К+. Правда, автоматизм СА узла, в отличие от волокон Пуркинье, мало чувствителен к сдвигам внеклеточной концентрации ионов К+ в пределах от 4 до 8— 9 мМ/л, что имеет свое объяснение. Токи if и it., блокируются ионами
Cs++ (цезий), взятьши в небольшой концентрации, и усиливаются под воздействием адреналина [DiFrances-со D., 1981, 1984; Brown H., 1982, 1983; Noble D., 1985].
Хотя для возникновения спонтанной диастолической деполяризации п волокнах Пуркипье решающее значение имеет ток if, в этом процессе участвуют и другие ионные токи, в частности ток ik,, который и определяет зависимость автоматизма волокон Пуркинье от внеклеточной концентрации ионов К+, т. е. угнетение автоматизма при гиперкалиемии (этот ток незначителен в клетках СА узла, поскольку в них мало ik, каналов). В общем, в современной модели автоматизма волокон Пуркипье представлены четыре ионных механизма, зависящие от внеклеточной концентрации ионов К+: а) активация it, усиливающая пейсмекерную активность; б) активация ik,, замедляющая или приостанавливающая пейсмекерную активность; в) активация тока Na—К насоса (ip), тоже замедляющая пейсмекерную активность; г) уменьшение тока ik, что усиливает пейсмекернуго активность.
В клетках СА узла складываются иные соотношения между ионными токами, определяющими их способность к автоматизму. На долю тока if приходится только до 20% этой активности. На передггий план выдвигается задержанный выходящий К+ ток (ik), угнетение которого во времени обеспечивает до 80% автоматической активности [Brown H. et al., 1982]. Разумеется, одними этими токами не ограничиваются сложные процессы, лежащие в основе спонтанного ритмического возбуждения клеток С А узла. Нельзя не упомянуть о токе ica, активация которого представляется необходимой для достижения порогового потенциала
Возбуждения ЭТИХ КЛеТОК, Vm.nx П
амплитуды их ПД [Noble D., 1985]. Клиницистам хорошо известно, как чувствителен синусовый ритм к бло-каторам Са каналов (L-типа) кле-
точной мембраны (верапамил) либо к р-адреноблокаторам (пропранолол), тоже влияющим на эти каналы через катехоламины. При анализе Са механизмов нельзя не учитывать активности Na+-Ka+-MeM6pairaoro насоса, Na+-Ca++-o6MeHnoro механизма, а также роли внутриклеточных систем, обеспечивающих секвестрацию и выделение ионов Са++. Накопление знаний в этой области биофизики происходит интенсивно, что позволит в ближайшем будущем еще больше приблизиться к истине [Noble D., 1985; Hagiwara N. et al., 1988; Levy M., 1990].
С электрофизиологических позиций, интервал меясду сокращениями сердца равен отрезку времени, п течение которого мембранный потепцп-ал покоя в клетках СА узла смещается до уровня порогового потенциала возбуждения. Три механизма оказывают влияние на продолжительность этого интервала и, следовательно, на частоту сердечной деятельности.
Первый из них (наиболее важный) — скорость (крутизна) диастолической деполяризации. При ее возрастании пороговый потенциал возбуждения достигается быстрее п происходит учащение синусового ритма (рис. 5). Противоположный эффект, т. е. замедление спонтанной диастолической деполяризации, ведет к урежению синусового ритма (рис. 6). Следует еще раз подчеркнуть, что С А узел не должен рассматриваться как однородный водитель ритма: в нем имеются группы клеток с различным уровнем автоматизма, и соответственно локализация пейсмекера в пределах СА узла может изменяться.
Второй механизм, оказывающий влияние тта уровень автоматизма СА узла, — изменение мембранного потенциала покоя его клеток (максимального диастолического потенциала). При увеличении этого потенциала (в абсолютных значениях), т. е. при гиперполяризации клеточной мембраны (например, под воздей-
25
~10QL

Рис. 5. Ускорение спонтанной диастолической деполяризации в клетках Пуркинье под воздействием адреналина (no M. Otsuka),
I — до адреналина; П — через 10 мин после добанления адреналина.

Рис. 6. Влияние ацетилхолина на скорость спонтанной диастолической деполяризации в СА узле сердца кролика — замедление деполяризации с образованием длинных пауз (но М. Otsuka).
ствием ацетилхолина), требуется больше времени для достижения порогового потенциала возбуждения, если, разумеется, скорость диастолической деполяризации остается неизменной. Следствием такого сдвига будет уменьшение числа сердечных сокращений в единицу времени.
Третий механизм — изменение порогового потенциала возбуждения. Его смещение по направлению к нулю удлиняет путь диастолической деполяризации и способствует урежению синусового ритма. Приближение порогового потенциала к потенциалу покоя сопровождается учащением синусового ритма. Возможны и различные комбинации трех основных :>лектрофизиологиче-ских механизмов, регулирующих ав-
томатизм СА узла. Соотношение между ними показано на рис. 7, 8.
Преобладание СА узла над остальными водителями ритма, рассеянными в проводящей системе сердца, обеспечивается прежде всего присущим ему более высоким уровнем автоматизма (скоростью спонтанной диастолической деполяризации), что приводит к опережающей разрядке латентных автоматических центров синусовыми импульсами. В этом проявляется «иерархия» автоматизма. Другой фактор, способствующий ведущей роли СА узла, — сверхчастое подавление (overdrive suppression — OS) скрытых пейсмекеров, т. е. временное подавление или угнетение их спонтанной активности после частой разрядки. В основе этого явления лр-

Рис. 7. Механизмы, изменяющие частоту синусового ритма.
Замедление синусового ритма при уменьшении скорости (крутизны) диастолической деполяризации (от а к б).

-20-
-GO-
100 мс
-80-
Рис. 8. Механизмы, изменяющие частоту синусового ритма. Замедление синусового ритма при смещении порогового потенциала (ПП) от ПП-1 до ПП-2 (от б к в); замедление синусового ритма при увеличении максимального диастолического потенциала от а до д (по В. Hoffman, P. Cranefield).
жат уменьшение скорости спонтанной диастолической деполяризации, гиперполяризация автоматических меток и смещение их порогового потенциала возбуждения к менее отрицательным величинам за счет того, что эти клетки подвергаются активации, более частой, чем их собственная частота возбуждения. М. Vassalle (1977, 1985) показал, что торможение автоматизма при OS связано с тем, что Na+-K+-Hacocy мембраны требуется сравнительно много времени для удаления накопившихся в клетках ионов Na+. Еще один механизм, ограничивающий функцию скрытых водителей ритма, — электротоническое взаимодействие между сократительными и автоматическими клетками. В гл. 1 были представлены соображения A. Wit и
P. Cranefield (1982) об электротоническом угнетении автоматизма клеток АВ узла предсердными клетками.
Изменения нормального автоматизма в СА узле или в скрытых автоматических центрах являются причиной возникновения таких аритмий, как: синусовые тахикардия, бради-кардия, аритмия, медленные (замещающие) и ускоренные выскальзывающие комплексы и ритмы (пред-сердные, атриовентрикулярные и идиовентрикулярные), миграция наджелудочкового водителя ритма, А В диссоциация.
АНОРМАЛЬНЫЙ АВТОМАТИЗМ
Впервые этот вид автоматической активности был обнаружен S. Imani-shi (1971) на препаратах волокон Пуркинье. Напомним, что физиологическая спонтанная диастолическая деполяризация в волокнах Пуркинт.р начинается от высокого уровня максимального диастолического потенциала (80—90 мВ) ("high potential automacity"). Она обеспечивает выработку за 1 мин ^30—40 импульсов (при физиологической концентрации ионов К+) и возрастание импуль-сации до 100 в 1 мин под воздействием адреналина. Другая форма спонтанной диастолической деполяризации, названная анормальным автоматизмом, начинается в тех же клетках при их частичной деполяризации, т. е. снижении их максимального диастолического потенциала до 60— 40 мВ ("low potential automacity") [Cranefield P., 1975].
Такого рода явление можно наблюдать в препарате волокон Пуркинье собаки, обработанном бария хлоридом, а также в сохранивших жизнеспособность субэндокардиаль-ных волокнах Пуркинье сердца животного через 24 ч после перевязки венечной артерии и развития острого инфаркта миокарда [Сосунов Е. А. и др., 1990; Dangman К., Hoffman В., 1980, 1985]. Спонтанно возникающим
ПД присущ медленный электрический ответ, что связано с низким уровнем мембранного потенциала покоя поврежденных клеток Пуркинье. Частота же их автоматического ритма лыше физиологической, т. е. свойственной этим клеткам [Gilmonr R., 7л-pes D., 198-1].
Ряду авторов удавалось вызвать анормальную автоматическую активность в частично деполяризованных сократительных клетках предсердий и желудочков [Surawitz В., Imani-shi S., 1976; Katzung B. et al., 1977, 1985]. D. Singer и соавт. (1981) находили аналогичную по характеру активность в ткани предсердий, резецированной у больных, страдавших приступами очаговой (фокусной) ггредсердной тахикардии.
Рассматривая механизмы анормального автоматизма, В. Katzung и соавт. (1985), указывают на то, что его главным компонентом является зависящий от времени выходящий К+ ток ik. Однако имеются данные об участии в этом процессе и входящих в клетку Na+ и Са++ токов. В частности, R. Gilmour и D. Zipes (1984) подчеркивают сходство между ПД, генерируемыми частично деполяризованной клеточной мембраной, и ПД автоматических клеток СА п АВ узлов. Амплитуда тех и других, а также скорость диастолической деполяризации возрастают под влиянием катехоламинов и повышенной концентрации ионои Са++ в среде. Вера-памил, дилтиазем и резкое снижение внеклеточной концентрации ионов Са++ могут полностью подавить анормальную автоматическую активность.
В отличие от физиологического автоматизма, анормальный автоматизм в гипополяризованных волокнах Пуркинье устойчив к сверхчастому подавлению, т. е. после его окончания патологические а втоматические импульсы появляются с прежней или даже с большей частотой. Возможно, что эти различия в быстроте вы-скальзывания нормальных и анормальных автоматических импульсов
следует учитывать в клинике при дифференциальной диагностике двух типов автоматизма. Правда, если сверхчастая стимуляция длится больше 15 с, то автоматизм гиполя-ризованных волокон Пуркиньо тоже оказывается несколько подавленным IDangman К., Hoi'fman В., 198,4; Ro-son M., 1986, 1988].
Реакция неизмененных и гипополяризованных волокон Пуркинье в ответ на одиночный преждевременный экстрастимул имеет общую направленность, однако в количественном отношении она неодинакова. В нормальных волокнах Пуркинье автоматизм временно прерывается с удлинением первого, возвратного, цикла на 30% по отношению к исходной длине цикла. В гипополяризованных волокнах возвратный цикл равен исходному циклу либо лишь слегка длиннее его. В части случаев преждевременные экстрастимулы, попадающие в определенную фазу автоматического цикла, могут вызвать аннигиляцию анормального водителя ритма, т. е. его устранение с внезапным прекращением выработки импульсов. В последующем функция анормального автоматического центра восстанавливается медленно и постепенно. «Аннигиляции» придается, с современной точки зрения, большое значение при объяснении интер-миттирования парасистолии [Jalife J., Anl/elevitchC., 1980].
Допускается, что анормальный автоматизм может быть причиной возникновения не только парасистолип, но и некоторых форм очаговых пред-сердньтх тахикардии, ускоренных ритмов. Возможно, что такой же механизм лежит в основе одной из разновидностей желудочковой тахикардии (ЖТ) в остром тгериоде инфаркта миокарда.
Это относится к очаговой автоматической ЖТ с частотой ритма ^200 в 1 мин, поскольку физиологический автоматизм волокон Пуркинье не может, как уже упоминалось, достигать столь высокого уровня [Crane-field Р., 1975].
ПОСТДЕПОЛЯРИЗАЦИИ И ТРИГГЕРНАЯ (НАВЕДЕННАЯ, ПУСКОВАЯ) АКТИВНОСТЬ
Двумя процессами, названными ностдеполяризациями (afterdepolari-/ations), представлены формы нарушенного образования импульса, но связанные с автоматическими, т. е. самогенерирующими механизмами. Постдеполяризации — это вторичные подпороговые деполяризации (осцилляции мембранного потенциала), которые могут появляться: а) во время 2 и 3 фаз реполяризации ПД — их называют ранними постдеполяризациями; б) непосредственно после окончания ПД — их называют задержанными, или замедленными, постдеполяризациями [Cranefield P., 1975, 1977].
Ранние постдеполяризации. .Можно указать два важнейших условия их возникновения и связанных с ними трштерных ритмов. Первое условие: остановка или замедление реполяри-аации ПД, который начинается от достаточно большого потенциала покоя (между 75 и 90 мВ). Как показали В. Damiano и М. Rosen (1984), изучавшие влияние цезия хлорида на ПД волокон Пуркинье собаки, существуют два подвида ранних постдеполяризаций. Одни из них формируются при задержке реполяризации в фазе 2 ПД, т. е. на уровне мембранных потенциалов от —3 до —ЗОмВ. Другие появляются при задержке реполяризации в фазе 3 ПД, т. е. на уровне мембранных потенциалов от —50 до —70 мВ (рис. 9, 10). Напомним, что при таком же уровне потенциала мембраны может возникнуть анормальная спонтанная диастолическая деполяризация. Однако анормальный автоматизм—следствие частичной деполяризации мембраны, тогда как ранние иостдеполяризации — результат ее неполной реполяризации.
Второе условие возникновения ранних постдеполяризаций и трштерных ритмов — урежепие основного ритма или частоты искусственной

Рис. 10. Ранние постдеиоляризации. Влияние длины цикла стимуляции (CL) на вон иикшшоние ранних ностдшюляризаций и трштерного ритма: но море, удлинения цикла возрастает число ранних лостденоля-риуаций (но В. Damiano, M. Rosen).
стимуляции. В эксперименте можно видеть, как при остановке реполяризации в фазе 2 или 3 ПД сначала регистрируются низкоамплитудные под-пороговые колебания мембранного потенциала, направленные кверху, т. е. в сторону более положительных потенциалов. Если частота основного ритма понижается, то происходит постепенное возрастание амплитуды ранних постдеполяризаций (в основном второго подвида). Достигнув порога возбуждения, одна из них вызывает образование нового ПД еще до окончания исходного ПД. Этот преждевременный ПД рассматривается
как триггерный, наведенный, ш>~ скольку он обязан своим возникновением ранней постдеполяризации, исходящей от основного ПД. В свою очередь, второй (наведенный) ПД может за счет своей ранней постдеполяризации вызвать третий, тоже триггерный ПД, а третий ПД стимулирует четвертый триггерный ПД и т. д. Следовательно, закрепляется пусковая ритмическая активность клеточной мембраны с различным числом импульсов. Надо учитывать, что при чрезмерном урежении основного ритма (или частоты стимуляции) амплитуда ранних постдеполяризаций начинает понижаться, и вероятность появления триггерного ритма уменьшается [Rosen M., 1986].
Триггерный ритм, вызванный ранними постдеполяризациями, не подвергается сверхчастому подавлению при коротком периоде стимуляции, но он может быть подавлен при более продолжительном периоде сверх частой стимуляция. Преждевременным экстрастимулом удается устранить такой триггерный ритм, если происходит гиперполяризация мембраны. В общем, триггерные ритмы этого типа исчезают в тот момент, когда по какой-либо причине полностью завершается процесс реполяризации, т. е. мембранный потенциал возвращается к своей максимальной физиологической величине (75—90 мВ).
Естественно, возникает вопрос о причинах, ведущих к задержке реполяризации, образованию ранних постдеполяризаций и триггерных ПД. Ответ мы находим в исследованиях D. Gadsby и P. Granefield (1977), обнаруживших два уровня мембранного потенциала, при которых волокнам Пуркинье свойственна устойчивая электрическая активность. Первый уровень равен —90 мВ, т. е. нормальному потенциалу покоя. Второй уровень соответствует —60 мВ, т. е. зоне триггерной активности. Остановка ре-поляризации на последнем уровне и образование ранних постдеполяризаций являются, согласно экспериментальным данным В. Damiano, M. Ro-
sen (1984), характерным ответом клеток на различные факторы: гиперка-техолемию, гипокалиемию, ацидоз, гипокальциемию, ишемию, воздействие аконитина, N-ацетилновокаина-мида, соталола, цезия хлорида и др. Перерастяжение волокон Пуркинье при большом расширении или аневризме левого желудочка тоже создает условия для триггерных возбуждений.
Полагают, что следствием этих влияний бывает усиление входящего устойчивого деполяризующего тока, чувствительного к ТТХ (так называемого «тока Na+ окна») в фазе плато с удлинением ПД, вместе с торможением фазы 3 реполяризации, что, по-видимому, зависит от изменений тока ik, [Coulombe A. et al., 1985]. Еще раньше P. Cranefield (1977) показал, что колебания потенциала в фазах 2 и 3 реноляризации удается подавить верапамилом; в этом факте проявляется связь ранних постдеполяризаций с электрогенным Na—Са-обменным механизмом [Fischmeister R., Vas-sort G., 1981] и, возможно, с усилением входящего Са++-тока [January С. et al., 1988]. По последним данным, ранние постдеполяризации на уровне потенциалов от 0 до —30 мВ связаны с входящим Са++ током, переносимым через мембранные каналы L-типа [January С., Riddle J., 1989].
Что касается клинического значения ранних постдеполяризаций, то о нем можно судить по результатам исследований J. Brachmann и соавт. (1983). С помощью цезия хлорида они вызывали у собак синусовую бра-дикардию, удлинение интервала Q— Т и плеоморфную ЖТ. Авторы предполагают, что некоторые формы тахи-аритмий у больных с удлинением интервала Q—Т имеют триггерную природу. С. Mendez, M. Delmar (1985) подчеркивают роль этого механизма и формировании парасистолических очагов.
Задержанные постдеполяризации. Это электрические осцилляции в фазе 4 ПД, которым, как правило, предшествует гиперполяризация клеточ-

ной мембраны [Cranefield P., 1977]. Они изучены лучше, чем ранние постдеполяризации. Последовательность событий здесь такая же, как и при ранних постдеполяризациях. Подпо-роговое, демпфированное колебание мембранного потенциала себя не проявляет. Если же его амплитуда возрастает, достигая порога возбуждения, то возникает наведенный импульс—новый, преждевременный ПД (рис. 11). Этот ПД может, в свою очередь, быть источником другой пороговой осцилляции — ПД и т. п. В конечном счете формируется цепь триггер-ных возбуждений.
В эксперименте отмечено, что увеличение амплитуды задержанных ностдеполяризаций происходит тогда, когда в клетках повышается концентрация ионов Caf+. Медленный входящий Са++-ток не втянут непосредственно в этот процесс. Задержанные постдеполяризации генерируются «транзиторным входящим током», (iti), переносимым ионами Na+ и частично К+, но регулируемым внутриклеточной концентрацией ионов Са++, на которую влияет вхождение ионов Са++ в клетку [Marban E., Tsi-en R., 1982; Marban E., Smith Т., 1986; Gintant G., 1988].
Триггерную активность, вызываемую задержанными постдеполяризациями, изучали в волокнах Пуркинье, на которые воздействовали токсическими дозами сердечных гликозидов [Verrier G., 1977; Moak J., Rosen M., 1984], в предсердных клетках коро-
нарного синуса, обработанных кате-холаминами [Wit A., Cranefield P., 1977; Wit A. et al., 1981], при экспериментальном инфаркте миокарда [Le Marek H. et al., 1985; Kimura S. et al., 1987], в предсердных и желудочковых волокнах человека in vitro [Dangman К. et al., 1982]. В 1988 г. S. Priori и соавт. впервые продемонстрировали in vivo (у кошек), что задержанные постдеполяризации можно вызвать путем раздражения левого звездчатого ганглия.
В отличие от ранних постдеполяризаций, возникновению (усилению) которых способствует брадикардия, задержанные постдеполяризации стимулируются учащением сердечного ритма. Это, по-видимому, происходит при синусовой тахикардии у больных с гипертрофией левого желудочка, кардиомиопатиями, ишемией миокарда. Вероятно, такой же характер носит «триггерный взрыв» — возникновение осцилляторной активности у некоторых больных вслед за периодом сверхчастой или программированной электрической стимуляции сердца [Wit A., Rosen M., 1983]. Весьма вероятно, что триггерную природу имеют ЖТ, вызываемые физической нагрузкой у больных без ИБС и других органических заболеваний сердца (см. стр. 309).
Триггерные ритмы, связанные с интоксикацией дигиталисом (волокна Пуркинье) и зависящие от воздействия адреналина на предсердные клетки коронарного синуса, имеют как
сходство, так и различия [Johnson N. el a)., 1986]. В лервом случае, по-видимому, сразу же устанавливается постоянная частота эктопического ритма; во-втором — отмечается постепенное укорочение длины циклов, т. е. «разогрев» ритма с последующей его стабилизацией. Дигиталисно-токсиче-ские триггерные ритмы могут прерываться остро. Триггерный ритм, исходящий из коронарного синуса, замедляется постепенно («охлаждение») до момента исчезновения. Правда, эти факты еще нуждаются в дальнейшем клиническом подтверждении.
Имеет смысл рассмотреть некоторые вопросы дифференциальной диагностики триггер-ных, анормальных автоматических и реципрокных (re-entry) ритмов в экспериментальной работе и в процессе клинических электрофизиологических исследований. Пока эта проблема не может считаться решенной, но мы усматриваем определенную пользу в систематизации имеющихся в литературе электрофизиологических данных, что должно приблизить нас к распознаванию механизмов аритмий у больных. Что касается задержанных постдеполяризаций и триггер-ных ритмов, то мы использовали в основном результаты, получаемые при дигиталисной интоксикации [Johnson N. et al., 1986; Rosen M., 1986, 1988]:
а) задержанные постдеполяризации (триггерные ритмы) могут быть вызваны одним-двумя преждевременными экстрастимулами, т. е. тем же приемом, что и re-enlry. Однако воспроизводимость тригтерных ритмов при достижении критического интервала экстрастимула обычно ниже 30% (в волокнах Пуркинье), тогда как воспроизводимость re-entry высока [Moak J., Roscn M., 1984]. Кроме того, длина возвратного цикла вслед за преждевременным экстрастимулом, вызвавшим задержанные постдеполяризации, укорачивается по мере уменьшения интервала сцепления экстрастимула (прямая зависимость). При re-entry зависимость об-
ратная: интервал между экстрастимулом и первым тахикардическим комплексом удлиняется при укорочении интервала сцепления преждевременного экстрастимула. Это — важный признак re-entry [Rosen M., 1986, 1988]. С помощью преждевременных экстрастимулов не удается генерировать анормальную автоматическую активность;
б) задержанные постдеполяризации (триггерные ритмы) значительно легче прерываются под воздействием одиночных преждевременных экстрастимулов, чем анормальные автоматические ритмы. Подавление триггерных ритмов, формирующихся в волокнах Пуркинье периинфаркт-ной зоны, достигается более легко с помощью ранних экстрастимулов, чем поздних [El-Sherif N. et al., 1983; Dangman K., Hoffman В., 1985]. Триг-герная активность в мышечных волокнах митрального клапана в равной степени устраняется как ранними, так и поздними экстрастимулами [Wit A., Cranefield P., 1976];
в) электрическая стимуляция длительностью 15 с и длиной цикла около 300 мс быстро прерывает триггерные ритмы, в основе которых лежат задержанные постдеполяризации, например дигиталисно-токсические, но она слабее влияет на анормальные автоматические ритмы, как, впрочем, и на триггерные ритмы, зависящие от ранних постдеполяризаций [Rosen M., 1986].
Еще одно замечание имеет отношение к терминологии. В литературе нередко можно встретить термин «триггерный автоматизм», что, по сути дела, неверно, так как триггерные (наведенные) ритмы не связаны со спонтанной диастолической деполяризацией — автоматизмом.
НАРУШЕНИЯ ПРОВОДИМОСТИ
Движение импульса в сердечном волокне зависит от нескольких взаимодействующих факторов: силы электрического стимула — ПД в возбуж-
денном участке волокна, электрического ответа соседнего еще не возбудившегося участка волокна, межклеточного электротонического взаимодействия, пассивных свойств клеточных мембран, анатомических особенностей строения волокон (их величины, типа, геометрии, направленности). Изменения каждого из этих факторов могут приводить к нарушениям проводимости [Gettes L. et al., 1985].
Нередко причиной медленного проведения или блокады бывает снижение потенциала покоя (максимального диастолического потенциала) в клетках, которым в нормальных условиях свойствен быстрый электрический ответ (клетки Пуркинье, сократительные клетки предсердий и желудочков). Скорость проведения импульса в этих клетках непосредственно связана с крутизной и амплитудой фазы О ПД, т. е. с такими характеристиками, которые определяются процентом открытых быстрых Na каналов мембраны в момент возбуждения и натриевым электрохимическим градиентом (соотношение вне- и внутриклеточной концентраций ионов Na+). В свою очередь, существует тесная зависимость между процентом Na каналов, способных к открытию, и величиной максимального диастоличе-ческого потенциала мембраны. Если под влиянием патологических воздействий он понижается, уменьшается и ПД, соответственно замедляется проведение импульса. Потенциал действия со сниженной фазой 0 за счет инактивации быстрых Na каналов мембраны отражает «подавленный быстрый ответ». При уменьшении потенциала покоя до уровня —50 мВ инактивируется около 50% Na каналов, и возбуждение (проведение) становится невозможным. Возникающие блокады могут быть как однонаправленными, так и двунаправленными.
В части случаев, даже при значительном уменьшении потенциала покоя, проведение импульса сохраняется, правда, резко замедленное. Воз-
буждение клеток, т. е. регенеративная деполяризация мембраны, обеспечивается в этих условиях медленными входящими Са++- и Na+-TOKa-ми, поскольку медленные Са, Са — Na и Na каналы мембраны устойчивы к снижению потенциала покоя. «Быстрые» клетки превращаются в «медленные» клетки с выраженным торможением скорости проведения или с возникновением блокады.
Одной из форм нарушенной проводимости является декрементное (затухающее) проведение, т. е. прогрессирующее замедление проведения в сердечном волокне, по длинни-ку которого постепенно снижается эффективность стимула (ПД) и (или) возбудимость ткани. Этот процесс обычно развертывается в функционально подавленных волокнах, на что обратил внимание еще J. Erlanger (1906), впервые выдвинувший концепцию о декрементном проведении. В 1928 г. F. Schmitt и J. Erlanger предложили модель декрементного проведения: на длинную мышечную полоску, вырезанную из желудочка черепахи, они воздействовали раствором, содержавшим высокую концентрацию ионов К+. Вероятно, такой же характер носят нарушения проводимости в волокнах Пуркинье, сохранившихся после экспериментального инфаркта миокарда, а также блокады в местах соединения волокон Пуркинье с мышечными сократительными волокнами [Bigger J., 1980; Gil-mour R. et al., 1985].
Другая форма нарушенной проводимости представлена неравномерным проведением. Если в параллельно расположенных сердечных волокнах проведение становится декре-ментным, но не в одинаковой степени, то вместо единого фронта возбуждения появляются опережающие и запаздывающие волны. Деполяризация соседних волокон происходит неодновременно, общая эффективность стимула падает, и возможно развитие частичной или полной блокады его проведения.
В 80-х годах рядом авторов подчер-
кивается значение неравномерностеи в распределении межклеточных соединений для возникновения нарушений проводимости [Spach M. et al., 1981, 1982, 1986]. Основанием для такого вывода послужили данные об анизотропности сердечной мышцы и связанным с ней более быстрым проведением импульса вдоль, чем поперек мышечного волокна. Соответственно, общее время открытия Na каналов оказывается более продолжительным, когда импульс проводится вдоль волокна, чем поперек его. Такого же рода неравномерности проявляются в тех участках, где мышечные пучки разветвляются пли соединяются с другими пучками, что и в норме приводит к внезапному замедлению ПД. В патологических условиях при ослаблении деполяризующего тока или межклеточных связей здесь могут возникать блокады.
Гипотеза, развиваемая G. Мое и сотр. [Antzelevitch С., Мое G., 1981; Antzelevitch С. el al., 1985], основывается на многочисленных экспериментальных данных, показывающих, что электротоническое взаимодействие между двумя возбудимыми участками, разделенными небольшой зоной высокого сопротивления, сопровождается резким замедлением проводимости в дистальном участке волокна. Такие факторы, как ограниченная ишемия миокарда, местная высокая концентрация ионов К+, локальное сдавление или охлаждение и другие воздействия могут вызвать невозбудимость небольшого сегмента в сердечном волокне (волокне Пуркинье) и тем самым способствовать электро-тонически опосредованному ступенчатому торможению передачи импульса через невозбудимую зону. По мнению С. Antzelevilch и соавт. (1985), этот механизм играет даже более важную роль в развитии частичных или полных блокад в сердце человека, чем изменения амплитуды ПД или скорости возрастания его фазы 0 (электрический ответ).
Мы кратко рассмотрели особенности механизмов блокирования им-
пульсов. При изложении отдельных форм аритмий будет уделено внимание таким нарушениям, как скрытое проведение, однонаправленные блокады и др. Непосредственное отношение к расстройствам проводимости имеет и повторный вход импульса (re-entry).
ПОВТОРНЫЙ ВХОД ИМПУЛЬСА (RE-ENTRY) И ЕГО КРУГОВОЕ ДВИЖЕНИЕ (CIRCUS MOVEMENT)
Как возможный механизм сердечных аритмий re-entry было распознано еще в начале XX в. [Мауег А., 1906, 1908; Mines G., 1913, 1914; Car-rey W., 1914]. Этим термином обозначают явление, при котором импульс, совершающий движение по замкнутому пути (петле, кругу, кольцу), возвращается к месту своего возникновения и повторяет движение (рис. 12). Фундаментальное изучение re-entry было предпринято F. Schmitt, J. Erlanger (1928) в уже упоминавшихся нами опытах с мышечной полоской из желудочка черепахи, подвергнутой воздействию давления, холода или раствора с высокой концентрацией ионов К+. Авторы, в частности, предположили, что избыток ионов К 1~ в наружной среде вызывает продольное разделение мышцы на два пути с антероградной блокадой проведения по одному из них. Искусственный стимул распространяется аптероградно по другому пути, а затем ретроградно продвигается по ранее блокированному пути к месту стимуляции. Это было первое четкое упоминание о возможности однонаправленного блокирования. Схемы повторного входа, предложенные исследователями для разветвленного и неразветвленного волокна, воспроизводятся с небольшими изменениями на рис. 13.
F. Schmitt, J. Erlanger (1928) указали также, что аналогичный процесс циркуляции может возникать в серд-
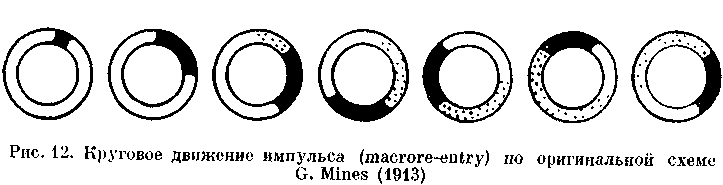



Рис. 13. Оригинальные схемы re-entry, пред- Рис. 14. Схема re-entry вокруг анатомиче- ставленныо F. Schmitt, J. Erlanger (1928) ского препятствия: macrore-entry no M. Al l-повторный вход в разветвленных мышечных lessie (объяснение в тексте), волокнах; II—повторный вход в синцитиальной структуре мышечной полоски.
це млекопитающих в очень небольших петлях, т. е. в форме microre-en-try. В экспериментальных работах, выполненных в 70-х годах, эта гипотеза получила подтверждение [Crane-field P., Hoffman В., 1971; Crane-field P. et al., 1971; Wit A. el al., 1972; Sasyniuk В., Mendez С., 1973]. Например, вызванное концентрированным раствором ионов К+ торможение скорости проведения в волокнах Пуркинье собаки до 0,01—0,1 м/с и укорочение в них периода рефрак-терности сопровождаются уменьшением кольцевого пути повторного входа до очень небольших размеров (^1 мм). Длина волны возбуждения, равная произведению из скорости проведения на длительность рефрактерности, соответствует величине такой минимальной петли reentry.
Современные представления о reentry усложнились, но они по-прежнему основываются на классических данных. Различают: a) macrore-entry (макрориентри), или упорядоченное
(ordered) re-entry; б) microre-entry (микрориентри), или «случайное» (random) re-entry. Разумеется, при таком делении учитывают размеры петли (круга), в которой осуществляется повторный вход. Однако не меньшее значение имеют электрофизиологические особенности каждого из этих двух подвидов re-entry. Мы приводим их описание, основываясь на результатах известных экспериментальных исследований М. Allessie и сотр. (1974—1984).
Для формирования macrore-entry с характерными для него свойствами требуются определенные условия:
а) наличие устойчивой замкнутой петли, длина которой зависит от периметра анатомического невозбудимого препятствия, вокруг которого движется импульс (рис. 14);
б) однонаправленная блокада проведения в одном из сегментов петли re-entry [Quan W., Rudy Y., 1990];
в) длина движущейся волны возбуждения должна быть короче длины петли; благодаря этому перед
фронтом («головой») распространяющегося по кругу импульса всегда имеется участок ткани, вышедший из состояния рефрактерности и восстановивший свою возбудимость; этот сегмент, или «окно возбудимости», имеет протяженность до 20% длины всей петли. Именно в этот «зазор» стараются попасть, нанося экстрастимулы, чтобы прервать круговое движение импульса при реципрокных тахикардиях. Укорочение рефракторного периода клеток, образующих петлю, способствует расширению «окна возбудимости», но оно не оказывает влияния на скорость распространения импульса и частоту ритма. Умеренное удлинение периода рефрактерности суживает «окно возбудимости» тоже без воздействия на скорость движения импульса по петле и на частоту ритма. При значительном удлинении рефрактерности «окно возбудимости» может закрыться, циркулирующая волна наталкивается на участок, находящийся в состоянии функциональной рефрактерности; движение импульса резко замедляется либо прекращается [Feld G. et al., 1986]. Описанный механизм mucrore-entry лежит, как полагают, в основе трепетания предсердий, а также некоторых форм реци-прокной тахикардии [Медвинский А. Б., Перцов А. М., 1989].
При другой разновидности повторного входа — microre-entry — движение импульса происходит по малому замкнутому кольцу, не связанному с каким-либо анатомическим препятствием. Теоретическое обоснование этому процессу было дано еще Th. Lewis (1925). М. Allessie и соавт. производили картографирование левого предсердия кролика в тот момент, когда с помощью электрического экстрастимула была вызвана пред-сердная тахикардия с частотой от 400 до 800 в 1 мин. Регистрацию возбуждения в различных участках предсердия производили как по его периметру, так и по радиусу. Можно было видеть, что импульс совершал не только круговое, но и цептростреми-

Рис. 15. Схема re-entry no малому кругу, не связанному с анатомическим препятствием — leading circle no M. Allessie (объяснения в тексте).
тельное движение в разных направлениях. По мере приближения к центру амплитуда и скорость подъема фазы О ПД понижались, и возбуждение затухало. Клетки в центре циркулировавшей волны давали только локальный электрический ответ, поскольку они поддерживались в рефракторном состоянии под воздействием поступавших с разных сторон импульсов. Место схождения этих импульсов служило функциональной основой для циркуляции волны возбуждения. Оно как бы заменяло анатомическое препятствие и защищало возбуждение от шунтирования (рис. 15).
Такое явление можно сравнить с водоворотом и воронкой в его центре. М. Allessie и соавт. (1977, 1980) назвали эту движущуюся, вращающуюся систему термином leading circle (leading circuit), т.е. «ведущий кружок» (цикл), или ведущая петля microre-entry, которая и определяет частоту возбуждения миокарда предсердий.
В предсердиях может быть несколько таких кругов, и самый меньший из них оказывается ведущим, так как в круге с наименьшим диаметром будет и самое короткое время обращения волны возбуждения. При столь малых размерах круга стимулирующий эффект движущейся волны оказывается достаточным, чтобы возбудить лежащий впереди участок миокарда, еще не вышедший из состояния функциональной рефрактерности. Другими словами, в кольце microre-entry нет «окна», т. е. зоны полностью восстановленной возбудимости; «голова» волны непосредственно следует за ее «хвостом». Длина ведущего круга оказывается равной длине волны возбуждения.
36

Ниже суммированы основные свойства leading circle:
а) размеры ведущего круга не являются фиксированными, они определяются длиной волны возбуждения, которая, в свою очередь, зависит от длительности функционального рефрактерного периода (ФРП) мышечной ткани и от скорости проведения в ней импульса; укорочение ФРП или замедление скорости проведения ведет к сужению (уменьшению) ведущего круга; когда же ФРП удлиняется, а скорость проведения возрастает, ведущий круг увеличивается в размерах; как видно, активность малого круга детерминируется не его длиной, а электрофизиологическими свойствами мышечных волокон, образующих этот круг;
б) в ведущем круге отсутствует участок, полностью восстановивший свою возбудимость; воздействовать на такой круг можно только с помощью стимула, сила которого значительно превышает диастолический порог возбуждения миокарда;
в) частота ритма, вырабатываемого в ведущем круге, обратно пропорциональна длительности ФРП: при его укорочении число импульсов в единицу времени возрастает.
Необходимо упомянуть еще об одном механизме — re-entry в неразветвленном волокне. Речь идет об {(отраженном повторном входе-,) (reflected re-entry). Развивающие эту
концепцию J. Jalife, G. Мое (1981), С. Antzelevitch и соавт. (1985) разработали экспериментальную модель, основу которой составляет электрото-нически опосредованное замедление проводимости. В неразветвленном волокне Пуркинье создается узкая зона (2 мм) функциональной невозбудимости, через которую осуществляется медленное элсктротоническое движение импульса от проксималь-ного к дистальному участку волокна. Если время этого антероградного движения велико, то создаются условия для электротоничсского тока в ретроградном направлении с повторным возбуждением проксимального участка волокна, вышедшего из состояния рефрактерности. Таким образом, импульс движется вперед и назад через один и тот же функционально блокированный сегмент благодаря электротонической передаче, а не вследствие продольного разделения волокна на 2 канала, как предусматривается в более старых моделях.
По-видимому, многие сложные та-хиаритмии, в частности фибрилля-ции, связаны с механизмами microre-entry. Сочетания (иногда весьма причудливые) неправильных петель reentry, лежащих в разных плоскостях, возникают у больных с желудочковыми тахикардиями в остром периоде инфаркта миокарда [Перцов А. М., Фаст В. Г., 1987; El-Sherif N. et al., 1983] (рис. 16).
