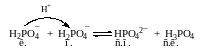- •Дисперсные системы.
- •Классификация дисперсных систем.
- •По степени дисперсности:
- •По наличию физической поверхности раздела между дисперсной фазой и дисперсионной средой:
- •По характеру взаимодействия между дисперсной фазой и дисперсионной средой:
- •По агрегатному состоянию дисперсной фазы и дисперсионной среды:
- •По природе дисперсионной среды:
- •Истинные растворы.
- •Протолитическая теория кислот и оснований.
- •Классификация кислот и оснований.
- •Автопротолиз воды. Ионное произведение воды.
- •Водородный показатель рН
- •Значение рН для химических реакций и биохимических процессов организма.
Протолитическая теория кислот и оснований.
Классическое представление о кислотах и основаниях дает теория Аррениуса. Согласно этой теории:
Кислота – электролит, при диссоциации которого образуется в качестве катиона – ион водорода.
Основание – электролит, при диссоциации которого образуется в качестве аниона – гидроксид-ион.
Однако, эта теория не может объяснить кислотно-основные свойства веществ, таких как аммиак, анилин – проявляющих основные свойства и галогенидов металлов или неметаллов (PCl5), проявляющих кислотные свойства.
Поэтому в 1923 году Бренстедом и Лоури была предложена более общая теория кислот и оснований.
Основные положения протолитической теории:
Кислотно-основные реакции осуществляются за счет переноса протона Н+ от кислоты к основанию.
Реакции, сопровождающиеся переносом Н+, называются протолитическими, а вещества, участвующие в них – протолитами.
Кислота – это протолит, который является донором Н+, т.е. способна отдавать протон.
Кислота, отдавая протон, превращается в основание, которое называется сопряженным.
Кислота ⇄ H+ + сопряженное основание
HCl ⇄ H+ + Cl –
кислота сопр. осн-е
Основание – это протолит, который является акцептором протона H+, т.е. способно принимать протон.
Основание, присоединив H+, превращается в кислоту, которая называется сопряженной.
Основание + H+ ⇄ сопряженная кислота
NН3 + H+ ⇄ NH4+
основание сопр. к-та
Кислота и соответствующее ей сопряженное основание или основание и сопряженная с ним кислота образуют протолитические пары или сопряженные кислотно-основные пары:
HCl - Cl – ; NН3 - NH4+
к с.о о. с.к.
Сила кислоты определяется ее способностью отдавать H+, а сила основания – его способностью присоединять H+. Поэтому сильная кислота, отдав протон, превращается в слабое сопряженное основание, т.е. частицу, плохо присоединяющую протон, а сильное основание – соответственно, в слабую сопряженную кислоту.
В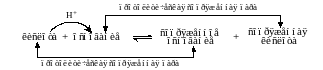 каждой протолитической реакции участвуют
2 пары кислот и оснований и схематически
это можно изобразить так:
каждой протолитической реакции участвуют
2 пары кислот и оснований и схематически
это можно изобразить так:
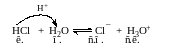
HCl/Cl–, H2O/H3O+

NH3/NH4+, H2O/H3O+
Классификация кислот и оснований.
По теории Бренстеда и Лоури, как видно из примеров, понятия кислоты и основания значительно расширены. Кислотами и основаниями могут быть как молекулы, так и ионы.
Примеры протолитов.
Типы частиц |
кислоты |
основания |
Нейтральные молекулы |
H2SO4, HNO3, HBr, HCl |
H2O, NH3, C2H5OH, CH3NH2 |
Катионы |
NH4+, H3O+, [Cr(H2O)6]3+ |
[Cr(H2O)5(OH)]2+, [Al(H2O)4(OH)2]+ |
Анионы |
HSО4 –, HPО4 2–, HS – |
Cl –, F –, Br –, OH –, СН3СОО – |
Из приведенных примеров видно, что есть вещества или частицы, способные проявлять свойства и кислот и оснований, например вода.
H2О ⇄ H+ + ОН – Н2О + H+ ⇄ H3О+
кислота сопр. осн-е основание сопр. к-та
Протолиты, способные как отдавать протон, так и принимать протон, т.е. обладающие как протонодонорными, так и протоноакцепторными свойствами, называются амфолиты.
К амфолитам относятся: вода, спирты, карбоновые кислоты, жидкий аммиак, гидрид анионы многоосновных кислот и т.д.
Характерной реакцией амфолитов является реакция кислотно-основного диспропорционирования или автопротолиза (самоионизации).