
- •И.Ф. Гарбуз, в.С. Леонтьев, е.Л. Коляда военная, экстремальная токсикология, медицинская защита от химических, радиоактивных и биологических поражений
- •История развития токсикологии
- •Современное состояние и перспективы развития военной и экстремальной токсикологии
- •Предмет, цель, задачи и структура токсикологии
- •Цель и задачи токсикологии
- •Структура токсикологии
- •Токсический процесс
- •Интоксикация (отравление)
- •Медико-тактическая классификация очагов ахов
- •Химическая обстановка
- •Токсикокинетика
- •Токсикодинамика
- •Токсическое действие вещества выражено тем сильнее, чем большее количество активных рецепторов (структур-мишеней) вступило во взаимодействие с токсикантом;
- •Экзотоксический шок и токсикогенный коллапс
- •Общие принципы оказания медицинской помощи пораженным ов и ахов
- •Отравляющие и сильнодействующие ядовитые вещества нервно-паралитического действия
- •Особенности холинергической передачи нервного импульса
- •Отравляющие и сильнодействующие ядовитые вещества кожно-нарывного действия
- •Отравляющие и сильнодействующие ядовитые вещества общеядовитого действия
- •Синильная кислота
- •Окись углерода
- •Нитробензол
- •Сероводород
- •Динитро-орто-крезол
- •Акрилонитрил
- •Отравляющие и сильнодействующие ядовитые вещества удушающего действия
- •Фосген, дифосген
- •Механизм возникновения и развития токсического отека легких.
- •Хлорпикрин
- •Гидразин
- •Отравляющие и сильнодействующие вещества раздражающего действия
- •Отравляющие и сильнодействующие вещества психомиметического (психодислептического) действия.
- •Вещество bz.
- •Диэтиламид лизергиновой кислоты (длк).
- •Основные проявления интоксикации длк у человека (Rothlin)
- •Отравляющие и сильнодействующие ядовитые вещества цитотоксического действия
- •Бромистый метил.
- •Диоксин.
- •Окись этилена.
- •Ядовитые технические жидкости.
- •Этиленгликоль.
- •Острые отравления хлорированными углеводородами.
- •Метиловый спирт.
- •Этанол.
- •Тетраэтилсвинец.
- •Дихлорэтан.
- •Физиология дыхания
- •Гипоксия при острых отравлениях.
- •Кислородная терапия при патологических состояниях. Табельна кислородная аппаратура.
- •Методы искусственной вентиляции легких.
- •Средства индивидуальной и коллективной защиты.
- •Средства защиты органов дыхания.
- •Средства защиты кожи.
- •Коллективные средства защиты.
- •Медицинские средства защиты.
- •Острые радиационные поражения.
- •Возможная структура сан. Потерь при ядерном взрыве мощностью 20 Кт.
- •Мтх очагов при применении яо (ю.М. Полумисков, и.В. Воронцов, 1980).
- •Острая лучевая болезнь.
- •Механизм возникновения и развития лучевых поражений.
- •Действие ии на нуклеиновые кислоты, белки, жиры и углеводы.
- •Влияние ии на обмен веществ и биоэнергетику клетки.
- •Действие ии на нервную систему и железы внутренней секреции.
- •Механизмы развития важнейших радиационных синдромов.
- •Клиническая характеристика острой лучевой болезни от внешнего облучения.
- •Классификация острой лучевой болезни.
- •Характеристика олб I степени.
- •Характеристика олб III степени.
- •Характеристика олб IV степени.
- •Особенности биологического действия нейтронов.
- •Биологическая дозиметрия.
- •Профилактика и принципы лечения острой лучевой болезни.
- •Характеристика средств и методов профилактики лучевых поражений, применяемых в войсках.
- •Классификация и механизмы действия радиопротекторов.
- •Профилактика лучевых поражений при внутреннем заражении.
- •Принципы лечения олб
- •Профилактика и лечение первичной реакции.
- •Лечение основных синдромов.
- •Радиационная и химическая разведка в частях и подразделениях медицинской службы.
- •Организация и средства проведения специальной обработки.
- •Предельно допустимые значения степени загрязнения радиоактивными веществами поверхностей различных объектов
- •Состав, назначение и способы применения дегазирующих и дезактивирующих растворов и рецептур
- •Частичная специальная обработка.
- •Полная специальная обработка. Организация работы отделения специальной обработки (осо).
- •Способы дегазации основных видов медицинского имущества.
- •Способы дезактивации основных видов медицинского имущества.
- •Литература
- •Оглавление
Токсическое действие вещества выражено тем сильнее, чем большее количество активных рецепторов (структур-мишеней) вступило во взаимодействие с токсикантом;
токсичность вещества тем выше, чем меньшее его количество связывается с "немыми" рецепторами, чем эффективнее оно действует на активный рецептор (структуру-мишень), чем большее значение имеет рецептор и повреждаемая биологическая система для поддержания гомеостаза целостного организма.
Любая клетка, ткань, орган содержат огромное количество потенциальных рецепторов различных типов ("запускающих" различные биологические реакции), с которыми могут вступить во взаимодействие лиганды. С учетом вышесказанного, связывание лиганда (как эндогенного вещества, так и ксенобиотика) на рецепторе данного типа является избирательным лишь в определенном диапазоне концентраций. Увеличение концентрации лиганда в биосистеме приводит к расширению спектра типов рецепторов, с которыми он вступает во взаимодействие, а следовательно, изменению его биологической активности. Это также одно из фундаментальных положений токсикологии, доказанное многочисленными наблюдениями.
Мишенями (рецепторами) для токсического воздействия могут быть:
структурные элементы межклеточного пространства;
структурные элементы клеток организма;
структурные элементы систем регуляции клеточной активности.
Каждая клетка организма окружена водной средой - интерстициальной или межклеточной жидкостью. Для клеток крови межклеточной жидкостью является плазма крови. Основные свойства межклеточной жидкости: её электролитный состав и определенное осмотическое давление. Электролитный состав определяется главным образом содержанием ионов Na+, K+, Са2+, Cl-, HCO3- и др.; осмотическое давление - присутствием белков, других анионов и катионов. Межклеточная жидкость содержит многочисленные субстраты для клеточного обмена, продукты метаболизма клеток, молекулы-регуляторы клеточной активности.
Попав в межклеточную жидкость, токсикант может изменять её физико-химические свойства, вступать в химическое взаимодействие с её структурными элементами. Изменение свойств межклеточной жидкости немедленно приводит к реакции со стороны клеток.
Возможны следующие механизмы токсического действия, обусловленные взаимодействием токсиканта с компонентами межклеточной жидкости:
Электролитные эффекты. Нарушение электролитного состава наблюдается при отравлении веществами, способными связывать ионы. Так, при интоксикациях фторидами некоторыми комплексообразователями, другими токсикантами (этиленгликолем, метаболизируящим с образованием щавелевой кислоты), происходит связывание ионов кальция в крови и межклеточной жидкости, развивается острая гипокальциемия, сопровождающаяся нарушениями нервной деятельности, мышечного тонуса, свертывающей системы крови и т.д. Нарушение ионного баланса, в ряде случаев, может быть устранено введением в организм растворов электролитов.
PН-эффекты. Интоксикация рядом веществ, не смотря на высокую буферную емкость межклеточной жидкости, может сопровождаться существенным нарушением кислотно-основных свойств внутренней среды организма. Так, отравление метанолом приводит к накоплению в организме муравьиной кислоты, вызывающей тяжелый ацидоз. Изменение рН интерстициальной жидкости может быть также следствием вторичных токсических эффектов и развиваться вследствие нарушения процессов биоэнергетики, гемодинамики (метаболический ацидоз/алкалоз), внешнего дыхания (газовый ацидоз/алкалоз). В тяжелых случаях нормализовать рН можно, вводя пострадавшему буферные растворы.
Связывание и инактивация структурных элементов межклеточной жидкости и плазмы крови. В плазме крови содержатся структурные элементы, обладающие высокой биологической активностью, способные стать мишенью действия токсикантов. К их числу относятся, например, факторы свертывающей системы крови, гидролитические ферменты (эстеразы), разрушающие ксенобиотики и т.д. Следствием такого действия может стать не только интоксикация, но и аллобиоз. Например, угнетение активности три-о-крезилфосфатом (ТОКФ) карбоксилэстераз плазмы крови, разрушающих фосфорорганические соединеня (ФОС), приводит к существенному повышению токсичности последних.
Нарушение осмотического давления. Существенные нарушения осмотического давления крови и интерстициальной жидкости при интоксикациях, как правило, носят вторичный характер (нарушение функций печени, почек, токсический отек легких). Развивающийся эффект пагубным образом сказывается на функциональном состоянии клеток, органов и тканей всего организма.
Действие токсикантов на структурные элементы клеток
Структурными элементами клеток, с которыми взаимодействуют токсиканты, как правило, являются:
белки;
нуклеиновые кислоты;
липидные элементы биомембран;
селективные рецепторы эндогенных биорегуляторов (гормонов, нейромедиаторов и т.д.).
Взаимодействие токсикантов с белками
Основные функции белков: транспортная, структурная, энзиматическая (белки - биологические катализаторы). Токсический эффект может развиваться при нарушении каждой из этих функций.
Нарушение свойств белков химическим веществом возможно различными способами, зависящими как от структуры токсиканта, так и от строения и функций белка. Возможны: денатурация белка, блокада его активных центров, связывание активаторов и молекул, стабилизирующих протеин, и т.д.
К числу веществ, денатурирующих белки, относятся крепкие щелочи, кислоты, окислители, ионы тяжелых металлов. В основе денатурации лежит повреждение внутрибелковых связей, поддерживающих вторичную, третичную структуру протеина. При этом наиболее часто токсиканты взаимодействуют с СООН-, NH-, OH-, SH-группами аминокислот, образующих белки. Многочисленные токсиканты, связывающиеся с SH-группами, называются тиоловыми ядами. К числу тиоловых ядов прежде всего следует отнести тяжелые металлы, такие как ртуть, мышьяк, сурьма, таллий, органические соединения этих металлов (метилртуть, люизит и т.д.). Другие металлы более активно взаимодействуют с карбоксильными группами (свинец, кадмий, никель, медь, марганец, кобальт).
Особое значение в токсикологии придают действию ксенобиотиков на энзимы.
Энзимы
Роль энзимов в обеспечении процессов жизнедеятельности огромна. Неудивительно, что вещества, модулирующие их активность, обладают высокой биологической активностью, порой являются высокотоксичными веществами.
Энзимы
- это белки, выполняющие функции
биологических катализаторов. Они
ускоряют достижение состояния равновесия
обратимых экзергических реакций, типа:
АВ ![]() А
+ В, путем снижения энергии активации
субстратов. Высокая энергия активации
многих экзергических реакций препятствует
их протеканию в условиях температурного
режима организма. Примером таковых
является расщепление перекиси водорода. in
vitro предварительное
нагревание увеличивает кинетическую
энергию молекул Н2О2,
что и инициирует процесс, который, будучи
экзотермическим, в дальнейшем сам
поддерживает свое течение. В условиях
организма связывание перекиси водорода
энзимом пероксидазой приводит к снижению
энергии активации, что обеспечивает
прохождение реакции в условиях температуры
тела.
А
+ В, путем снижения энергии активации
субстратов. Высокая энергия активации
многих экзергических реакций препятствует
их протеканию в условиях температурного
режима организма. Примером таковых
является расщепление перекиси водорода. in
vitro предварительное
нагревание увеличивает кинетическую
энергию молекул Н2О2,
что и инициирует процесс, который, будучи
экзотермическим, в дальнейшем сам
поддерживает свое течение. В условиях
организма связывание перекиси водорода
энзимом пероксидазой приводит к снижению
энергии активации, что обеспечивает
прохождение реакции в условиях температуры
тела.
Скорость каталитических превращений веществ в организме определяется специфической активностью энзимов, их содержанием в клетках и тканях, наличием субстратов и регуляторов активности в среде. При нормальных условиях интенсивность процессов поддерживается на определенном уровне. Регуляция осуществляется различными механизмами, среди которых основные - модуляция количества энзимов, их специфической активности, изменение биодоступности субстратов и т.д.
Наиболее часто в основе интоксикации лежит угнетение токсикантом специфической активности энзимов. Выделяют следующие механизмы ингибиторного действия ксенобиотиков:
1. Конкурентное ингибирование. В основе взаимодействия лежит конкуренция токсиканта с субстратом за активный центр энзима. При этом реализуются две возможности:
токсикант вступает в превращение вместо субстрата (конкурентные субстраты). Так, некоторые эфиры холина (пропионилхолин, бутирилхолин и др.) гидролизуются ацетилхолинэстеразой вместо ацетилхолина. Конкурентным ингибитором аконитазы, одного из энзимов цикла трикарбоновых кислот, участвующих в превращении лимонной кислоты в аконитовую, является фторлимонная кислота, образующаяся в процессе метаболических превращений опасного токсиканта фторуксусной кислоты;
взаимодействие токсиканта с активным центром не приводит к его метаболизму (стабильные ингибиторы). Примерами таких токсикантов являются карбаматы - ингибиторы холинэстеразы.
Конкурентный тип ингибирования развивается также при образовании прочных ковалентных связей между токсикантами и активными центрами некоторых энзимов. Этот вид ингибирования приводит к полному прекращению ферментативной активности. Таким способом фосфорорганические соединения взаимодействуют с ацетилхолинэстеразой.
2. Неконкурентное ингибирование. В данном случае токсикант взаимодействует с добавочным, аллостерическим, центром энзима, изменяя при этом конформацию активного центра и снижая, тем самым, его сродство к субстрату. Таким способом упомянутая выше фторлимонная кислота угнетает активность транслоказы, фермента, обеспечивающего активный транспорт цитрата через мембраны митохондрий, а мышьяк и его соединения - SH-содержащие энзимы.
3. Прочие. Для осуществления ферментативной активности энзимы нуждаются в присутствии в среде ионов металлов: Mg2+, Ca2+, K+, Mn2+, Zn2+, Co2+ и др. Связывание этих металлов токсикантами приводит к угнетению активности. Таков механизм токсического действия комплексообразователей (этилендиаминтетрауксусная кислота, дитизон и др.), салициловой кислоты и др. Особое токсикологическое значение имеют вещества, взаимодействующие с железом, кобальтом, медью, входящими в структуру более сложных простетических групп энзимов (гемсодержащие энзимы, цитохромы, каталаза, пероксидаза, гемоглобин, миоглобин). К числу подобных токсикантов относятся цианиды, сульфиды, азиды, монооксид углерода и др.
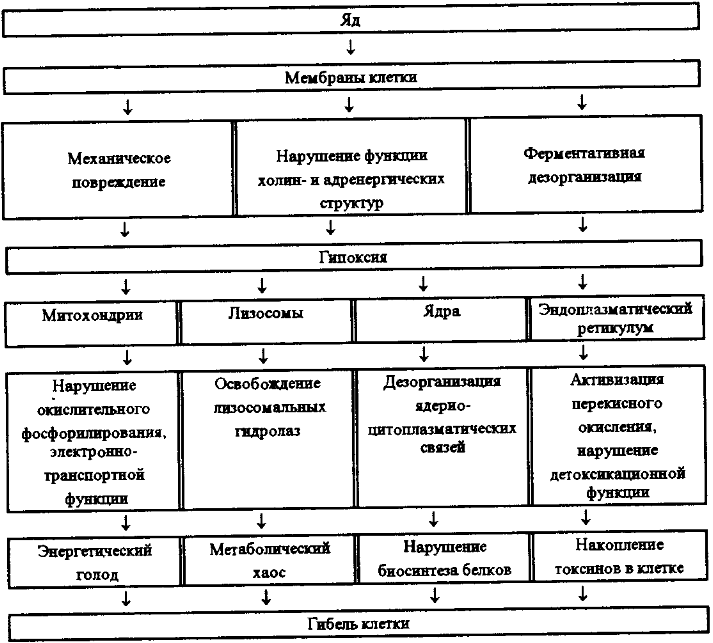
Рис. 15. Схема патогенеза химической болезни (по И.А. Климову).
Некоторые энзимы находятся под постоянным контролем специальных кооперационных систем. Так, система GSH/GSSG (восстановленный/окисленный глутатион) регулирует активность SH-энзимов (пирофосфатаза, фосфоглицеральдегид-дегидрогеназа, гемоглобин-редуктаза и др.). Токсиканты, понижающие содержание восстановленного глютатиона в тканях, такие как гидроксиламин, фенилгидразин, дихлорэтан и др., подавляют активность этих ферментов.
При острых экзогенных отравлениях различают 2 фазы:
Токсикогенную, когда яд находится в организме и оказывает определенное влияние вследствие химической «специфичности».
Соматогенную, когда яд удален из организма, но из-за первичного воздействия развивается неспецифический патологический процесс, который трактуется как осложнение острых отравлений (пневмония, острая почечно-печеночная недостаточность, надпочечниковая недостаточность, расстройство трофики, сепсис и прочие).
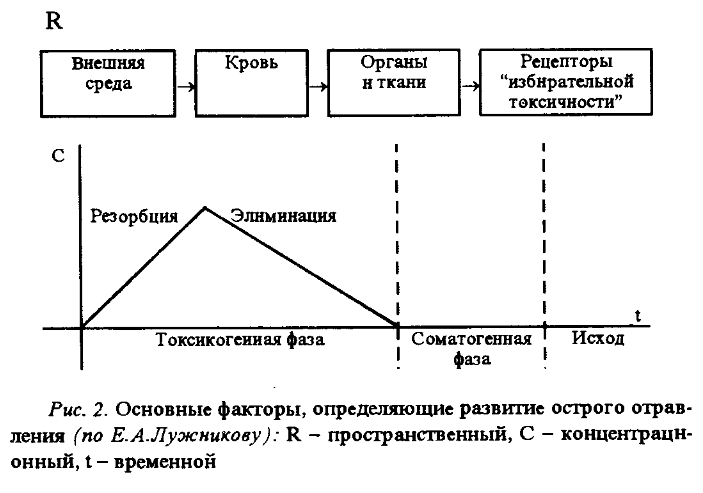
Рис. 16. Основные факторы, определющее развитие острого отравления (по Е.Л. Лужникову): R – пространственный, C- концентрационный, t-временной.
В клинической токсикологии используются различные методы интенсивной терапии с учетом фаз токсикологического процесса.
В клинической практике симптомы отравлений группируют в отдельные синдромы, которые отражают общую реакцию организма на токсическое воздействие и реакцию отдельных жизненно-важных органов и систем.
Синдром являет собой совокупность симптомов отравления, объединенных общим патогенезом (симптомокомплексом).
В клинической токсикологии рассматриваются несколько ведущих патологических синдромов, соответствующих нарушениям функции жизнеобеспечивающих органов и систем при остром отравлении АХОВ (Лужников Е.А., 1977, 1989гг., Могош Г.Н., 1984г. и другие).
Психоневрологический синдром - представляет собой сочетание психоневрологических и соматовегетативных расстройств:
острое психическое состояние при остром отравлении бензолом, тетраэтилсвинцом, хлором, цианатами, ФОС и другими АХОВ.
реактивные состояния и реактивные психозы может быть развитие «массовых истерий и психического шока».
токсическая кома возникает про среднем и тяжелом течении отравлений ацетоном, синильной кислотой, этиловым и метиловым спиртом, углеводородами нефти, ФОС, ХОС, окисью углерода, четыреххлористым углеводородом и другими.
Судорожный синдром может быть результатом специфического воздействия АХОВ (синильная кислота, ФОС, сероводород, бензол, тетраэтилсвинец и др.) и тяжелые нарушения дыхания, гипоксии мозга и при осложнении от отравления окисью углерода или этиленгликолем.
Синдром нарушения дыхания (клинико-патогенетическая классификация гипоксических состояний при острых отравлениях).
Синдром поражения сердечно-сосудистой системы. Причиной летальных исходов при отравлениях, как правило, является сердечно-сосудистая недостаточность (первичный токсикогенный коллапс, экзотоксический шок)
Синдром гепато- и нефропатии. Синдромы поражения печени и почек при отравлении всеми ядами, но к гепатотоксичным или, же печеночным ядом относят: органические кислоты, ацетон, динитробензол, спирты, фенолы, альдегиды, мышьяковистый водород, хлорированные углеводороды, ХОС. К почечным ядам, т.е. нефротоксическим относят этиленгликоль, мышьяковистый водород, дихлорэтан, четыреххлористый углерод, ФОС и другие.
Синдром взаимного отягощения, когда может быть взаимодействие 2-х и более токсоагентов, в результате чего патологические процессы усиливаются.
