
- •Оглавление.
- •Тема 1.
- •Основные параметры состояния газов.
- •Понятие о внутренней энергии газов
- •Первый и второй законы термодинамики. Понятие об энтальпии газа.
- •5. Энтропия.
- •6. Изотермический и адиабатный процессы.
- •7. Круговые процессы изменения состояния газов.
- •8. Цикл Карно.
- •1.) Термический к.П.Д. Зависит исключительно от температуры источника и от температуры холодильника;
- •2.) Термический к.П.Д. Цикла Карно увеличивается при возрастании температуры источника т1 и при уменьшении температуры холодильника т2;
- •9. Регенеративный цикл.
- •10. Водяной пар. Общие положения.
- •Тема 2.
- •Основные определения, классификация, типы паровых котлов.
- •Гост 23172-78 (2005).
- •Котёл паровой е-400-13,8-560кгдт.
- •Типы и конструктивные схемы паровых котлов.
- •2. Поверхности нагрева паровых котлов.
- •Котел тп-14а.
- •3. Тепловой баланс и кпд паровых котлов.
- •Тема 3. Металлы, каркас, обмуровка паровых котлов.
- •Особенности работы металла в паровых котлах.
- •Каркас котла несёт нагрузку лишь при незначительно повышенной температуре.
- •Стали, применяемые в котлостроении.
- •3.Каркас котла.
- •4.Обмуровка котла.
- •Тема 4. Барабан парового котла.
- •Назначение.
- •Изготовление. Устройство.
- •3.Методы получения чистого пара. Внутрибарабанные устройства.
- •Ремонт барабанов.
- •Уступами для удаления повреждённого металла.
- •Более 100мм. А – без подкладного кольца; б – с подкладным кольцом.
- •Ремонт внутрибарабанных сепарационных устройств.
- •Технические условия на капитальный ремонт со 34-38-20184-94 (ту 34-38-20184-94).
- •Барабанных котлов - со 34.26.729.
- •1). Требования к материалам.
- •2). Метрологическое обеспечение.
- •3). Требования к разборке.
- •4). Требования к дефектации. Осмотр сепарационных устройств. Дырчатые пароприёмные потолки.
- •Паропромывочные устройства.
- •Внутрибарабанные циклоны.
- •Штуцера водоуказательных колонок.
- •5). Требования к сборке.
- •6). Технические условия и допуски по сборке сепарационных устройств. Требования к собранному изделию.
- •Тема 5. Экраны парового котла.
- •Назначение.
- •Тема 6. Водяной экономайзер.
- •Назначение.
- •Конструктивные особенности.
- •Ремонт водяных экономайзеров.
- •1) Общее положение.
- •2). Требования к материалам.
- •3). Требования к поставляемым элементам и деталям экономайзера.
- •4). Требования к дефектации.
- •5). Разборка (демонтаж) и ремонт экономайзера.
- •6). Требования к отремонтированному экономайзеру.
- •Тема 7. Пароперегреватель.
- •Назначение и классификация.
- •Конструктивные особенности.
- •3. Ремонт пароперегревателей.
- •1). Общее положение.
- •2). Требования к материалам.
- •3). Требования к поставляемым элементам и деталям пароперегревателя.
- •4). Требования к дефектации.
- •5). Разборка (демонтаж) и ремонт пароперегревателя.
- •6). Требования к отремонтированному пароперегревателю.
- •Тема 8. Регулирование температуры пара.
- •1. Температура перегретого пара и её изменение при работе котла.
- •2.Способы регулирования температуры перегрева пара.
- •Ремонт устройств для регулирования температуры пара.
- •Предельные отклонения размеров в узлах устройств для регулирования температуры пара и способы устранения дефектов.
- •Тема 9. Воздухоподогреватели.
- •Классификация.
- •Конструктивные особенности рекуперативных воздухоподогревателей.
- •3. Ремонт рекуперативных воздухоподогревателей.
- •1). Общие положения.
- •2). Общие технические требования.
- •3). Дефектация. Требования к составным частям.
- •4). Требования к собранному изделию.
- •5). Испытания.
- •6). Гарантии.
- •7). Требования к надёжности.
- •Конструктивные особенности регенеративных воздухоподогревателей. Рис. 9.9.
- •Основные технические данные роторов регенеративных
- •5. Ремонт регенеративных воздухоподогревателей.
- •1). Общие положения.
- •Технические характеристики рвп-54 и рвп-68.
- •2). Общие технические требования.
- •3). Повреждения и порядок ремонта регенеративных воздухоподогревателей.
- •3). Ремонт ротора регенеративного воздухоподогревателя.
- •4). Ремонт уплотнений регенеративного воздухоподогревателя.
- •5). Ремонт кожуха, газовоздушных патрубков и компенсаторов регенеративного воздухоподогревателя.
- •6). Ремонт подшипниковых опор и привода регенеративного воздухоподогревателя.
- •7). Требования к собранному воздухоподогревателю.
- •8). Испытания.
- •9). Гарантии.
- •Тема 10. Тягодутьевые установки.
- •2.Конструкции мельниц-вентиляторов и тягодутьевых машин. Рис. 10.6.
- •3.Расшифровка индексов тягодутьевых машин.
- •Ремонт тягодутьевых машин.
- •1). Общие положения.
- •2). Общие технические требования.
- •3). Дефектация. Требования к составным частям. Ремонт. Характерные повреждения тягодутьевых машин.
- •Разборка и сборка центробежных тягодутьевых машин. Рис. 10.11.
- •Сборка и разборка осевых дымососов. Рис. 10.12.
- •Требования к составным частям.
- •3.3.1.Валы ходовых частей.
- •3.3.2. Корпуса подшипников ходовой части.
- •3.3.3. Соединительные муфты ходовой части.
- •3.3.4. Рабочие колёса центробежных тдм.
- •Рабочие колёса осевых тдм.
- •Направляющие аппараты центробежных тдм. (Рис.10.14.).
- •Направляющие и спрямляющие аппараты осевых тдм. (Рис. 10.15.).
- •Требования к сборке и отремонтированному изделию.
- •Испытания, контроль, измерения.
- •Гарантии.
- •Тема 11. Арматура.
- •Общие технические требования. Назначение. Классификация.
- •Номинальный диаметр прохода арматуры. Давления номинальные, рабочие, пробные.
- •Условное обозначение и маркировка арматуры.
- •Ремонт арматуры.
- •1). Общие положения.
- •2). Общие технические требования.
- •3). Дефектация, требования к составным частям.
- •4). Требования к сборке и к отремонтированному изделию.
- •Тема 12. Организация проведения ремонтов в соответствии с «Правилами организации технического обслуживания и ремонта оборудования, зданий и сооружений эл.Станций и сетей».
- •1. Основные положения по организации технического обслуживания и ремонта
- •2 Техническое обслуживание и ремонт оборудования электростанций
- •2.1 Общие положения
- •2.3 Плановый ремонт оборудования
- •2.6 Планирование ремонта оборудования
- •2.7 Подготовка к ремонту оборудования
- •2.7.2 Электростанции разрабатывают:
- •2.8 Вывод в ремонт и производство ремонта оборудования
- •6) По завершении ремонта составляют ведомость выполненных работ по ремонту по форме приложения 26;
- •7) Принимают предъявляемое к сдаче отремонтированное оборудование и контролируют его опробование.
- •8) Решают возникающие в ходе ремонта технические и организационные вопросы;
- •1) Осуществляют входной контроль качества применяемых материалов и запасных частей;
- •2.9 Приемка оборудования из ремонта и оценка качества
- •2.9.1 Приемку установок из капитального, среднего или текущего ремонта (далее в разделе - ремонт) производит комиссия, возглавляемая главным инженером электростанции. В состав комиссии включаются:
- •2.9.2 Приемочные комиссии осуществляют:
- •2.9.3 Приемка установок из ремонта должна производиться по программе, согласованной с исполнителями и утвержденной главным инженером электростанции.
- •2.9.4 Руководители работ предприятий, участвующих в ремонте, предъявляют приемочной комиссии необходимую документацию, составленную в процессе ремонта, в том числе:
- •2.9.19 Акты на приемку из ремонта установки и входящего в нее оборудования подписываются в течение 5 дней после окончания приемо-сдаточных испытаний.
- •2.9.31 Оценка качества выполненных ремонтных работ характеризует организационно-техническую деятельность каждого предприятия, участвующего в ремонте, включая электростанцию.
- •2.9.36 Оценка качества отремонтированного оборудования, входящего в установку, и оценка качества выполненных ремонтных работ устанавливаются:
- •Тема 13. Правила технической эксплуатации электростанций и сетей рф.
- •1.2. Приемка в эксплуатацию оборудования и сооружений
- •1.2.9. Приемка в эксплуатацию оборудования, зданий и сооружений с дефектами, недоделками не допускается.
- •1.6. Техническое обслуживание, ремонт и модернизация
- •1.6.13. Временем окончания капитального (среднего) ремонта является….
- •1.7. Техническая документация
- •Присосы воздуха в системы пылеприготовления, %
- •4.3. Паровые и водогрейные котельные установки
- •4.13. Контроль за состоянием металла
- •Тема 14. Методические указания. Проект производства работ для ремонта энергетического оборудования электростанций. Требования к составу, содержанию и оформлению.
- •1 Общие положения
- •1.3 Основными производственными факторами в совокупности или в отдельности, определяющими необходимость разработки ппр, являются:
- •1.4 Исходными документами для разработки ппр являются;
- •2 Состав комплекта документов ппр и требования к ним
- •2.1 Состав комплекта документов ппр
- •2.1.6 Разработанный ппр может использоваться как типовой при последующих ремонтах и нуждается в пересмотре при значительных изменениях технологии выполнения ремонта.
- •2.2 Требования к документам ппр
- •3 Порядок разработки, согласования и утверждения ппр
- •Тема 15. Стандарт организации
- •1. Область применения.
- •4.Общие положения.
- •7. Требования по выполнению Договора.
- •7.1. Требования к качеству.
- •7.2. Требования безопасности.
- •7.3. Требования к документации.
- •7.4. Требования к метрологическому обеспечению.
- •7.5. Требования к технологическому оснащению.
- •7.6. Требования к персоналу.
- •8.1.11. Подрядчик, в согласованные с Заказчиком сроки, должен выполнить:
- •8.1.13. Заказчик обеспечивает готовность объекта к ремонту в сроки, предусмотренные сетевым (календарным) графиком проведения работ.
- •8.1.15. За 10 дней до начала работ по Договору Подрядчик передаёт Заказчику документы, необходимые для оформления личных пропусков персоналу Подрядчика.
- •8.2. Услуги предоставляемые Заказчиком.
- •8.2.4. Заказчик в согласованные сроки предоставляет Подрядчику;
- •9. Оценка соответствия.
- •Тема 16. Гражданский кодекс Российской Федерации.
- •Гражданский кодекс российской федерации
- •Часть первая
- •Гражданский кодекс российской федерации
- •Часть вторая
- •Список литературы.
- •Оглавление.
5. Энтропия.
В термодинамике для характеристики состояния рабочего тела наряду с параметрами p, v, T, u, i широко пользуются ещё одним параметром состоянии газа, называемым энтропией и обозначаемым буквой s. Этот параметр, так же как и I, вводят чисто математическим путём и он не может быть измерен при помощи какого-либо прибора.
Изменение энтропии газа в процессе ∆s, а следовательно, и сама энтропия s не зависит от характера процесса изменения состояния идеального газа, а определяется только начальным и конечным состоянием рабочего тела, т. е. энтропия s действительно является параметром состояния и может быть выражена как функция любой пары из трёх основных параметров состояния газа s =f1(T, v); s = f2(T, p); s=f3(p, v).
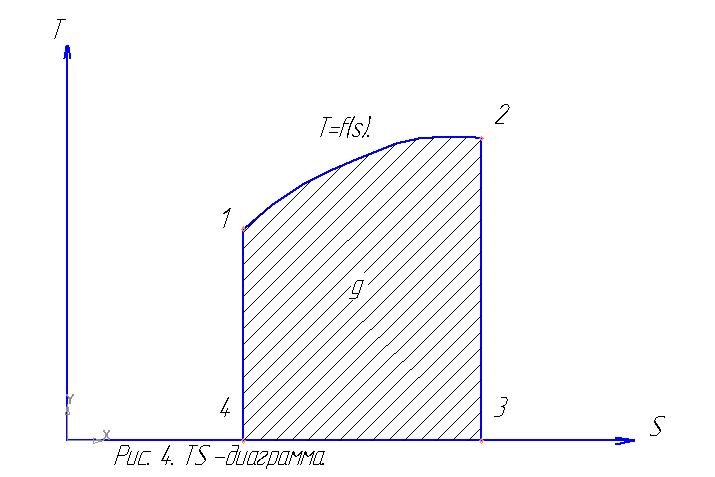
В Ts-диаграмме (рис.4.) площадь, ограниченная кривой процесса 1-2, отрезком оси абсцисс 3-4 и двумя крайними ординатами процесса 1-4 и 2-3, измеряет количество тепла q процесса.
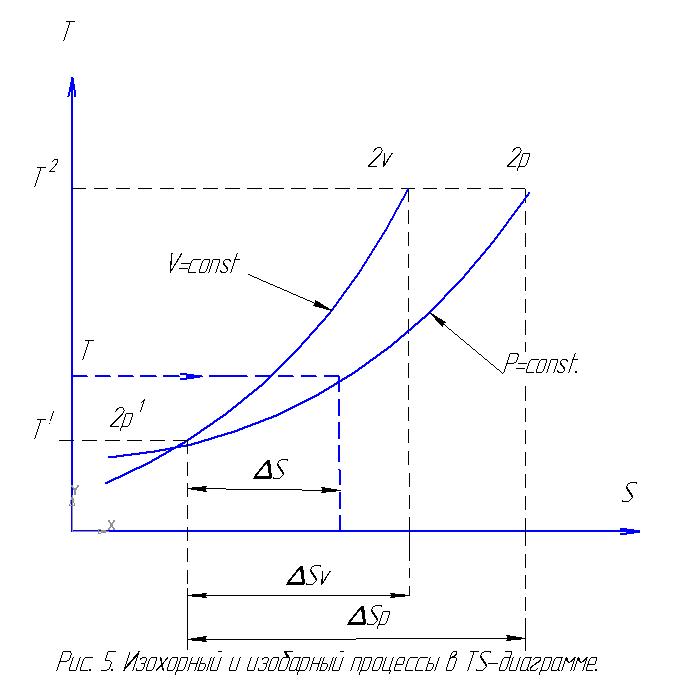
Если в процессе изменения состояния газа энтропия уменьшается (∆s<0), то это значит, что тепло отводится от газа, и наоборот, если энтропия возрастает (∆s>0), то это значит, что тепло сообщается газу в процессе. При этом количество сообщаемого или отнимаемого тепла графически определяется размером площади под кривой процесса в Ts-диаграмме. В этом и состоит важнейшее практическое применение параметра энтропии s, которое позволяет упростить и в то же время сделать более наглядным исследование различных процессов изменения состояния газа. Для примера предоставлены изохорные и изобарные процессы в TS - диаграмме.
В Ts-диаграмме изохорный процесс изображается логарифмической кривой, направленной выпуклостью к оси абсцисс. Процесс 1 – 2v , будет соответствовать процессу нагревания газа, а процесс 1 – 21v – процессу охлаждения газа (рис. 5).
В процессе 1 – 2v энтропия возрастает, следовательно, тепло сообщается газу, который нагревается. В процессе же 1 – 21v наоборот. Площадь под кривой процесса графически изображает количество тепла qv.
Уравнение изобары в Ts-диаграмме также изображается логарифмической кривой, направленной выпуклостью к оси абсцисс (см. рис. 5).
В процессе 1 – 2p энтропия возрастает. Это означает, что к газу подводится тепло, и, следовательно, это процесс расширения. В процессе 1 – 21р происходит сжатие, так как тепло отводится (энтропия уменьшается). Площадь под кривой процесса графически изображает количество тепла qp.
В Ts-диаграмме изохора круче изобары.
6. Изотермический и адиабатный процессы.
Изотермический процесс. Изотермическим называется процесс, происходящий при постоянной температуре газа. Уравнение этого процесса для идеального газа выражает закон Бойля-Мариотта и имеет вид pv = const.
В Ts-диаграмме изотерма является прямой, параллельной оси абсцисс (рис. 6).
Процесс расширения (1 – 2) в Ts-диаграмме изображается прямой, идущей вправо, поскольку расширение газа при постоянной его температуре возможно лишь при подводе тепла к газу.
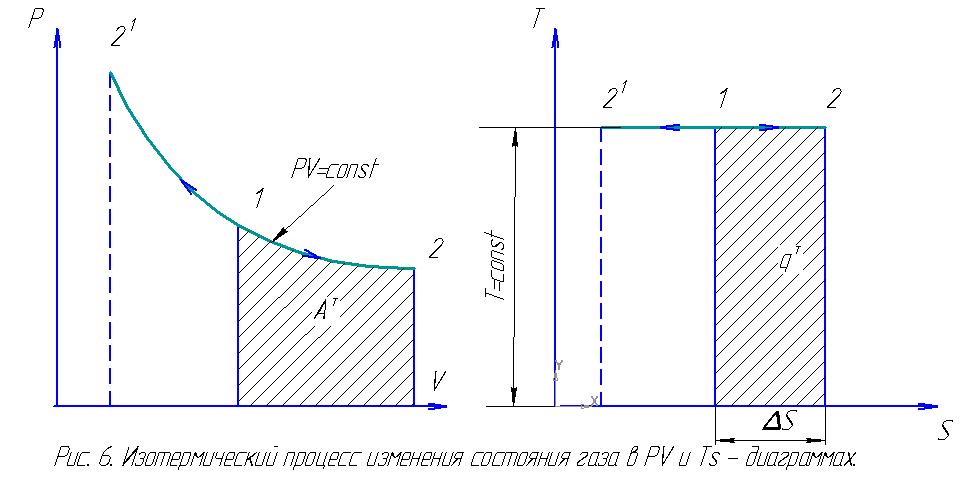
Количество тепла qт в Ts-диаграмме изображается площадью прямоугольника с высотой T и основанием ∆sт, т. е. qт = T∆sт, где изменение энтропии ∆sт может быть найдено из уравнений.
Так как изменение внутренней энергии ∆u в изотермическом процессе идеального газа равно нулю, то Ат = qт.
Адиабатный процесс. Адиабатными называются процессы изменения состояния, осуществляемые без подвода и отвода тепла от газа, т. е. dq = 0.
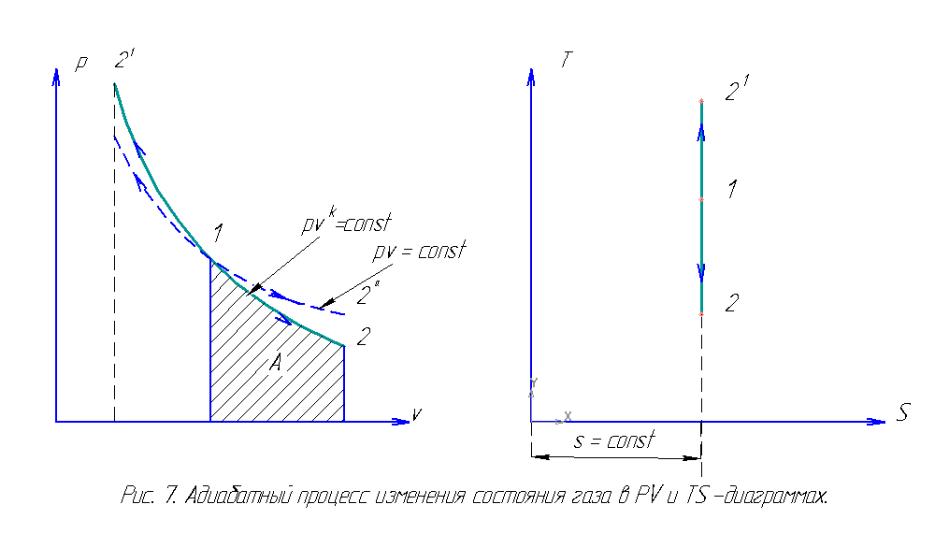
Таким образом, необходимым и достаточным условием адиабатного процесса является аналитическое выражение dq = 0, означающее, что в процессе совершенно не происходит теплообмена. Условие же q = 0 является необходимым для адиабатного процесса, но, как видно ещё недостаточным.
Уравнение адиабаты pvk =const, где k носит название показателя адиабаты и имеет следующие числовые значения, если считать теплоёмкости cp и cv постоянными:
для одноатомных газов k = 1.67;
для двухатомных газов k = 1.4;
для трёх- и многоатомных газов k = 1.3.
