
- •Оглавление.
- •Тема 1.
- •Основные параметры состояния газов.
- •Понятие о внутренней энергии газов
- •Первый и второй законы термодинамики. Понятие об энтальпии газа.
- •5. Энтропия.
- •6. Изотермический и адиабатный процессы.
- •7. Круговые процессы изменения состояния газов.
- •8. Цикл Карно.
- •1.) Термический к.П.Д. Зависит исключительно от температуры источника и от температуры холодильника;
- •2.) Термический к.П.Д. Цикла Карно увеличивается при возрастании температуры источника т1 и при уменьшении температуры холодильника т2;
- •9. Регенеративный цикл.
- •10. Водяной пар. Общие положения.
- •Тема 2.
- •Основные определения, классификация, типы паровых котлов.
- •Гост 23172-78 (2005).
- •Котёл паровой е-400-13,8-560кгдт.
- •Типы и конструктивные схемы паровых котлов.
- •2. Поверхности нагрева паровых котлов.
- •Котел тп-14а.
- •3. Тепловой баланс и кпд паровых котлов.
- •Тема 3. Металлы, каркас, обмуровка паровых котлов.
- •Особенности работы металла в паровых котлах.
- •Каркас котла несёт нагрузку лишь при незначительно повышенной температуре.
- •Стали, применяемые в котлостроении.
- •3.Каркас котла.
- •4.Обмуровка котла.
- •Тема 4. Барабан парового котла.
- •Назначение.
- •Изготовление. Устройство.
- •3.Методы получения чистого пара. Внутрибарабанные устройства.
- •Ремонт барабанов.
- •Уступами для удаления повреждённого металла.
- •Более 100мм. А – без подкладного кольца; б – с подкладным кольцом.
- •Ремонт внутрибарабанных сепарационных устройств.
- •Технические условия на капитальный ремонт со 34-38-20184-94 (ту 34-38-20184-94).
- •Барабанных котлов - со 34.26.729.
- •1). Требования к материалам.
- •2). Метрологическое обеспечение.
- •3). Требования к разборке.
- •4). Требования к дефектации. Осмотр сепарационных устройств. Дырчатые пароприёмные потолки.
- •Паропромывочные устройства.
- •Внутрибарабанные циклоны.
- •Штуцера водоуказательных колонок.
- •5). Требования к сборке.
- •6). Технические условия и допуски по сборке сепарационных устройств. Требования к собранному изделию.
- •Тема 5. Экраны парового котла.
- •Назначение.
- •Тема 6. Водяной экономайзер.
- •Назначение.
- •Конструктивные особенности.
- •Ремонт водяных экономайзеров.
- •1) Общее положение.
- •2). Требования к материалам.
- •3). Требования к поставляемым элементам и деталям экономайзера.
- •4). Требования к дефектации.
- •5). Разборка (демонтаж) и ремонт экономайзера.
- •6). Требования к отремонтированному экономайзеру.
- •Тема 7. Пароперегреватель.
- •Назначение и классификация.
- •Конструктивные особенности.
- •3. Ремонт пароперегревателей.
- •1). Общее положение.
- •2). Требования к материалам.
- •3). Требования к поставляемым элементам и деталям пароперегревателя.
- •4). Требования к дефектации.
- •5). Разборка (демонтаж) и ремонт пароперегревателя.
- •6). Требования к отремонтированному пароперегревателю.
- •Тема 8. Регулирование температуры пара.
- •1. Температура перегретого пара и её изменение при работе котла.
- •2.Способы регулирования температуры перегрева пара.
- •Ремонт устройств для регулирования температуры пара.
- •Предельные отклонения размеров в узлах устройств для регулирования температуры пара и способы устранения дефектов.
- •Тема 9. Воздухоподогреватели.
- •Классификация.
- •Конструктивные особенности рекуперативных воздухоподогревателей.
- •3. Ремонт рекуперативных воздухоподогревателей.
- •1). Общие положения.
- •2). Общие технические требования.
- •3). Дефектация. Требования к составным частям.
- •4). Требования к собранному изделию.
- •5). Испытания.
- •6). Гарантии.
- •7). Требования к надёжности.
- •Конструктивные особенности регенеративных воздухоподогревателей. Рис. 9.9.
- •Основные технические данные роторов регенеративных
- •5. Ремонт регенеративных воздухоподогревателей.
- •1). Общие положения.
- •Технические характеристики рвп-54 и рвп-68.
- •2). Общие технические требования.
- •3). Повреждения и порядок ремонта регенеративных воздухоподогревателей.
- •3). Ремонт ротора регенеративного воздухоподогревателя.
- •4). Ремонт уплотнений регенеративного воздухоподогревателя.
- •5). Ремонт кожуха, газовоздушных патрубков и компенсаторов регенеративного воздухоподогревателя.
- •6). Ремонт подшипниковых опор и привода регенеративного воздухоподогревателя.
- •7). Требования к собранному воздухоподогревателю.
- •8). Испытания.
- •9). Гарантии.
- •Тема 10. Тягодутьевые установки.
- •2.Конструкции мельниц-вентиляторов и тягодутьевых машин. Рис. 10.6.
- •3.Расшифровка индексов тягодутьевых машин.
- •Ремонт тягодутьевых машин.
- •1). Общие положения.
- •2). Общие технические требования.
- •3). Дефектация. Требования к составным частям. Ремонт. Характерные повреждения тягодутьевых машин.
- •Разборка и сборка центробежных тягодутьевых машин. Рис. 10.11.
- •Сборка и разборка осевых дымососов. Рис. 10.12.
- •Требования к составным частям.
- •3.3.1.Валы ходовых частей.
- •3.3.2. Корпуса подшипников ходовой части.
- •3.3.3. Соединительные муфты ходовой части.
- •3.3.4. Рабочие колёса центробежных тдм.
- •Рабочие колёса осевых тдм.
- •Направляющие аппараты центробежных тдм. (Рис.10.14.).
- •Направляющие и спрямляющие аппараты осевых тдм. (Рис. 10.15.).
- •Требования к сборке и отремонтированному изделию.
- •Испытания, контроль, измерения.
- •Гарантии.
- •Тема 11. Арматура.
- •Общие технические требования. Назначение. Классификация.
- •Номинальный диаметр прохода арматуры. Давления номинальные, рабочие, пробные.
- •Условное обозначение и маркировка арматуры.
- •Ремонт арматуры.
- •1). Общие положения.
- •2). Общие технические требования.
- •3). Дефектация, требования к составным частям.
- •4). Требования к сборке и к отремонтированному изделию.
- •Тема 12. Организация проведения ремонтов в соответствии с «Правилами организации технического обслуживания и ремонта оборудования, зданий и сооружений эл.Станций и сетей».
- •1. Основные положения по организации технического обслуживания и ремонта
- •2 Техническое обслуживание и ремонт оборудования электростанций
- •2.1 Общие положения
- •2.3 Плановый ремонт оборудования
- •2.6 Планирование ремонта оборудования
- •2.7 Подготовка к ремонту оборудования
- •2.7.2 Электростанции разрабатывают:
- •2.8 Вывод в ремонт и производство ремонта оборудования
- •6) По завершении ремонта составляют ведомость выполненных работ по ремонту по форме приложения 26;
- •7) Принимают предъявляемое к сдаче отремонтированное оборудование и контролируют его опробование.
- •8) Решают возникающие в ходе ремонта технические и организационные вопросы;
- •1) Осуществляют входной контроль качества применяемых материалов и запасных частей;
- •2.9 Приемка оборудования из ремонта и оценка качества
- •2.9.1 Приемку установок из капитального, среднего или текущего ремонта (далее в разделе - ремонт) производит комиссия, возглавляемая главным инженером электростанции. В состав комиссии включаются:
- •2.9.2 Приемочные комиссии осуществляют:
- •2.9.3 Приемка установок из ремонта должна производиться по программе, согласованной с исполнителями и утвержденной главным инженером электростанции.
- •2.9.4 Руководители работ предприятий, участвующих в ремонте, предъявляют приемочной комиссии необходимую документацию, составленную в процессе ремонта, в том числе:
- •2.9.19 Акты на приемку из ремонта установки и входящего в нее оборудования подписываются в течение 5 дней после окончания приемо-сдаточных испытаний.
- •2.9.31 Оценка качества выполненных ремонтных работ характеризует организационно-техническую деятельность каждого предприятия, участвующего в ремонте, включая электростанцию.
- •2.9.36 Оценка качества отремонтированного оборудования, входящего в установку, и оценка качества выполненных ремонтных работ устанавливаются:
- •Тема 13. Правила технической эксплуатации электростанций и сетей рф.
- •1.2. Приемка в эксплуатацию оборудования и сооружений
- •1.2.9. Приемка в эксплуатацию оборудования, зданий и сооружений с дефектами, недоделками не допускается.
- •1.6. Техническое обслуживание, ремонт и модернизация
- •1.6.13. Временем окончания капитального (среднего) ремонта является….
- •1.7. Техническая документация
- •Присосы воздуха в системы пылеприготовления, %
- •4.3. Паровые и водогрейные котельные установки
- •4.13. Контроль за состоянием металла
- •Тема 14. Методические указания. Проект производства работ для ремонта энергетического оборудования электростанций. Требования к составу, содержанию и оформлению.
- •1 Общие положения
- •1.3 Основными производственными факторами в совокупности или в отдельности, определяющими необходимость разработки ппр, являются:
- •1.4 Исходными документами для разработки ппр являются;
- •2 Состав комплекта документов ппр и требования к ним
- •2.1 Состав комплекта документов ппр
- •2.1.6 Разработанный ппр может использоваться как типовой при последующих ремонтах и нуждается в пересмотре при значительных изменениях технологии выполнения ремонта.
- •2.2 Требования к документам ппр
- •3 Порядок разработки, согласования и утверждения ппр
- •Тема 15. Стандарт организации
- •1. Область применения.
- •4.Общие положения.
- •7. Требования по выполнению Договора.
- •7.1. Требования к качеству.
- •7.2. Требования безопасности.
- •7.3. Требования к документации.
- •7.4. Требования к метрологическому обеспечению.
- •7.5. Требования к технологическому оснащению.
- •7.6. Требования к персоналу.
- •8.1.11. Подрядчик, в согласованные с Заказчиком сроки, должен выполнить:
- •8.1.13. Заказчик обеспечивает готовность объекта к ремонту в сроки, предусмотренные сетевым (календарным) графиком проведения работ.
- •8.1.15. За 10 дней до начала работ по Договору Подрядчик передаёт Заказчику документы, необходимые для оформления личных пропусков персоналу Подрядчика.
- •8.2. Услуги предоставляемые Заказчиком.
- •8.2.4. Заказчик в согласованные сроки предоставляет Подрядчику;
- •9. Оценка соответствия.
- •Тема 16. Гражданский кодекс Российской Федерации.
- •Гражданский кодекс российской федерации
- •Часть первая
- •Гражданский кодекс российской федерации
- •Часть вторая
- •Список литературы.
- •Оглавление.
Понятие о внутренней энергии газов
Вследствие того, что температура газа определяет кинетическую энергию поступательного и вращательного движения молекул и энергию внутримолекулярных колебаний, а давление или объём определяют потенциальную энергию, то внутренней энергией газа и называют сумму перечисленных четырёх видов энергии молекул газа.
Для газа u = f(p, T).
u – это также параметр состояния газа, и разность внутренних энергий для двух каких-либо состояний рабочего тела, или системы тел не будет зависеть от того, каким путём это рабочее тело или система тел будет переходить из первого состояния во второе. Математически разность внутренних энергий для двух состояний рабочего тела записывается
так: u2 - u1 =∆u., где ∆u обычно называют изменением внутренней энергии, единица измерения которой в системе СИ, отнесённая к 1 кг газа, будет дж/кг.
Первый и второй законы термодинамики. Понятие об энтальпии газа.
Первый закон термодинамики устанавливает возможность превращения различных форм энергии друг в друга и определяет, в каких количественных соотношениях эти взаимные превращения осуществляются. Таким образом, первый закон термодинамики фактически является законом сохранения и превращения энергии, отражающим особенности вечно движущийся и вечно изменяющейся материи.
Сущность этого закона состоит в том, что энергия не создаётся и не уничтожается, различные формы энергии могут превращаться друг в друга в строго эквивалентных соотношениях. Сформулировать первый закон термодинамики можно следующим образом: … «любая форма движения способна и вынуждена при определённых для каждого случая условиях превращаться прямо или косвенно в любую другую форму движения».
Выражение u + pv, является параметром состояния газа, поскольку u и pv для каждого состояния газа имеют вполне определённые значения. Сумму величин u + pv называют энтальпией газа и обозначают буквой i. Энтальпия измеряется в джоулях.
Величина pv, входящая в выражение энтальпии i = u + pv, носит название потенциальной энергии давления. Поэтому энтальпию газа можно рассматривать как энергию газа, являющуюся суммой его внутренней энергии и потенциальной энергии давления.
Для более полного анализа явлений и процессов необходимо к первому закону термодинамики добавить ешё одну общую закономерность, позволяющую определить качественные особенности явлений и процессов. Такой закономерностью и является второй закон термодинамики, который устанавливает, возможен или не невозможен тот или иной процесс, в каком преимущественном направлении будет он протекать, когда система достигнет динамического равновесия и при каких условиях от системы можно получить максимальную работу.
Второй закон термодинамики показывает, что необратимые процессы возможны лишь при условии, когда в системе нет равновесия, когда, например, в системе имеется разность температур, и что процессы эти всегда протекают в направлении, приближающим систему к равновесию, при котором подобные процессы и заканчиваются. Второй закон термодинамики устанавливает также, что максимальную работу можно получить от системы только при условии протекания в ней термодинамически обратимых процессов.
Чтобы выяснить условия, при которых осуществляется процесс преобразования тепловой энергии в механическую, и понять сущность второго закона термодинамики, рассмотрим на примере устройства простейшей паросиловой установки (рис. 1.), каким образом тепло преобразуется в механическую энергию.

В паровом котле осуществляются процессы нагрева воды и получения пара за счёт тепловой энергии, выделяемой при сгорании топлива в топке, расположенной под котлом. Из котла пар по трубопроводу поступает к соплам и лопаткам рабочих колёс турбины, где расширяется и совершает работу, заставляя вращаться вал турбины. Так получается механическая энергия, которая может быть использована для привода генератора, вырабатывающего электрический ток. После расширения пар обычно вновь возвращается в первоначальное состояние. С этой целью отработавший пар из турбины выпускают в конденсатор, где он омывает трубки, внутри которых движется холодная вода. Отдавая ей тепло, пар конденсируется, превращается в воду, которая с помощью насоса обратно перекачивается в паровой котёл, вновь превращается в пар, который опять поступает в турбину, расширяется, совершая при этом работу, и т.д.
Для такой непрерывно действующей машины характерно следующее. Если через q1 обозначить количество тепла, получаемого рабочим телом от горячего (высшего) источника (горящее топливо в топке), а через q2 обозначить количество тепла, отдаваемого рабочим телом холодному (низшему) источнику (холодная вода в конденсаторе), то только разность между q1 и q2 перестаёт существовать в виде тепла и превращается в механическую энергию, за счёт которой и совершается работа А, равная по первому закону термодинамики
q1 – q2 = q0.
Для работы непрерывно действующей машины необходимо иметь по крайней мере два источника тепла (один горячий, а другой холодный), поэтому в ней невозможно целиком перевести в работу всё тепло q1, сообщённое рабочему телу. Часть этого тепла в виде q2 неминуемо должна быть отдана холодному источнику и только разность между этими количествами тепла превращается в механическую энергию. Это утверждение, высказанное впервые в 1824 г. французским инженером Сади Карно, и составляет сущность второго закона термодинамики.
4. Изохорный и изобарный процессы.
Среди большого многообразия различных процессов изменения состояния газов широкое распространение имеют некоторые частные случаи процессов, т.е. такие, на протекание которых накладывается какое-либо ограничение. К таким процессам относятся:
процесс изменения состояния при постоянном объёме рабочего тела (изохорный процесс);
процесс изменения состояния при постоянном давлении рабочего тела (изобарный процесс);
процесс изменения состояния при постоянной температуре рабочего тела (изотермический процесс);
процесс изменения состояния, при котором между рабочим телом и внешней средой отсутствует теплообмен (адиабатный процесс).
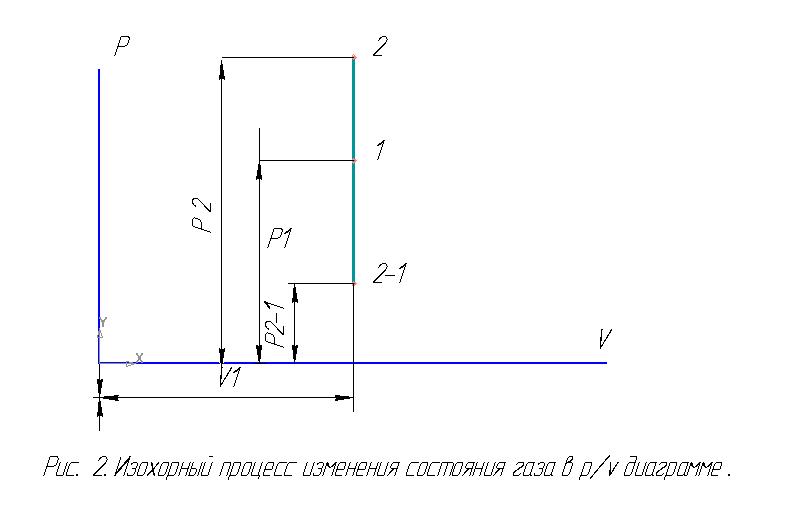
Изохорный процесс. Изохорными называются процессы, осуществляемые при постоянном объёме рабочего тела. Примером изохорного процесса может служить нагревание или охлаждение газа в закрытом сосуде. Изохорный процесс в РV – диаграмме имеет вид прямой линии V = const. Если точка 1 характеризует начальное состояние газа, то при нагревании конечное состояние газа будет характеризоваться точкой 2, расположенной выше точки 1, а при охлаждении – точкой 2-1, расположенной ниже точки 1 (рис. 2.). В изохорных процессах тепло, сообщаемое газу, идёт только на увеличение его внутренней энергии, и отвод тепла возможен только за счёт уменьшения внутренней энергии, т. е. qv = ∆uv.
Изобарный процесс. Так называется процесс изменения состояния газа, который осуществляется при постоянном давлении. Уравнение процесса в pv-координатах
р
= const,
а его график в pv-диаграмме
есть горизонтальная прямая (рис.3.).
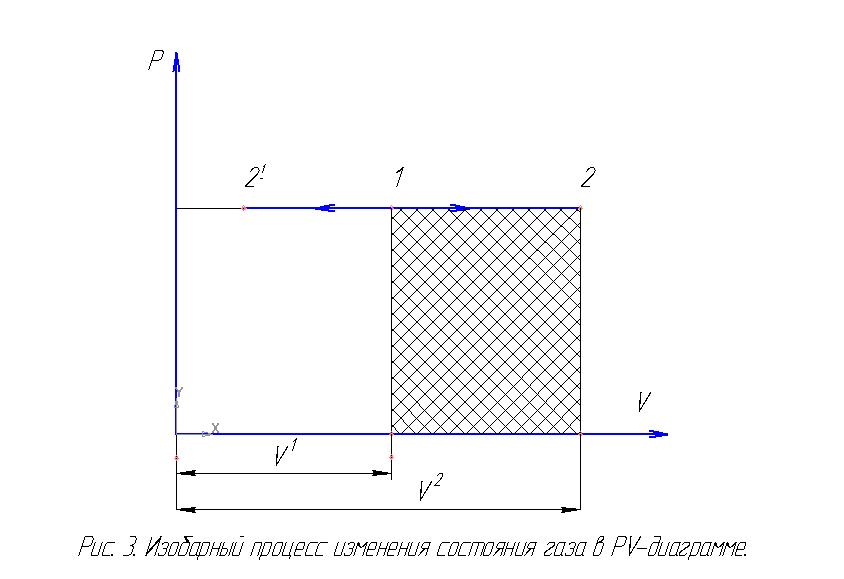
Если точка 1 характеризует начальное состояние газа, процесс изобарного расширения будет представлен линией 1 – 2, а изобарного сжатия 1 – 21.
Тепло, сообщаемое газу в изобарном процессе, идёт на увеличение его энтальпии.
