
- •Глава 1. Обзор литературы
- •Глава 2. Экспериментальная часть
- •Глава 1. Обзор литературы
- •1.1. Функциональная характеристика изоцитратлиазы и ее роль в регуляции клеточного метаболизма
- •1.1.1. Общая характеристика глюконеогенеза
- •1.1.2. Глюконеогенез в растениях
- •1.1.3. Глюконеогенез у животных
- •1.1.4. Глиоксилатный цикл
- •1.1.4.1. Роль глиоксилатного цикла в глюконеогенезе
- •1.1.4.2.Субклеточная локализация изоцитратлиазы
- •1.1.4.3. Распространение глиоксилатного цикла
- •1.1.4.3.1. Рапространение глиоксилатного цикла у микроорганизмов, низших растений и грибов
- •1.1.4.3.2. Функционирование глиоксилатного цикла у высших растений
- •1.1.4.3.3. Глиоксилатный цикл в тканях животных
- •1.1.5. Изоферментный состав изоцитратлиазы
- •1.2. Молекулярные аспекты регуляции ицл
- •1.2.1. Экспрессионная регуляция изоцитратлиазы
- •1.2.2. Генетические механизмы регуляции синтеза ицл
- •1.2.3. Характеристика структурной организации генетического материала изоцитратлиазы
- •1.2.4. Эволюция ферментов глиоксилатного цикла
- •1.3. Особенности метаболизма нетрадиционной культуры амаранта
- •1.3.1. Морфо-физиологические и биохимические свойства амаранта
- •1.3.2. Химический состав амаранта
- •Глава 2. Экспериментальная часть
- •2.1. Цель и задачи
- •2.2.2.2. Определение количества белка
- •2.2.2.3. Электрофоретические исследования белков
- •2.2.2.4. Специфическое проявление изоцитратлиазы
- •2.2.2.5. Исследование субклеточной локализации
- •2.2.2.6. Выделение суммарной клеточной популяции рнк
- •2.2.2.7. Проведение обратной транскрипции
- •2.2.2.8. Подбор праймеров
- •2.2.2.9. Проведение полимеразной цепной реакции
- •2.2.2.10. Секвенирование пцр-продукта
- •2.2.2.11. Проведение пцр в реальном времени
- •2.2.2.12. Статистическая обработка данных
- •2.3. Результаты исследования и их обсуждение
- •2.3.1. Динамика активности изоцитратлиазы из проростков амаранта
- •2.3.2. Изоферментный состав ицл в проростках амаранта
- •2.3.3. Исследование субклеточной локализации ицл
- •2.3.4. Идентификация генов изоцитратлиазы
- •2.3.4.1. Выделение суммарной клеточной популяции рнк
- •2.3.4.2. Проведение обратной транскрипции
- •2.3.4.3. Проведение полимеразной цепной реакции
- •2.3.4.4. Определение нуклеотидной последовательности продуктов полученных методом пцр
- •2.3.4.5. Изменение экспрессии генов изоцитратлиазы в проростках амаранта
1.1.3. Глюконеогенез у животных
Глюконеогенез функционирует у человека и животных главным образом в печени и в меньшей степени в почках и слизистой оболочке кишечника. Особенно активно этот процесс идет при голодании, а также в период восстановления после интенсивной мышечной работы [Епринцев А.Т. Распространение глиоксилатного цикла у организмов различных таксономических групп / А.Т. Епринцев, М.Ю. Шевченко, В.Н. Попов // Успехи современной биологии. — М., 2008.— Т. 128, № 3. - С. 271-280.];[ Епринцев А.Т. Экспрессия и регуляция ферментов глиоксилатного цикла / А.Т. Епринцев, М. Ю. Шевченко, В. Н. Попов. – Воронеж: Центрально-Черноземное книжное издательство, 2005. – 224с.]. По данным некоторых авторов, небольшая активность фосфоенолпируваткарбоксикиназы отмечена в клетках скелетных мышц [Филлипович Ю.Б. Основы биохимии / Ю.Б. Филлипович. – М.: Высш. шк. 1993.– 496 с].
Важнейшим предшественником углеводов в организме животных является молочная кислота (лактат), образующаяся при работе мышц в процессе гликолиза и поступающая в печень с током крови. Превращение лактата в пируват осуществляется под действием гликолитического фермента лактатдегидрогеназы (так называемый Кори цикл). Субстратами глюконеогенеза выступают также промежуточные продукты ЦТК. Главными из них являются интермедиаты, способные окисляться в малат. Однако в тканях животных имеется альтернативный путь образования ФЕП из 2-оксоглутарата и предшествующих ему шестиуглеродных кислот ЦТК.
1.1.4. Глиоксилатный цикл
1.1.4.1. Роль глиоксилатного цикла в глюконеогенезе
Глиоксилатный цикл является важным этапом трансформации жирных кислот в углеводы у организмов различных таксономических групп.
Глиоксилатный цикл был впервые открыт Корнбергом и Кребсом в 1957 году в клетках бактерий рода Pseudomonas, выращиваемых на ацетате [Kornberg H. L. Synthesis of cell constituents from C2-units by a modigied tricarboxylic acid cycle / H. L. Kornberg, H. A. Krebs // Nature – 1957. – Vol. 179. – P. 988-991.]. Для этих микроорганизмов было показано, что его функцией является конденсация С2-молекул для синтеза составляющих клетку компонентов. Для растительных тканей функционирование глиоксилатного цикла было впервые показано в эндосперме клещевины [Malhotra O. P. Isolation and characterization of isocitrate lyase of castor endosperm / O. P. Malhotra, P. K. Srivaslava // Arch. Biochem. and Biophys. – 1982. – Vol. 214, №1. – P. 164-171.]. В жирозапасающих тканях растений основной функцией глиоксилатного цикла считается участие в глюконеогенезе при мобилизации запасных жиров. Глиоксилатный цикл шунтирует две декарбоксилирующие реакции цикла трикарбоновых кислот и позволяет использовать C2-соединения в качестве субстрата для глюконеогенеза[Kornberg H. L. Synthesis of cell constituents from C2-units by a modigied tricarboxylic acid cycle / H. L. Kornberg, H. A. Krebs // Nature – 1957. – Vol. 179. – P. 988-991.].
Глиоксилатный цикл состоит из пяти реакций (рис.2). На первом этапе ацетил-КоА (C2) конденсируется с глиоксилатом с образованием малата (C4) при помощи ключевого фермента глиоксилатного цикла – малатсинтазы (КФ 4.1.3.2). НАД+-зависимая малатдегидрогеназа окисляет малат до оксалоацетата, восстанавливая НАД+. Цитратсинтаза катализирует образование цитрата из оксалоацетата и ещё одной молекулы ацетил-КоА. Аконитатгидратаза превращает цитрат в изоцитрат через цис-аконитат. Другой маркерный фермент ГЦ изоцитратлиаза (КФ 4.1.3.1) катализирует расщепление изоцитрата на сукцинат и глиоксилат. Другими словами последним этапом глиоксилатного цикла является образование сукцината и регенерация глиоксилата в изоцитратлиазной реакции. Некоторые биохимические этапы ГЦ идентичны реакциям ЦТК, однако существуют их регуляторные особенности, связанные с работой изоферментов и компартментализацией (рис.2).
Суммарное уравнение глиоксилатного цикла:
2Ацетил-СоА + Н2О + НАД+ → сукцинат +2СоАSH + НАДН + Н+
Возможность конденсации С2 соединений через глиоксилатный цикл, делает его центральной стадией в пути превращения жирных кислот в углеводы.
Конверсия запасных липидов в форму углеводов делает возможным построение клеточных компонентов в периоды, когда необходимы эндогенные источники углеводов. Кроме того, совсем недавно было открыто, что работа глиоксилатного цикла является необходимым условием вирулентности возбудителей некоторых заболеваний растений, животных и человека [Епринцев А.Т. Экспрессия и регуляция ферментов глиоксилатного цикла / А.Т. Епринцев, М. Ю. Шевченко, В. Н. Попов. – Воронеж: Центрально-Черноземное книжное издательство, 2005. – 224с.].
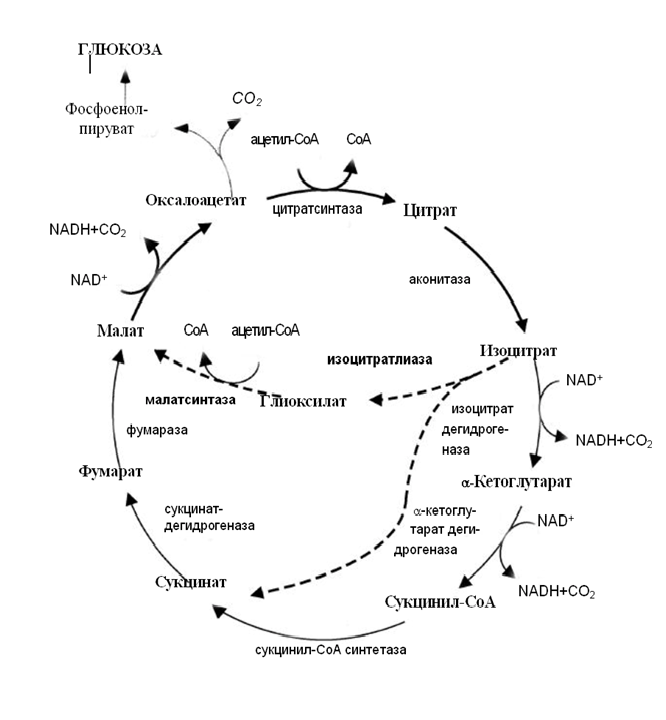
Рис. 2. Схематичное изображение реакций цикла трикарбоновых кислот и глиоксилатного цикла.
Р


 еакции
глиоксилатного цикла , реакции
ЦТК , общие реакции ,
глюконеогенез
еакции
глиоксилатного цикла , реакции
ЦТК , общие реакции ,
глюконеогенез
Хотя глиоксилатный цикл впервые описан для бактерий, дальнейшие исследования показали, что данный метаболический путь имеет широкое распространение в природе, функционируя в различных физиологических периодах жизни многих организмов [Епринцев А.Т. Распространение глиоксилатного цикла у организмов различных таксономических групп / А.Т. Епринцев, М.Ю. Шевченко, В.Н. Попов // Успехи современной биологии. — М., 2008.— Т. 128, № 3. - С. 271-280.].
