
- •Глава 1. Обзор литературы
- •Глава 2. Экспериментальная часть
- •Глава 1. Обзор литературы
- •1.1. Функциональная характеристика изоцитратлиазы и ее роль в регуляции клеточного метаболизма
- •1.1.1. Общая характеристика глюконеогенеза
- •1.1.2. Глюконеогенез в растениях
- •1.1.3. Глюконеогенез у животных
- •1.1.4. Глиоксилатный цикл
- •1.1.4.1. Роль глиоксилатного цикла в глюконеогенезе
- •1.1.4.2.Субклеточная локализация изоцитратлиазы
- •1.1.4.3. Распространение глиоксилатного цикла
- •1.1.4.3.1. Рапространение глиоксилатного цикла у микроорганизмов, низших растений и грибов
- •1.1.4.3.2. Функционирование глиоксилатного цикла у высших растений
- •1.1.4.3.3. Глиоксилатный цикл в тканях животных
- •1.1.5. Изоферментный состав изоцитратлиазы
- •1.2. Молекулярные аспекты регуляции ицл
- •1.2.1. Экспрессионная регуляция изоцитратлиазы
- •1.2.2. Генетические механизмы регуляции синтеза ицл
- •1.2.3. Характеристика структурной организации генетического материала изоцитратлиазы
- •1.2.4. Эволюция ферментов глиоксилатного цикла
- •1.3. Особенности метаболизма нетрадиционной культуры амаранта
- •1.3.1. Морфо-физиологические и биохимические свойства амаранта
- •1.3.2. Химический состав амаранта
- •Глава 2. Экспериментальная часть
- •2.1. Цель и задачи
- •2.2.2.2. Определение количества белка
- •2.2.2.3. Электрофоретические исследования белков
- •2.2.2.4. Специфическое проявление изоцитратлиазы
- •2.2.2.5. Исследование субклеточной локализации
- •2.2.2.6. Выделение суммарной клеточной популяции рнк
- •2.2.2.7. Проведение обратной транскрипции
- •2.2.2.8. Подбор праймеров
- •2.2.2.9. Проведение полимеразной цепной реакции
- •2.2.2.10. Секвенирование пцр-продукта
- •2.2.2.11. Проведение пцр в реальном времени
- •2.2.2.12. Статистическая обработка данных
- •2.3. Результаты исследования и их обсуждение
- •2.3.1. Динамика активности изоцитратлиазы из проростков амаранта
- •2.3.2. Изоферментный состав ицл в проростках амаранта
- •2.3.3. Исследование субклеточной локализации ицл
- •2.3.4. Идентификация генов изоцитратлиазы
- •2.3.4.1. Выделение суммарной клеточной популяции рнк
- •2.3.4.2. Проведение обратной транскрипции
- •2.3.4.3. Проведение полимеразной цепной реакции
- •2.3.4.4. Определение нуклеотидной последовательности продуктов полученных методом пцр
- •2.3.4.5. Изменение экспрессии генов изоцитратлиазы в проростках амаранта
2.2.2.11. Проведение пцр в реальном времени
Для выяснения изменения уровня экспрессии генов icl1 и icl2 амаранта, проводили ПЦР-РВ на приборе DNA Engine® Thermal Cycler «Chromo4» (Bio-Rad, США), используя в качестве красителя SYBR Green [Tzachi B. Kinetic Outlier Detection (KOD) in real-time PCR / B. Tzachi // Nucleic Acids Research. – 2003. – Vol. 31. – P. 105-109.]. Подбор праймеров осуществляли на основе сравнения нуклеотидных последовательностей генов ИЦЛ с использованием программного обеспечения Primer3 [Rozen S. Primer3 on the WWW for general users and for biologist programmers / S. Rozen, H. Skaletsky // Methods Mol. Biol. – 2000. – Vol. 132. – P. 365-386.]. Праймеры для ПЦР-РВ анализа были следующими: прямой - 5'-TGYGGNCAYATGGGNGG-3'; обратный - 5'-DCTRCARTTRTANGC-3'.Параметры амплификации: предварительная денатурация при 95оС в течение 5 мин, затем 35 циклов: 95оС – 20 с, 54оС – 20 с, 72оС – 15 с (детекция) и, наконец, финальная элонгация 72оС – 4 мин.
2.2.2.12. Статистическая обработка данных
Опыты проводили в 3 кратной биологической повторности, аналитическое определение для каждой пробы – в трех повторностях. Для определения достоверности результатов применяли метод вариационной статистики. Для построения графиков применяли программы линейной и параболической аппроксимации. При математической обработке использовали статистический критерий Стъюдента.
Из данных исследования (вариант хi) находили среднее арифметическое х (М); затем вычисляли отклонения каждой варианты от среднего значения (хi – х), после чего рассчитывали квадраты отклонения варианты от среднего значения (хi – х)2, затем находили сумму квадратов отклонений Σ (хi – х)2. Далее вычисляли среднее квадратичное отклонение вариант от среднего арифметического (σ) для контроля и опыта по формуле:
![]()
 ,где
n – число вариант.
,где
n – число вариант.
Затем находили ошибку данных контроля и опыта, после чего рассчитывали нормированное отклонение (t). Значение t, то есть оценка достоверности различий между контролем и опытом, сравнивалась по таблице распределения Стьюдента. Если вычисленное значение совпадает с табличным или больше его, то разницу в эксперименте считали достоверной. Обсуждаются статистически достоверные различия при р≤0,05 [Филлипович Ю.Б. Основы биохимии / Ю.Б. Филлипович. – М.: Высш. шк. 1993.– 496 с.]; [Чернышев Г.А. Вероятность и статистика в биологии и химии / Г.А. Чернышев, В.Н. Стариков – Воронеж: Изд-во ВГУ, 1998. – 270 с.].
2.3. Результаты исследования и их обсуждение
2.3.1. Динамика активности изоцитратлиазы из проростков амаранта
Изучение динамики активности изоцитратлиазы в проростках семян амаранта Amaranthus caudatus L. в течение 10 дней показало, что наблюдается ее индукция с первых дней прорастания, достигающая максимального значения уже на 2-3 сутки (рис.?). Возрастание активности ИЦЛ свидетельствует об активном функционировании глиоксилатного цикла, обеспечивающего конверсию запасных липидов в растворимые формы углеводов. К 10 суткам величина активности ИЦЛ постененно снижалась. В условиях гетеротрофного питания в масличных растениях важную роль играет глюконеогенез, обеспечивающий мобилизацию запасных липидов. Анализ полученных данных по динамике изоцитратлиазной активности показывает корреляцию ее величины от этапа онтогенеза амаранта.
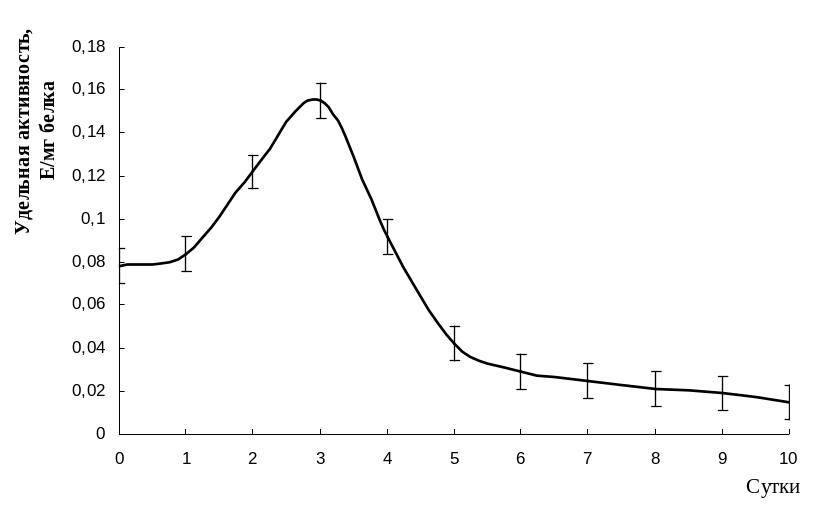
Рис.?. Динамика активности изоцитратлиазы в проростках семян амаранта.
