
- •Общие правила выполнения лабораторных работ.
- •Правила техники безопасности.
- •Лабораторная работа № 1 алканы
- •Методика проведения исследований:
- •Лабораторная работа № 2 алкены
- •Лабораторная работа № 3.
- •Лабораторная работа № 4. Арены (Ароматические углеводороды)
- •Сделайте вывод о химических свойствах бензена и нафталена, о сходстве и различии их химических свойств.
- •Лабораторная работа № 5. Спирты, фенолы, нафтолы.
- •При оформлении отчета по лабораторной работе напишите уравнения реакций для других спиртов, используя их структурные формулы.
- •При оформлении отчета по лабораторной работе по аналогии напишите уравнение реакции получения гликолята меди
- •Симм-трибромфенол
- •Лабораторная работа №6. Альдегиды и кетоны.
- •Методика проведения исследования:
- •Бензиловый спирт h oh
Бензиловый спирт h oh
бензойный альдегид бензойная кислота
По помутнению содержимого пробирки можно судить об образовании бензойной кислоты.
ОПЫТ 5. ЦВЕТНАЯ РЕАКЦИЯ НА АЦЕТОН.
Выполнение работы.
На предметное стекло наносят каплю раствора нитропруссида натрия, 2 капли воды и 1 каплю водного раствора ацетона. При добавлении капли раствора едкого натра смесь окрашивается в красный цвет, который от добавления 1 капли раствора уксусной кислоты принимает вишнево-красный оттенок.
Сделать вывод о химических свойствах альдегидов и кетонов, отметить их общие химические свойства и различия их химических свойств.
Контрольные вопросы.
Напишите общую формулу гомологического ряда предельных альдегидов.
Укажите тип гибридизации атомов углерода в карбонильной группе.
Напишите структурные формулы возможных изомеров состава C 3H6O. Назовите их.
Составьте структурные формулы веществ: 3,3-диметилбутаналя;3-метил-2-этилпентаналя; 2-метилпропаналя; бутаналя; метилэтилкетона; 2,2-диэтилпропаналя. Укажите формулы гомологов и изомеров.
Одним реактивом распознайте глицерин, формальдегид, этиловый спирт. Напишите уравнения реакций.
Опишите, как можно различить: бензен, ацетальдегид, гексен. Напишите уравнения соответствующих реакций.
Какие методы можно использовать для получения изомасляного альдегида; метил-втор-бутилкетона; бензальдегида? Напишите уравнения соответствующих реакций.
Укажите, какие вещества из приведенных могут реагировать между собой: глицерин, бромная вода, формальдегид, гидроксид меди(II), фенол, этанол, хлороводород. Напишите уравнения соответствующих химических реакций, используя структурные формулы органических соединений. Назовите образующиеся вещества.
Составьте структурную формулу метаналя, укажите валентность и степень окисления атомов углерода и напишите уравнения реакций, в которых метаналь является: а) окислителем; б) восстановителем.
Напишите уравнения реакций следующих превращений : метан → ацетилен → ацетальдегид → этанол → этилен → этан.
Лабораторная работа № 7.
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ.
Цель работы: изучение химических свойств карбоновых кислот.
Оборудование: спиртовки, пробирки, газоотводные трубки, химические стаканы.
Реактивы:
№ опыта |
Название реактива |
Концентр. |
№ капель-ницы |
Примеча-ние |
1 |
Уксусная кислота Лимонная кислота Щавелевая кислота Молочная кислота Метиловый оранжевый Фенолфталеин |
0,1 н 0,1 н
0,1 н |
10 83 82 84 27 23 |
на столе на столе на столе под тягой на полке на полке |
2 |
Уксусная кислота Лимонная кислота Щавелевая кислота Молочная кислота Стружка магния Кусочки цинка |
0,1 н 0,1 н 0,1 н 0,1 н тв. тв. |
10 83 82 84 28 29 |
на столе на столе на столе под тягой набор. тв.в-в набор. тв. в-в |
3 |
Оксид меди (II) Уксусная кислота ледяная Карбонат натрия |
тв.
0,5 н |
11 45 1 |
набор тв. в-в под тягой на столе |
4 |
Уксуснокислый натрий Хлорид железа |
тв. 0,1 н |
12 11 |
набор тв. в-в на столе |
5 |
Щавелевая кислота Известковая вода |
тв. насыщ. р-р |
4 79 |
набор тв. в-в на полке |
6 |
Щавелевая кислота Перманганат калия Серная кислота Известковая вода |
тв. 0,1 н 10% насыщ. р-р |
4 3 5 79 |
набор тв. в-в на столе на столе на полке |
7
|
Олеиновая кислота Бромная вода |
конц. насыщ. р-р |
53 41 |
под тягой под тягой |
8 |
Олеиновая кислота Перманганат калия Карбонат натрия |
конц. 0,1 н 0,5 н |
53 3 1 |
под тягой на столе на столе |
9
|
Стеарин Диэтиловый эфир Едкий натр Фенолфталеин |
кв.
10% |
32 85 72 23 |
набор тв. в-в под тягой на столе на полке |
10 |
Бензойная кислота Едкий натр Соляная кислота Хлорид железа |
кв. 10% 2 н 0,1 н |
33 72 12 11 |
набор тв. в-в на столе на столе на столе |
11 |
Фталевая кислота Бензол |
тв. |
6 49 |
набор тв. в-в под тягой |
12 |
Уксусный ангидрид Едкий натр Этиловый спирт Карбонат натрия Анилин |
10%
тв. |
40 72 48 13 32 |
под тягой на столе под тягой набор тв. в-в под тягой |
Методика проведения исследования:
ОПЫТ 1. КИСЛОТНЫЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ.
Выполнение работы.
В четыре пробирки помещают по 5 капель уксусной, лимонной, щавелевой, молочной кислот (каждую кислоту в отдельную пробирку) и добавляют по 1 капле метилового оранжевого, а в следующие четыре пробирки с указанными кислотами добавляют по 1 капле фенолфталеина.
В каких пробирках изменился цвет, а в
каких остался бесцветным? Сделайте
вывод о кислотных свойствах кислот
ОПЫТ 2. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИ.
Выполнение работы.
В две пробирки налить по 5 капель уксусной кислоты и в одну пробирку добавить стружки магния, а в другую – кусочки цинка. Аналогичные опыты проделать с остальными кислотами. Выделяется водород и образуются соли. Если с цинком реакция протекает медленно, то реакционную смесь нагревают.
При
оформлении отчета по лабораторной
работе напишите уравнения реакций
ОПЫТ 3. ВЗАИМОДЕЙСТВИЕ УКСУСНОЙ КИСЛОТЫ С ОКСИДОМ МЕДИ И КАРБОНАТОМ НАТРИЯ.
Выполнение работы.
а) К 0,1 г оксида меди (II), помещенного в пробирку, приливают 10 капель уксусной кислоты, затем пробирку осторожно нагревают. Обращают внимание на цвет раствора. Напишите уравнение химической реакции.
б) К 10 каплям 10% раствора карбоната натрия приливают 5 капель ледяной уксусной кислоты. Напишите уравнение химической реакции и опишите происходящие изменения.
ОПЫТ 4. ОБРАЗОВАНИЕ И ГИДРОЛИЗ УКСУСНОКИСЛОГО ЖЕЛЕЗА.
Выполнение работы.
В пробирку помещают несколько кристалликов уксуснокислого натрия, 3 капли воды 2 капли раствора хлорида железа (III). Раствор окрашивается в желтовато-красный цвет в результате образования железной соли уксусной кислоты. Раствор нагревают до кипения. Тотчас же выпадают хлопья основных солей красно-бурого цвета.
Химизм процесса:
F e(CH3COO)3 + HOH Fe(OH)(CH3COO)2 + CH3COOH
F e(OH)(CH3COO)2 + HOH Fe(OH)2(CH3COO) + CH3COOH
F e(OH)2(CH3COO) + HOH Fe(OH)3 + CH3COOH
ОПЫТ 5. РАЗЛОЖЕНИЕ ЩАВЕЛЕВОЙ КИСЛОТЫ ПРИ НАГРЕВАНИИ.
Выполнение работы.
Несколько кристаллов щавелевой кислоты нагревают в пробирке с газоотводной трубкой, конец которой опущен в пробирку с известковой водой. Газ, выделяющийся при нагревании, вызывает помутнение известковой воды. После этого газоотводную трубку вынимают из пробирки с известковой водой и поджигают выделяющийся газ. Химизм процесса:
нагревание
H OOC-COOH·
2H2O
HOOC-COOH
+ 2H2O
OOC-COOH·
2H2O
HOOC-COOH
+ 2H2O
HOOC-COOH CO 2 + HCOOH
ОПЫТ 6. ОКИСЛЕНИЕ ЩАВЕЛЕВОЙ КИСЛОТЫ ПЕРМАНГАНАТОМ КАЛИЯ.
Выполнение работы.
В пробирку помещают несколько кристаллов кислоты, добавляют 2 капли перманганата калия и 1 каплю серной кислоты. Отверстие пробирки закрывают пробкой с газоотводной трубкой, конец которой опущен в пробирку с известковой водой. Реакционную смесь нагревают. Розовый раствор перманганата калия обесцвечивается, а в пробирке с известковой водой появляется белый осадок карбоната.
Химизм процесса:
 2KMnO4
+ 5HOOC-COOH + 3H2SO4
K2SO4
+ 2MnSO4 +10CO2
+ 8H2O
2KMnO4
+ 5HOOC-COOH + 3H2SO4
K2SO4
+ 2MnSO4 +10CO2
+ 8H2O
 CO2
+ Ca(OH)2
CaCO3↓
+ H2O
CO2
+ Ca(OH)2
CaCO3↓
+ H2O
Щавелевая кислота обладает восстановительными свойствами.
ОПЫТ 7. ПРИСОЕДИНЕНИЕ БРОМА К ОЛЕИНОВОЙ КИСЛОТЕ.
Выполнение работы.
В пробирку вносят 3-4 капли бромной воды, 1 каплю олеиновой кислоты и энергично взбалтывают. Бромная вода обесцвечивается.
Химизм процесса:
CH3(CH2)7-CH=CH-(CH2)7-COOH + Br2 →
→ CH3(CH2)7-CHBr-CHBr-(CH2)7-COOH дибромстеариновая кислота
ОПЫТ 8. ОКИСЛЕНИЕ ОЛЕИНОВОЙ КИСЛОТЫ ПЕРМАНГАНАТОМ КАЛИЯ.
Выполнение работы.
В пробирку помещают по 2 капли олеиновой кислоты, раствора карбоната натрия и раствора перманганата калия. При встряхивании смеси розовая окраска исчезает.
Химизм процесса:
C H3
- (CH2)7
– CH
= CH
- (CH2)7
- COOH
+ [O]
+ HOH
H3
- (CH2)7
– CH
= CH
- (CH2)7
- COOH
+ [O]
+ HOH
CH3-(CH2)7 – CH ― CH - (CH2)7 – COOH
| |
OH OH
Обесцвечивание бромной воды и раствора перманганата калия указывает на наличие кратной связи в молекуле олеиновой кислоты.
ОПЫТ 9. КИСЛОТНЫЕ СВОЙСТВА СТЕАРИНА.
Выполнение работы.
В две сухие пробирки помещают по 4 капли диэтилового эфира. В одну пробирку добавляют маленький кусочек стеарина и растворяют его в диэтиловом эфире без нагревания. В обе пробирки прибавляют по 1 капле фенолфталеина, по 1 капле раствора едкого натра и тщательно встряхивают. В пробирке, содержащей стеарин, появившееся вначале малиновое окрашивание при перемешивании исчезает. В пробирке с эфиром и щелочью появляется стойкая малиновая окраска.
Химизм процесса:
C17H35COOH + NaOH C17H35COONa + H2O
C15H31COOH + NaOH C15H31COONa + H2O
Стеарин представляет собой смесь стеариновой и пальмитиновой кислот. Реагируя со щелочью, они образуют соли, вследствие чего в растворе отсутствуют ионы OH-.
ОПЫТ 10. ПОЛУЧЕНИЕ БЕНЗОЙНОКИСЛОГО КАЛИЯ И ЖЕЛЕЗА.
Выполнение работы.
В пробирку помещают несколько кристаллов бензойной кислоты и прибавляют 3 капли раствора едкого кали. Встряхивают содержимое пробирки. Кристаллы растворяются.
Химизм процесса:
C 6H5COOH + KOH C6H5COOK + H2O
Соли бензойной кислоты со щелочными металлами хорошо растворимы в воде, поэтому бензойная кислота растворима в щелочах.
Разделите содержимое пробирки на две части. В одну пробирку к раствору бензойнокислого калия добавляют 2-3 капли раствора соляной кислоты. Снова выпадает бензойная кислота:
C 6H5COOK + HCl C6H5COOH + KCl
В другую пробирку к раствору бензойнокислого калия приливают 3-4 капли 2% раствора хлорида железа. Сразу же образуется бензойнокислое железо, которое осаждается в виде объемистого бурого осадка:
3C6H5COOK + FeCl3 (C6H5-COO)3Fe + 3KCl
ОПЫТ 11. ОБРАЗОВАНИЕ ФТАЛЕВОГО АНГИДРИДА.
Выполнение работы.
Орто-фталевая кислота при нагревании легко теряет воду и превращается в вещество белого цвета, так называемый фталевый ангидрид:
O



 COOH C
COOH C



 O
O
 COOH C
COOH C



O
В сухую пробирку насыпают несколько кристаллов фталевой кислоты и нагревают ее в пламени горелки, держа пробирку горизонтально. При этом образуется фталевый ангидрид, который сублимируется и вновь конденсируется на холодных стенках пробирки. Пробирке дают остыть и приливают 3-4 капли бензола. При взбалтывании фталевый ангидрид легко растворяется в бензоле.
ОПЫТ 12. СВОЙСТВА УКСУСНОГО АНГИДРИДА.
Выполнение работы.
а) Взаимодействие уксусного ангидрида со щелочью.
В пробирку наливают 10 капель воды, прибавляют 2 капли уксусного ангидрида и взбалтывают. Растворение не наблюдается. Затем приливают несколько капель 10% раствора едкого натра и снова взбалтывают. При этом происходит гидролиз уксуснокислого ангидрида с образованием уксуснокислого натрия:

б) Взаимодействие уксусного ангидрида с этиловым спиртом.
В пробирку наливают 10 капель уксусного ангидрида и 10 капель этилового спирта, раствор нагревают несколько минут на водяной бане при температуре 60-700С. После этого смесь выливают в равный объем воды и нейтрализуют раствором соды. Образовавшийся уксусноэтиловый эфир отделяется в верхнем слое. Его узнают по характерному запаху:

в) Взаимодействие уксусного ангидрида с анилином.
В пробирку наливают 10 капель воды, прибавляют 4 капли анилина и сильно взбалтывают. К образовавшейся эмульсии добавляют 4 капли уксусного ангидрида и вновь энергично встряхивают. При этом наблюдается сильное разогревание смеси, которая в скором времени превращается в сплошную массу белых кристаллов образовавшегося ацетанилида (фенилацетамида):
C 6H5NH2 + (CH3-CO)2O C6H5NHCOCH3 + CH3COOH
Сделайте вывод о химических свойствах карбоновых кислот. Дайте сравнительную характеристику карбоновых и минеральных кислот.
Контрольные вопросы.
1. Какую функциональную группу содержат карбоновые кислоты.
2.Напишите общую формулу одноосновных предельных карбоновых кислот.
3. Укажите тип гибридизации атома углерода в карбоксильной группе.
4. Напишите уравнения химических реакций, характеризующих химические свойства карбоновых кислот.
5. Составьте структурные формулы четырех изомерных карбоновых кислот, соответствующих формуле C 5H10О 2. Назовите их.
6. Составьте уравнения реакций следующих превращений, используя структурные формулы органических веществ: а) пропаналь →пропионовая кислота →пропионат натрия → этан → этин → ацетальдегид; б) метанол → метаналь → муравьиная кислота → оксид углерода (IV).
7. Укажите, какие вещества вступили в реакцию, и при каких условиях, если в результате образовались следующие вещества:
а) (CH 3COO) 2Mg + H 2 ;
б) CH 3COOCH3 + H 2O;
в) 2CH 3COONa + H 2O + CO 2.
ЛАБОРАТОРНАЯ РАБОТА № 8
ГАЛОГЕНРОИЗВОДНЫЕ ПРЕДЕЛЬНЫХ И АРОМАТИЧЕСКИХ
УГЛЕВОДОРОДОВ
Цель работы: изучение химический свойств галогенпроизводных углеводородов.
Оборудование: микроскоп, термометр, водяная баня, спиртовки, штатив, пробирки, пипетки, микрошпатель, предметные стекла, газоотводные трубки, стеклянная трубка-поглотитель с натронной известью, ватный тампон.
Реактивы:
№ опыта |
Название
|
концентр.
|
№ капельниц.
|
примечание
|
1 1 |
Этиловый спирт Бромид калия Серная кислота |
кристал. конц. |
48 21 57 |
под тягой в наборе сухих под тягой |
2 |
Этиловый спирт Серная кислота Хлорид натрия |
конц. крист. |
48 57 20 |
под тягой в наборе сухих |
3 |
Этиловый спирт Едкий натр Р-р йода в иодиде калия |
2н
|
48 7 44 |
под тягой на столе под тягой |
4
|
Хлороформ Едкий натр Нитрат серебра в этиловом спирте азотная кислота
|
10%
20% |
42 72
73
|
под тягой на столе
на столе
|
5 |
Р-р резорцина Хлороформ |
1%
|
71 42 |
в капельн. под тягой |
6
|
Едкий натр Хлороформ
|
10%
|
72 42
|
на столе под тягой.
|
7 |
|
|
||
7 |
Бензол Бром Железные опилки Натронная известь Едкий натр
|
2н
|
49 41 9 8 7
|
под тягой под тягой в наборе сух. в наборе сухих на столе
|
8 |
Бензол Толуол Бром Алюминиевая проволока Железо восстановленное Йод кристаллический |
насыщ. р-р
|
49 52 41 23 9 22 |
под тягой под тягой под тягой в наборе сухих в наборе сухих в наборе сухих |
9 |
Стирол Бром Уксусная кислота |
насыщ. р-р ледяная |
41 45 |
под тягой под тягой |
10 |
Хлорбензол Нитрат серебра |
0,2 н |
4 |
на столе |
Методика проведения исследования.
Опыт 1. ПОЛУЧЕНИЕ БРОМИСТОГО ЭТИЛА.
Выполнение работы.
В пробирку с отводной трубкой помещают 3 капли спирта, 2 капли воды и 3 капли серной кислоты. Охладив разогревшуюся спирто-кислотную смесь, в нее на конце микрошпателя помещают несколько кристаллов бромида калия. Пробирку укрепляют наклонно в лапке штатива и осторожно нагревают содержимое пробирки до кипения. Конец отводной трубки погружают в другую пробирку, содержащую 6-7 капель воды и охлаждаемую льдом. Нагревание ведут до исчезновения кристаллов бромида кадия в реакционной пробирке.
В приемнике образуются два слоя: нижний - бромистый этил, верхний - вода. С помощью пипетки удаляют верхний слой. Стеклянной палочкой вносят 1 каплю бромистого этила в пламя горелки. Пламя окрашивается по краям в зеленый цвет.
Химизм процесса:
C2H5OH
+
HO-SO3H
C2H5-O-SO3H Этилсерная
кислота
+
HOH

KBr
+
H2SO4
HBr
+
KHSO4 Гидросульфат
калия
С2H5-O-SO3H
+
HBr
C2H5Br Бромистый
этил
+
H2SO4
При оформлении
лабораторной работы напишите суммарную
реакцию: этанол + НВr
Наиболее удобным способом получения галогеналкилов является замещение гидроксильной группы спиртов R - ОН на галоген. Способ получения галогенопроизводных из спиртов используется в больших масштабах, так как спирты - легкодоступные и хорошо изученные соединения. В некоторых случаях при получении галогеналкилов вместо галогеноводородов применяют галогениды фосфора.
ОПЫТ 2. ПОЛУЧЕНИЕ ХЛОРИСТОГО ЭТИЛА.
Выполнение работы.
В пробирку насыпают мелкие кристаллы хлорида натрия (слой высотой I мм), затем добавляют 3 капли этилового спирта, 3 капли концентрированной серной кислоты и нагревают смесь в пламени горелки. Время от времени подносят отверстие пробирки к пламени горелки. Выделяющийся хлористый этил загорается, образуя характерное колечко, окрашенное в зеленый цвет.
Химизм процесса:
C2H5OH
+ HO-SO3H
C2H5-O-SO3H
+H2O

N aCl
+ H2SO4
HCl
+ NaHSO4
aCl
+ H2SO4
HCl
+ NaHSO4
C2H5-O-SO3H + HCl C2H5Cl + H2SO4
Хлористый этил - газ, легко сгущается в жидкость с ТК=12,40 С.
ОПЫТ 3 . ПОЛУЧЕНИЕ ЙОДОФОРМА ИЗ ЭТИЛОВОГО СПИРТА
Выполнение работы.
В пробирку помещают I каплю этилового спирта, 3 капли раствора йода в иодиде калия и 3 капли раствора едкого натра. Содержимое пробирки нагревают, не допуская закипания раствора, так как в кипящем растворе йодоформ расщепляется щелочью. Появляется беловатая муть, из которой постепенно при охлаждении образуются кристаллы йодоформа. Если муть растворяется, то добавляют еще 3-4 капли раствора йода к теплой реакционной смеси и тщательно перемешивают содержимое пробирки, пока не начнется выделение кристаллов.
Две капли осадка переносят на предметное стекло и рассматривают их под микроскопом. Кристаллы йодоформа имеют вид шестиугольников или шестиконечных снежинок.
Химизм процесса:

Йодоформ образует кристаллы желтого цвета с Тпл = 1190С, обладает сильным, очень навязчивым запахом. Это прекрасный антисептик.
ОПЫТ 4. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ ГАЛОГЕНА В АЛКИЛГАЛОГЕНИДАХ.
Выполнение работы.
.
а) ЩЕЛОЧНОЙ ГИДРОЛИЗ АЛКИЛГАЛОГЕНИДОВ.
В пробирки наливают по 5 капель исследуемых алкилгалогенидов и 2 раза промывают их водой. Для этого к алкилгалогениду добавляют дистиллированную воду - 20 капель, встряхивают смесь и после расслоения сливают воду и промывание повторяют. После этого к алкилгалогенидам добавляют 20 капель 10% раствора гидроксида натрия и встряхивают содержимое пробирок. Затем при постоянном перемешивании осторожно доводят смесь до кипения. (Кипятить нельзя, так как алкилгалогенид может испариться!). После охлаждения отливают 10 капель щелочного раствора в другую пробирку, подкисляют его 20% раствором азотной кислоты и добавляют несколько капель 1% раствора нитрата серебра. Количество образующегося осадка AgCl или АgBr зависит от подвижности галогена в алкилгалогениде.
C 2H5Cl + NaOH C2H5OH + NaCl
A gNO3
+NaCl AgCl↓ +NaNO3.
gNO3
+NaCl AgCl↓ +NaNO3.
б) ВЗАИМОДЕЙСТВИЕ АЛКИЛГАЛОГЕНИДОВ СО СПИРТОВЫМ РАСТВОРОМ НИТРАТА СЕРЕБРА
Для опыта используют несколько алкилгалогенидов, предварительно промытых водой. В сухие пробирки наливают по 10 капель насыщенного раствора (спиртового) нитрата серебра и добавляют по 1 капле промытых водой алкилгалогенидов. Смесь в каждой пробирке встряхивают и отмечают, выпадает ли осадок на холоду, затем нагревают пробирки в кипящей водяной бане в течение 1 мин. Охлаждают пробирки и сравнивают количества выпавших осадков. Чем больше выпадает осадка, тем выше подвижность галогена в исходном алкилгалогениде.
ОПЫТ 5. ЦВЕТНАЯ РЕАКЦИЯ НА ХЛОРОФОРМ.
Выполнение работы.
В пробирку наливают 5 капель резорцина, 1% раствор; 10 капель гидроксида натрия и 5 капель хлороформа. Смесь нагревают. Появляется желто-красное окрашивание.
ОПЫТ 6. ЗАМЕЩЕНИЕ ГАЛОГЕНОВ НА ГИДРОКСИЛЫ ДЕЙСТВИЕМ ЩЕЛОЧИ.
Выполнение работы.
К 5 каплям хлороформа в пробирке приливают 20 капель 10%-го раствора едкого натра и осторожно при частом взбалтывании нагревают смесь до начала кипения. Смесь охлаждают, дают отстояться и сливают часть водно-щелочного слоя. К водно-щелочному слою прибавляют кислоту до явно кислой реакции (проба на лакмус) и приливают несколько капель 1%-го раствора нитрата серебра. Наблюдают образование белого осадка хлористого серебра, нерастворимого в азотной кислоте.
Химизм процесса:

Если проводить опыт параллельно с несколькими галогенопроизводными предельных углеводородов, то, сравнивая количества образовавшегося осадка галоидного серебра, можно сделать вывод о легкости замещения галогена.
В одинаковых по своему строению галогенопроизводных легкость замещения галогена падает в следующей последовательности:
R-I > R-Br > R-Cl > R-F.
ОПЫТ 5. ПОЛУЧЕНИЕ БРОМБЕНЗОЛА.
Выполнение работы.
Опыт проводят в вытяжном шкафу.
В сухую пробирку помещают немного железных опилок, 5 капель бензена и 2 капли брома. Отверстие пробирки сразу же закрывают пробкой с газоотводной трубкой.
Реакция начинается немедленно, смесь при этом почти не разогревается. После того, как в реакционной пробирке прекратится выделение пузырьков НВr и исчезнут окрашенные пары брома, ее помещают в водяную баню и нагревают 2 мин. при температуре 60-700С.
Полученный бромбензен охлаждают и промывают от следов брома раствором едкого натра почти до обесцвечивания. Верхний водный слой отбирают при помощи пипетки. С бромбензеном проводят качественную реакцию на галоген.
Химизм процесса:
2 Fe + 3Br2 2FeBr3
FeBr3
C 6H6
+ Br2
C6H5Br
+ HBr
6H6
+ Br2
C6H5Br
+ HBr
ОПЫТ 8. ВЛИЯНИЕ КАТАЛИЗАТОРОВ НА ХОД БРОМИРОВАНИЯ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
Выполнение работы.
Опыт проводят в вытяжном шкафу.
В 4 пробирки приливают по 3 капли исследуемого углеводорода (опыт проводят с бензеном и толуеном параллельно) и по 1 капле раствора брома. В первую пробирку помещают кристаллик йода, во вторую - немного железных опилок, в третью - кусочек амальгамированной алюминиевой проволоки. В четвертую пробирку катализатор не добавляют.
В четырех пробирках, содержащих бензен, на холоду не обнаруживают изменений. Поэтому их нагревают в водяной бане сначала до начала кипения, а затем ставят в штатив. Выделение бромоводорода наблюдается в присутствии алюминия и железа. Пробирки с толуеном оставляют в штативе при комнатной температуре, часто взбалтывая. Бромирование толуена идет значительно легче, чем бромирование бензена.
Химизм процесса:

При низких температурах в присутствии катализаторов галоген легко замещает водородные атомы бензенового ядра. В качестве катализаторов применяются галогениды металлов, сера, йод. Самыми сильнодействующими катализаторами являются соединения алюминия с галогенами. В их присутствии можно все атомы водорода ядра заменить на атомы хлора или брома.
Катализаторы помогают созданию активной электрофильной частицы путем поляризации связи между атомами галогена:

δ+ δ-
 δ+
δ-
δ+
δ-
ОПЫТ 9. БРОМИРОВАНИЕ СТИРЕНА.
Выполнение работы.
В вытяжном шкафу очень осторожно готовят раствор брома в ледяной уксусной кислоте.
В пробирку помещают 3 капли стирена и при постоянном перемешивании по 1 капле добавляют раствор брома до тех пор, пока очередная капля брома не перестанет обесцвечиваться. К полученному раствору добавляют 5 капель холодной воды, через некоторое время выпадет белый осадок фенилдибромэтана.
Химизм процесса:

В этих условиях идет постепенное присоединение брома по месту двойной связи в боковой цепи.
ОПЫТ 10. ПРОЧНОСТЬ ГАЛОГЕНА, СТОЯЩЕГО В БЕНЗЕНОВОМ КОЛЬЦЕ.
Выполнение работы.
В пробирку помещают 1 каплю хлорбензена, 5 капель воды и нагревают до кипения. К горячему раствору приливают 1 каплю раствора соли серебра. Появления белого осадка или мути хлорида серебра не происходит. Это подтверждает прочность связи с ядром галогена.
Атом галогена сопряжен с бензеновым ядром. В результате образуется частичная двоесвязанность С-HaI, которая приводит к уменьшению длины связи и возрастанию ее энергии. Сопряжение уменьшает полярность связи С-НаI и тем самым затрудняет условия для протекания реакций замещения. Подвижность галогена в ядре увеличивают электроноакцепторные заместители. Например, нитрогруппа в пара- или орто-положении к галогену.
ОПЫТ 11. ЛЕГКАЯ ПОДВИЖНОСТЬ ГАЛОГЕНА, СТОЯЩЕГО В БОКОВОЙ ЦЕПИ.
Выполнение работы.
В пробирку помешают 1 каплю хлористого бензила, 5 капель воды, нагревают до кипения и прибавляют 1 каплю раствора нитрата серебра. Немедленно выпадает белый осадок хлорида серебра.
Химизм процесса:
C 6H5-CH2Cl
+ HOH
C6H5-CH2OH
+ HCl
6H5-CH2Cl
+ HOH
C6H5-CH2OH
+ HCl
хлористый бензил бензиловый спирт
HCl + AgNO3 AgCl + HNO3
Атом галогена у α - углеродного атома боковой цепи обладает большой подвижностью.
Сделайте сравнительный вывод о химических свойствах галогенпроизводных алифатического и ароматического рядов. Отметьте отличительные особенности галогена в ароматических углеводородах (подвижность галогена в боковой цепи и прочную связь галогена в ядре).
Контрольные вопросы.
1. Напишите общую формулу моногалогенпроизводных предельных углеводородов.
2. От чего зависит изомерия галогенпроизводных?
3. Каким образом можно получить галогенпроизводные из предельных углеводородов, олефинов, спиртов? Напишите уравнения соответствующих реакций.
4.От каких факторов зависят физические свойства галогенроизводных?
5. Напишите уравнения химический реакций моногалогенпроизводных, характеризующие их химические свойства.
6. Какое техническое значение имеют галогенпроизводные непредельных углеводородов?
7. На какие две группы разделяются по строению, свойствам и методам получения ароматические углнводороды?
Как отличаются по реакционной способности галогеналкилы от простых галогенарилов?
8. Расскажите о правилах ориентации в бензеновом кольце. Приведите примеры.
9. Из бензена получите м-хлорнитробензен; п-бромнитробензен;
3,5-дибромнитробензен.
10. Напишите структурные формулы п-хлортолуена; о-бромбензойной кислоты; м-броманилина; 1,1-дихлорэтана; 1,2-дихлорэтана;
1,1,1,2-тетрахлорэтана; 1,1,2,2-тетрахлорэтана. Предложите схему систеза п-хлортолуена.
11. Как влияет применение катализаторов при галогенировании ароматических соединений?
ЛАБОРАТОРНАЯ РАБОТА № 9.
АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
(АМИНЫ И НИТРОСОЕДИНЕНИЯ)
Цель работы: изучение химических свойств азотсодержащих органических соединений.
Оборудование: микроскоп, технохимические весы, водяная баня, спиртовки, пробирки, предметные стекла, стеклянные палочки, микрошпатель,
Реактивы: бензен, азотная кислота концентрированная (ρ=1,4 г∕мл3);
серная кислота концентрированная (ρ=1,84 г∕мл3); кислота серная, 0,2 н раствор; кислота серная, 2 н раствор; толуен; нафтален (порошок); мочевина (порошок); мочевина, концентрированный раствор; вода дистиллированная; известковая вода; гидроксид натрия, 40 %-ный раствор; гидроксид натрия, 2н раствор; сульфат меди, 2%-ный раствор; соляная кислота, концентрированная (ρ=1,19 г/мл3); хлорная известь, насыщенный раствор; дихромат калия, 0,5 н раствор; бромная вода, насыщенный раствор; анилин; хлористый ацетил; уксусный ангидрид; формалин, 40%-ный раствор; уксусная кислота ледяная; метиловый спирт, лигнин (газетная бумага, личинка). Индикаторы: фенолфталеин, 1%-ный спиртовый раствор; лакмусовая бумага красная.
Методика проведения исследования.
О П Ы Т № 1. ПОЛУЧЕНИЕ НИТРОБЕНЗЕНА.
Выполнение работы.
В сухую пробирку помещают 2 капли концентрированной азотной кислоты и 3 капли концентрированной серной кислоты. Полученную нитрующую смесь охлаждают и добавляют 2 капли бензена. Пробирку помещают в водяную баню, нагретую до 50-55С, на 2-3 мин., постоянно встряхивая содержимое пробирки. После этого выливают реакционную смесь в заранее приготовленную пробирку с водой. На дно опускается капля тяжелого, чуть желтоватого нитробензена, мутного от присутствия влаги. Химизм процесса:
C 6H6 + HONO2 → C 6H 5NO2 + H 2O
Активной формой нитрующего агента является катион нитрония +NO2, образующийся при действии серной кислоты на азотную:
HO-NO2 + 2H2 SO4 ↔ +NO2 + 2HSO4-- + H3O+
Ион гидроксония H3O+ образуется из протона H+ и молекулы воды в водных растворах минеральных кислот. Катион нитрония реагирует с ароматическим углеводородом:





 H
-H+
H
-H+


 +
+NO2
+NO2
+
+
+NO2
+NO2
+
NO2
π – комплекс очень неустойчивый
σ - комплекс

 NO2
NO2
Скорость реакции нитрования зависит от объекта нитрования и состава нитрующей смеси. Для каждого соединения существует оптимальный состав.
О П Ы Т № 2. ПОЛУЧЕНИЕ ДИНИТРОБЕНЗЕНА.
Выполнение работы.
В пробирку помещают 2 капли азотной кислоты и 3 капли серной кислоты. К горячей нитрующей смеси приливают 2 капли нитробензена и нагревают в кипящей водяной бане при постоянном взбалтывании 3-4 мин.
Затем реакционную смесь охлаждают и выливают в пробирку с водой. Динитробензен вначале выделяется в виде тяжелой маслянистой капли, затем быстро переходит в кристаллическое состояние. Химизм процесса:
C 6H 5NO2 + HO-NO2 →C 6H4 (NO)2 + H 2O
Нитрогруппа относится к заместителям второго рода. Поэтому она уменьшает способность ароматического ядра к реакциям электрофильного замещения. Для введения второй нитрогруппы требуется большая длительность нитрования и более высокая температура, чем при получении мононитробензена. Для получения мононитробензена нужна температура 50С, а для получения динитробензена -90.
О П Ы Т № 3. Нитрование толуена.
В пробирке готовят нитрующую смесь из 2 капель концентрированной азотной кислоты и 3 капли концентрированной серной кислоты. К нитрующей смеси приливают 2 капли толуена и энергично встряхивают содержимое пробирки. Через 1-2 минуты реакционную смесь выливают в пробирку с водой. На дно опускается тяжелая капля нитротолуена:
 CH3
CH3

 NO2
NO2

 CH3
+ HO-NO2
+ Н2О
CH3
+ HO-NO2
+ Н2О
 CH3
CH3
 O2N
O2N
При нагревании толуена получается смесь о- и п- нитротолуенов.
В зависимости от условий нитрования относительные количества о- и п-изомеров в этой смеси различны.
Гомологи бензена нитруются легче, чем бензен.
О П Ы Т № 4 ПОЛУЧЕНИЕ НИТРОНАФТАЛЕНА.
Выполнение работы.
К 20 каплям концентрированной азотной кислоты добавляют 0,5 г. нафталена в порошке: при встряхивании смесь начинает желтеть уже на холоду. Нагревают смесь в кипящей водяной бане 5 мин. при частом встряхивании выделяется в виде оранжевого масла, быстро твердеющего при встряхивании. Продуктом реакции является преимущественно нитронафтален.
 NO2
NO2

 +HONO2
+
H2O
+HONO2
+
H2O
H2SO4
О П Ы Т № 5. СВОЙСТВА МОЧЕВИНЫ
Выполнение работы.
а) Гидролиз мочевины.
0,5 – 1 г. мочевины помещают в пробирку и растворяют в 4 - 5 мл воды.
К раствору добавляют баритовой или известковой воды и кипятят. Наблюдают образование нерастворимого белого осадка углекислого бария или кальция, а выделяющиеся пары имеют характерный запах аммиака и окрашивают лакмусовую бумажку в синий цвет. Процесс гидролиза мочевины можно выразить схемой:
N
 H2
OH
H2
OH
C
 =O
+ 2HOH → C=O (CO2+H
2O)
+ 2NH3
=O
+ 2HOH → C=O (CO2+H
2O)
+ 2NH3
NH2 OH
CO2 + Ba(OH)2 → BaCO3↓ + H2O.
б) Образование солей.
В пробирку к 3-4 мл концентрированного раствора мочевины прибавляют небольшое количество концентрированной азотной кислоты. При этом происходит разогревание смеси. При охлаждении реакционной смеси выпадает в осадок трудно растворимая в воде соль - азотнокислая мочевина. Мочевина обладает слабыми основными свойствами и поэтому способна образовывать соли с одним эквивалентом кислоты:

 NH2
NH 2·HNO3
NH2
NH 2·HNO3
C
 =O
+ HNO3
→
C=O
=O
+ HNO3
→
C=O
NH2
NH2
в) Взаимодействие мочевины с азотной кислотой.
В пробирку помещают 2-3 мл 3 %- ного раствора мочевины, приливают равный объем 3%-ного раствора азотокислого натрия, и смесь осторожно подкисляют разбавленной серной кислотой. Наблюдают выделение пузырьков азота и углекислого газа:
NaNO2 + H2SO4 → HNO2 + NaHSO4
 NH2
NH2
 C=O
+ 2HONO → 2N2
+
CO2
+
3H2O
|
C=O
+ 2HONO → 2N2
+
CO2
+
3H2O
|
NH2
Эта реакция применяется для количественного определения мочевины по объему выделившегося газа-азота.
г) Образование биурета.
В пробирке осторожно нагревают 0,5г. сухой мочевины. При этом сначала мочевина плавится, а затем происходит обильное выделение аммиака (что легко узнают по характерному запаху или по посинению смоченной лакмусовой бумажки); и затвердевание расплавленной массы. Нагревание прекращают после того, как расплавившаяся масса снова затвердевает. Пробирку охлаждают, добавляют 3-4 мл воды, и продукт реакции растворяют при слабом нагревании. К полученному раствору прибавляют 1-1 мл 10%-ного раствора едкого натра и 1-2 капли 2%-ного раствора медного купороса и встряхивают раствор окрашивают в характерный ярко-фиолетовый цвет вследствие образования комплексного медного соединения биурета:
(NH2CONHCONH2 )2 · 2KOH · Cu(OH)2
NH2-CO-NH2 + NH2-CO-NH2 → NH2-CO-NH-CO-NH2 +NH3
биурет
О П Ы Т 6. ОБРАЗОВАНИЕ СОЛЕЙ АНИЛИНА И ИХ РАЗЛОЖЕНИЕ.
Выполнение работы.
а) В пробирку помещают 1 каплю анилина, 8 капель воды и встряхивают содержимое пробирки. Одну каплю, эмульсии наносят на лакмусовую бумажку. Цвет красного лакмуса не меняется.
б) Приготовленную эмульсию анилина делят на две части.
К одной части добавляют по каплям раствор серной кислоты.
Образуется осадок сернокислого анилина. Нагревают пробирку до растворения осадка и медленно охлаждают. Выпавшие игольчатые кристаллы переносят на предметное стекло и рассматривают их форму в микроскоп. Химизм процесса:


 NH2
NH3
+
NH2
NH3
+
 +
H2SO4
SO4H-
+
H2SO4
SO4H-
кислый сернокислый анилин
в) К другой части эмульсии анилина добавляют по каплям концентрированную соляную кислоту до получения однородного раствора. К прозрачному раствору солянокислого анилина добавляют 1-2 капли фенолфталеина и по капля раствор щелочи. Жидкость мутнеет еще до появления малиновой окраски. Химизм процесса:
NH2 NH3 +
+ НСl Cl-
солянокислый
анилин

 NH3
+
NH3
+
 NH2
NH2
Сl- + NaOH + NaCl + H2O
Основные свойства аминогруппы, связанной с ароматическим ядром, значительно ослаблены по сравнению с аминами жирного ряда. Водный раствор анилина не окрашивает лакмус в синий цвет. Анилин образует соли только с сильными минеральными кислотами. Водные растворы этих солей имеют, кислую реакцию и их можно титровать щелочами.
О П Ы Т № 7. ЦВЕТНЫЕ РЕАКЦИИ АНИЛИНА.
Выполнение работы.
а) Цветная реакция с лигнином.
В пробирку помещают I каплю анилина, 5 капель воды и по каплям добавляют соляную кислоту до образования прозрачного раствора солянокислого анилина. Каплю этого раствора наносят на полоску газетной бумаги.
Появляется желто-оранжевое окрашивание. Лучинка, опущенная в раствор солянокислого анилина, также окрашивается в желто-оранжевый цвет. Окрашивание обусловлено присутствием в бумаге и древесине лигнина. Если раствором соли анилина смочить полоску фильтровальной бумаги, окрашивание не произойдет, так как фильтровальная бумага представляет собой чистую клетчатку без примеси лигнина.
б) Цветная реакция с хлорной известью.
Готовят раствор солянокислого анилина и каплю раствора наносят на предметное стекло. Добавляют каплю раствора хлорной извести. Появляется темно-зеленое окрашивание, переходящее в синее, а затем в черное. Эти реакции основаны на легкой окисляемости анилина. Конечным продуктом является «черный анилин» - краситель для хлопчатобумажных тканей.
О П Ы Т № 8. БРОМИРОВАНИЕ АНАЛИНА.
Выполнение работы.
В пробирку помещают 3 капли бромной воды и I каплю анилиновой воды. Выпадает белый осадок тримброманилина:
NH2 NH2


 Br Br
Br Br
 +
3Вr2
+ 3HBr
+
3Вr2
+ 3HBr

Br
триброманилин
Являясь электронодонорным заместителем, аминогруппа повышает электронную плотность в ароматическом ядре, облегчая этим реакции электрофильного замещения.
Вместо анилина можно использовать для этого опыта соли анилина. Они бромируются так же легко, как и сам анилин.
О П Ы Т № 9. ОБРАЗОВАНИЯ АЦЕТАНИЛИДА.
Выполнение работы.
Опыт проводят в вытяжном шкафу.
1. в пробирку помещают 2 капли анилина и 2 капли хлористого ацетила. К полученной смеси приливают 10 капель воды и энергично встряхивают. Для ускорения образования кристаллов ацетанилида стеклянной палочкой трут смоченные раствором стенки пробирки. Ацетанилид выпадает в виде кристаллов, образовавшийся солянокислой анилин остается в растворе:
O




 NH2
O NH
– C
– CH3
NH2
O NH
– C
– CH3
 +
СН3-С
+HCl
+
СН3-С
+HCl
Cl
ацетанилид
 +
+

 NH2
NH3
NH2
NH3
+ HCl Cl-
Солянокислый аналин
В пробирку помещают каплю анилина, 3 капли воды и I каплю уксусного ангидрида. Содержимое пробирки тщательно перемешивают. Выпадают кристаллы ацетанилида, застывшие в густую массу. Стеклянной палочкой переносят несколько кристаллов ацетанилида на предметное стекло и помещают в объектив микроскопа. Форму кристаллов зарисовывают в лабораторном журнале.
Химизм процесса:
 O
O
O O

 NH2
NH
–
C – CH3
NH2
NH
–
C – CH3
 +
СH3-C-O-C-CH3
+
+
СH3-C-O-C-CH3
+
+ CH3COOH
Анилидами называют амиды кислот, в которых атом водорода группы NH2 замещен на ароматический радикал. Анилиды представляющие собой замещенные амиды, реагируют подобно амидам. Например, при кипячении с водой в присутствии щелочей анилиды расщепляются с образованием анилина и кислоты.
О П Ы Т № 10. КОНДЕНСАЦИЯ АНИЛИНА С ФОРМАЛЬДЕГИДОМ.
Выполнение работы.
В пробирку помещают 2 капли анилина и 2 капли раствора формальдегида, закрывают пробкой и взбалтывают до образования белого аморфного порошка. Порошок промывают водой и метиловым спиртом (декантацией). к влажному порошку добавляют каплю уксусной кислоты и нагревают в пламени горелки. смесь сплавляется и окрашивается в желтый или оранжевый цвет. После сплавления получается прозрачный полимер. В нейтральном или слабощелочном растворе при эквимолекулярном соотношении компонетов образуется основание Шиффа С6H5 –N=CH2, которое нельзя выделить в чистом виде, так как оно самопроизвольно превращается в полимер:

 CH2
CH2
C6H5
 -N N
– C6H5
-N N
– C6H5
 H2C
H2C
 CH2
CH2
ангидроформальдегиданилин
N – C6H5
Анилин с избытком формальдегида в кислой среде дает высокомолекулярную анилиноформальдегидную смолу, сходную с бакелитом.
Сделайте вывод о химических свойствах азотсодержащих соединений. При оформлении лабораторных работ напишите уравнения химических реакций, используя структурные формулы соединений.
Контрольные вопросы.
1. Напишите общие химические формулы предельных алифатических нитросоединений и аминов.
2. В каком состоянии гибридизации находится атом азота в молекуле амина?
3. Какую группу называют амино-группой, какую - нитро-группой?
4. Расскажите о номенклатурах, используемых для названия нитросоединений и аминов.
5. Поясните, почему амины являются органическими основаниями.
6. Как изменяются основные свойства в ряду: (CH 3)2-NH; CH 3NH2; NH3;
C 6H 5NH 2.
7. Написать реакцию Н.Н. Зинина для нитробензена. В каких условиях она проходит?
8. Какие соединения называются псевдокислотами? Получите нитробутан и на его примере объясните явление таутомерии нитросоединений.
9. Напишите структурны формулы изомерных аминов состава C 4H 9NH 2.
Укажите первичные, вторичные, третичные амины. Дайте им названия по систематической номенклатуре. Как изменяются основные свойства данных аминов?
10. Из бензена получите нитробензен и анилин. Приведите механизм реакции сульфирования полученных соединений.
ЛАБОРАТОРНАЯ РАБОТА № 10.
АМИНОКИСЛОТЫ, БЕЛКОВЫЕ ВЕЩЕСТВА.
Цель работы: изучение химических свойств аминокислот.
Оборудование: спиртовки или водяная баня, пробирки, капельницы, предметные стекла,
Реактивы:
№ опыта |
Название реактива |
концентрация |
№ капельницы |
Примечание |
1 |
Аминоуксусная кислота Метиловый оранжевый Метиловый красный Лакмус |
0,2 н р-р р-р р-р |
13 27 26 28 |
На столе На полке На полке На полке |
2 |
Аминоуксусная кислота Оксид меди Едкий натр |
0,2 н крист. 2 н |
13 11 7 |
На столе Набор тв. в-в На столе |
3 |
Аминоуксусная кислота Формальдегид Метиловый красный |
0.2 н р-р р-р |
13 58 26 |
На столе На полке На полке |
4 |
Нитрит натрия Аминоуксусная кислота Соляная кислота |
1 н 0,2 н 2 н |
22 13 12 |
На полке На столе На столе |
5 |
Едкий натр Едкий натр Азотная кислота Сульфат меди Уксуснокислый свинец Азотно-ртутный реактив |
2 н конц. конц. 0,2 н 0,1 н |
7 39 37 9 14 24 |
На столе На полке На полке На столе На столе На столе |
6 |
Соляная кислота Едкий натр Метиловый оранжевый Фенолфталеин |
Конц. Конц. |
59 39 27 23 |
На полке На полке На полке На полке |
7 |
Сульфат аммония |
Насыщ. |
15 |
На столе |
8 |
Сульфат аммония |
Насыщ. |
15 |
На столе |
9 |
Азотная кислота Соляная кислота |
Конц. Конц. |
37 59 |
На полке На полке |
10 |
Сульфат меди Уксуснокислыйый свинец |
Насыщ. 2 н |
29 16 |
На полке На столе |
Методика проведения исследования:
ОПЫТ 1. ОТНОШЕНИЕ АМИНОКИСЛОТ К ИНДИКАТОРАМ.
Выполнение работы.
В пробирку помещают 2 капли раствора аминоуксусной кислоты и добавляют 1 каплю метилового оранжевого. Такой же опыт проделывают с метиловым красным и лакмусом. Окраска индикатора не меняется.
Аминокислоты обладают как кислотными, так и основными свойствами. Кислотная группа – COOH и основная – NH2 взаимно нейтрализуются, следовательно, аминокислоты имеют структуру амфотерных, или биполярных ионов (внутренние соли): Н3N-CH2-COO--.
Поэтому водные растворы одноосновных моноаминокислот нейтральны по отношению к индикаторам.
ОПЫТ 2. ОБРАЗОВАНИЕ МЕДНОЙ СОЛИ АМИНОКУКСУСНОЙ КИСЛОТЫ.
Выполнение работы.
В пробирку помещают немного порошка оксида меди CuO, 4 капли раствора, аминоуксусной кислоты и нагревают в пламени горелки, встряхивая содержимое пробирки. Пробирку ставят на некоторое время в штатив, чтобы осел избыток черного порошка оксида меди. К отстоявшемуся синему раствору подливают 1 каплю раствора едкого натра. Раствор остается прозрачным.
Для аминокислот характерно образование медных солей, окрашенных в синий цвет. α-аминокислоты дают с медью окрашенные внутренние комплексные соли, очень устойчивые:
NH2-CH2-COOH
NH2-CH2-COOH
CuO
+
+H2O
Связь между атомами меди и азота координационная за счет свободной пары электронов азота аминогруппы.
ОПЫТ 3. ДЕЙСТВИЕ МУРАВЬИНОГО АЛЬДЕГИДА НА АМИНОКИСЛОТЫ.
Выполнение работы.
В пробирку помещают 3 капли раствора формальдегида и 1 каплю метилового красного. Из-за дисмутации муравьиного альдегида раствор окрашивается в красный цвет. При помощи пипетки с капиллярным отверстием приливают по каплям раствор щелочи до появления желтой окраски (нейтральная среда на метиловый красный).
В
монооксметил- аминокислота
N
 H2-CH2-COOH
NH-CH2OH-CH2-COOH
H2-CH2-COOH
NH-CH2OH-CH2-COOH
 CH2COOH
CH2COOH
 N CH2OH
N CH2OH

CH2OH
дисксиметил-аминокислота
Блокированная муравьиным альдегидом аминогруппа не влияет на карбоксил, и раствор аминокислоты приобретает, кислую реакцию.
ОПЫТ 4. ДЕЙСТВИЕ АЗОТИСТОЙ КИСЛОТЫ НА АМИНОКИСЛОТЫ.
Выполнение работы.
В пробирку помешают 2 капли раствора аминокислоты, 2 капли раствора нитрита натрия н 2 капли соляной кислоты. При встряхивании содержимого пробирки выделяются пузырьки газа. Химизм процесса:
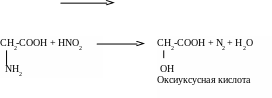 NaNO2
+ HCl
HNO2
+ NaCl
NaNO2
+ HCl
HNO2
+ NaCl
На этой реакции основано количественное определение аминогрупп в аминокислотах, а также в белках и продуктах их распада.
Выделяющийся азот определяется объемным методом.
ОПЫТ 5. ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ.
Выполнение работы.
а)Биуретовая реакция.
В пробирку помешают 2 капли исследуемого раствора сульфата меди, жидкость окрашивается в фиолетовый цвет, который заметен в окрашенной водной вытяжке мяса. Биуретовая реакция связана с наличием в белках пептидных группировок – CO-NH-, которые и обусловливают появление окраски при взаимодействии с солями меди.
б) Ксантопротеиновая реакция.
В пробирку вводят 3 капли водного раствора белка и 1 каплю азотной кислоты. Появляется белый осадок. При нагревании реакционной смеси раствор и осадок окрашиваются в ярко-желтый цвет. Смесь охлаждают и добавляют 1-2 капли едкого натра. При этом желтое окрашивание переходит в ярко-оранжевое. Ксантопротеиновая реакция обусловлена наличием в белках ароматических аминокислот. Желтое окрашивание появляется как результат нитрования ароматических ядер. Появление оранжевой окраски определяется образованием более интенсивно окрашенных анионов.
в) Реакция на серу.
В пробирку вводят комочек белой шерстяной пряжи, 2 капли раствора едкого натра и 1 каплю раствора уксуснокислого свинца и нагревают содержимое пробирки в пламени горелки. Появляется коричнево-черный осадок сульфида свинца. Эта реакция на содержание серы в белках. Ее дают белки, содержащие цистин, цистеин и метионин.
г) Азотно-ртутная реакция белков.
В пробирку помешают 2 капли раствора белка и 1 каплю азотно-ртутного реактива. Встряхивают содержимое пробирки и нагревают. Появляется характерное красное окрашивание. Эту реакцию дают белки, в состав которых входят аминокислоты, содержащие свободный фенольный гидроксил (тирозин, триптофан).
ОПЫТ 6. БУФЕРНЫЕ СВОЙСТВА РАСТВОРА БЕЛКА.
Выполнение работы.
В пробирку наливают каплю соляной кислоты, 15 капель дистиллированной воды и тщательно взбалтывают. Одну каплю этого раствора переносят в другую пробирку и добавляют еще 15 капель воды. К полученному очень разбавленному раствору соляной кислоты добавляют 2-3 капли метилового оранжевого. Проявляется красное окрашивание.
В чистую пробирку помещают три капли раствора белка и 1каплю окрашенного в красный цвет раствора соляной кислоты. Окраска переходит в желтую. Следовательно, уменьшается концентрация водородных ионов.
Готовят очень разбавленный раствор едкого натра (точно так же, как и соляной кислоты) и добавляют 2-3 капли фенолфталеина. Раствор щелочи окрашивается в розовый цвет.
В чистую пробирку помещают 3 капли раствора белка и 1 каплю окрашенного раствора щелочи. Розовая окраска исчезает. Следовательно, уменьшается концентрация гидроксильных ионов.
Белки - аморфные вещества. Они могут в растворе связывать как водородные ионы, так и гидроксильные (буферные свойства). В первом опыте белок реагировал как основание, во втором - как кислота.
ОПЫТ 7. КАЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ОТДЕЛЬНЫХ АМИНОКИСЛОТ МЕТОДОМ РАСПРЕДЕЛИТЕЛЬНОЙ ХРОМАТОГРАФИИ НА БУМАГЕ.
Метод распределительной хроматографии на бумаге.
Выполнение работы.
Применение метода распределительной хроматографии на бумаге для разделения аминокислот основано на различии в коэффициентах распределения отдельных аминокислот между двумя несмешивающимися жидкостями. Используемая в качестве инертного носителя хроматографическая бумага способна удерживать в порах большее количество неподвижной жидкой фазы.
Коэффициент
распределения
![]() ,
определяемый как отношение расстояний,
пройденных аминокислотой и подвижной
фазой от точки старта, является характерной
величиной для каждой аминокислоты в
определенных условиях опыта (состав
растворителя, температура, сорт
хроматографической бумаги).
,
определяемый как отношение расстояний,
пройденных аминокислотой и подвижной
фазой от точки старта, является характерной
величиной для каждой аминокислоты в
определенных условиях опыта (состав
растворителя, температура, сорт
хроматографической бумаги).
Положение аминокислот на бумаге определяют с помощью цветной реакции с нингидрином.
При нагревании до 700С и выше α-аминокислоты окисляются нингидрином, подвергаясь окислительному дезаминированию и декарбоксилировани. Нингидрин восстанавливается.
O
O
+
H2O
O R-C
+ CO2
+ NH3
+
H







NH2-CH-COOH
+
R



O
+
Восстановленный нингидрин, конденсируясь с NH3 и окисленным нингидрином, образует соединение, которое превращается в окрашенную форму (сине-фиолетовая окраска).

В присутствии органических растворителей возможно образование соединений, содержащих в своем составе радикал аминокислот (красного, голубого, желтого цветов).
OH
O

N
CH
CH
R
O
OH
Наличие радикала аминокислоты в составе этого соединения обуславливает различную окраску (красную, желтую, голубую) соединений, возникающих при реакции аминокислот с нингидрином.
Реакция с нингидрином является специфической для аминокислот, содержащих α-аминогруппу, и характерна как для некоторых карбоновых, так и циклических аминокислот. В реакции глицерина с нингидрином образуется комплексное соединение, имеющее сине-фиолетовую окраску.
В присутствии нингидрина отдельные аминокислоты выявляются в виде пятен, окрашенных в голубой, фиолетовый, желтый или другой цвет (в зависимости от химической структуры аминокислот).
Идентификацию аминокислот в смеси проводят по распределению известных аминокислот (стандартов).
Материалы и методы. Хроматографическая бумага; растворитель – смесь n-бутанола, уксусной кислоты, воды (4:1:1); смесь аминокислот и их стандартные растворы (0,1%-ный раствор аланина, лейцина и глутаминовой кислоты), свежеприготовленный нингидриновый реактив (95мл 0,5%-ного раствора нингидрина в 95%-ном ацетоне, 1 мл ледяной уксусной кислоты и 4 мл дистиллированной воды).
Оборудование. Эксикатор или чашечка Петри, пульверизатор, микропипетки, сушильный шкаф, карандаш, линейка, часы.
Ход работы. Хроматографическую бумагу вырезают в форме круга, диаметр которого равен поверхностному радиусу эксикатора (или чашки Петри). Простым карандашом круг разделяют на сегменты, в центре делают небольшое отверстие (0,5-1 см), в которое вставляют свернутую в трубочку бумагу (фитиль). Изменяя толщину и длину фитиля, который опущен в растворитель, регулируют скорость подачи растворителя на хроматографическую бумагу.
Карандашом у основания фитиля на хроматографической бумаге в каждом сегменте намечают точку нанесения аминокислот. На один из сегментов с помощью микропипетки наносят смесь аминокислот (5-10 мкл раствора аланина, лейцина и глутаминовой кислоты), на другие сегменты - такое же количество аминокислот – стандартов. Затем хроматографическую бумагу высушивают на воздухе в течение 10 мин. В эксикатор (или чашку Петри) наливают растворитель – смесь n-бутанола, уксусной кислоты и воды (4:1:1) в таком объеме, чтобы фитиль был погружен в растворитель. Круговую хроматограмму помещают в экискатор (или между двумя половинками чашки Петри). Хроматограмма с диаметром 12 см образуется примерно через 1 ч, с диаметром 20 см - через 2 ч. после завершения распределения (фронт растворителя дошел до установленной отметки) хроматограмму высушивают и проявляют, опрыскивая нингидриновым реактивом из пульверизатора и прогревая в сушильном шкафу в течение 10 мин при температуре 1100С.
Сравнивая положение пятен смеси аминокислот с положением пятен аминокислот – стандартов, проводя идентификацию пятен смеси аминокислот. С помощью линейки определяют расстояния, пройденные фронтом растворителя и аминокислотами, и вычисляют значения коэффициента распределения.
ОПЫТ 8. ОБРАТИМОЕ ОСАЖДЕНИЕ БЕЛКОВ ИЗ РАСТВОРИТЕЛЕЙ.
Реактив и материалы: белки, водные растворы; сульфат аммония, насыщенный водный раствор.
В пробирку помещают 2 капли раствора белка, 2 капли насыщенного раствора сульфата аммония и слегка взбалтывают. Появляемся муть выпадающего в осадок белка (глобулина). Одну каплю мутного раствора приливают в одну пробирку с 3 каплями воды и встряхивают. Осадок растворяется.
При добавлении к водным растворам белков концентрированных растворов минеральных солей белки осаждаются (высаливаются). При охлаждении они не изменяют своих свойств и при разбавлении водой вновь переходят в раствор.
ОПЫТ 9. СВЕРТЫВАНИЕ БЕЛКОВ ПРИ НАГРЕВАНИИ.
Реактивы и материалы: белки, водные растворы; сульфат аммония, 2 н раствор.
В пробирку наливают 4 капли раствора белка и нагревают в пламени горелки до кипения. Белок при этом выпадает в виде мути или хлопьев. Содержимое пробирки слегка охлаждают, добавляют каплю раствора сульфата аммония и нагревают до начала кипения, количество свернувшегося белка при этом увеличивается.
Свертывание белков при нагревании характерно для большинства из них. Добавление нейтральных солей (сульфата аммония, хлорида натрия) облегчает и ускоряет свертывание белков при нагревании.
Свертывание белков - процесс необратимого осаждения, так как белковые молекулы при этом меняют свою структуру.
ОПЫТ 10. ОСАЖДЕНИЕ БЕЛКОВ КОНЦЕНТРИРОВАННЫМИ МИНЕРАЛЬНЫМИ КИСЛОТАМИ.
Реактивы н материалы: белки, водные растворы; азотная кислота (d=1,41 г/см3); соляная кислота (d=1,19 г/см3).
В пробирку наливают 2 капли концентрированной азотной кислоты и осторожно, наклонив пробирку, по стенке добавляют 2 капли раствора белка. Через несколько секунд на границе раздела белка и кислоты образуется кольцо свернувшегося белка. При встряхивании количество свернувшегося белка увеличивается.
Такой же опыт повторим с соляной кислотой. Осадок, выпавший при действии соляной кислоты, при встряхивании растворяется.
Концентрированные минеральные кислоты образуют с белками солеобразные соединения и одновременно вызывают свертывание белков. В большинстве случаев выпавший осадок растворим в избытке концентрированной кислоты (кроме азотной).
ОПЫТ 10. ОСАЖДЕНИЕ БЕЛКОВ СОЛЯМИ ТЯЖЕЛЫХ МЕТАЛЛОВ.
Реактивы и материалы: белки, водные растворы; сульфат меди, насыщенный раствор; уксуснокислый свинец, 2 н раствор.
В две пробирки помещают по 3 капли раствора белка. В одну пробирку добавляют 1 каплю раствора сульфата меди, в другую - 1 каплю раствора уксуснокислого свинца. Образуется хлопьевидный осадок или муть. С солью меди - осадок голубого цвета, с солью свинца – белого.
Соли тяжелых металлов осаждают белку из растворов, образуя с ними нерастворимые в воде солеобразные соединения.
Сделайте вывод о химических свойствах аминокислот.
Контрольные вопросы.
1. Какие функциональные группы содержат аминокислоты?
2.Расскажите об изомерии и номенклатуре аминокислот.
3. Что такое биполярный ион? Как он ведет себя в кислой и щелочной средах?
4. Расскажите о способах получения ά-аминокислот.
5. Какие соединения дают γ- и δ-аминокислоты?
6. Для лейцина, глицина и аланина напишите их химические названия, уравнения диссоциации в водном растворе, состояние ионизации в сильно кислой и сильно щелочной средах; определите, в какой среде находятся их изоэлектрические точки. Напишите уравнения реакций каждой из аминокислот с HCI, KOH,HNO 2,CH 3OH при нагревании.
7. Какие соединения называются аминокислотами? Напишите примеры следующих аминокислот: моноаминомонокарбоновой, диаминомонокарбоновой, моноаминодикарбоновой. Для них приведите реакции с HCI, NaOH. Назовите полученные соединения.
8. Напишите уравнения реакций получения α-аминомасляной кислоты из соответствующего альдегида. Напишите уравнения реакций ее взаимодействия с азотистой кислотой, с двумя молекулами глицина.
9. Получите дипептид из фенилаланина и лизина. В какой среде лежит его изоэлектрическая точка?
10. Сравните химические свойства, обусловленные наличием аминогруппы, в следующих соединениях: этиламине, ацетамиде, аминоуксусной кислоте.
ЛАБОРАТОРНАЯ РАБОТА № 11.
МОНОСАХАРИДЫ
Цель работы: изучение химических свойств моносахаридов.
Оборудование: спиртовки, пробирки, пипетки.
Реактивы:
|
Название реактива |
Концентра-ция |
№ капельницы |
примечание |
1 |
Глюкоза α-нафтол Крахмал Сахароза фруктоза |
Тв. 10% спирт тв. тв. тв. |
15 96 38 39 40 |
Набор тв. в. Под тягой Набор тв. в. Набор тв. в. Набор тв. в.
|
2 |
Глюкоза Едкий натр Сульфат меди |
2% 2 н 0,2 н |
18 7 9 |
На полке На столе На столе |
4 |
Глюкоза Реактив Фелинга |
2% |
18 31 |
На полке На полке |
5 |
Глюкоза Нитрат серебра Аммиак Едкий натр |
2% 0,2 н 2 н 2 н |
18 4 33 7 |
На полке На столе Под тягой На столе |
6 |
Глюкоза Фруктоза Бромная вода Хлорное железо фенол |
2% 2% насыщ. 0,1 н |
18 95 41 11 47 |
На полке На полке Под тягой На столе Под тягой |
7 |
Глюкоза Фруктоза Раствор йода Едкий натр Серная кислота |
2% 2%
2 н 10% |
18 95 56 7 5 |
На полке На полке Под тягой На столе На столе |
8 |
Глюкоза Едкий натр |
1% конц. р-р |
17 39 |
На полке Под тягой |
9 |
Глюкоза Фруктоза Серная кислота Соляная кислота |
Тв. Тв. Конц. Конц. |
15 40 57 59 |
Набор тв. в Набор тв. в Под тягой Под тягой |
10 |
Глюкоза Фруктоза Реактив Селиванова |
2% 2% |
18 95 94 |
На полке На полке Под тягой |
Методика проведения исследования.
ОПЫТ 1 . ОБЩАЯ РЕАКЦИЯ НА УГЛЕВОДЫ С α – НАФТОЛОМ (Реакция Молиша).
Выполнение работы.
В отдельные пробирки помещают по 0,1 г различных углеводов: глюкозу, фруктозу, сахарозу, крахмал, клетчатку (маленький кусочек фильтровальной бумаги размером 2-3 мм2).В каждую пробирку прибавляют по 10 капель воды и 3-4 капли спиртового раствора α- нафтола. Содержимое пробирок перемешивают и осторожно, чтобы жидкость не смешивалась, добавляют по 7-10 капель концентрированной серной кислоты, которая при этом опускается на дно пробирки. На границе двух слоев наблюдается красно-фиолетовое кольцо. При взбалтывании смесь разогревается и окрашивается по всему объему, а при разбавлении ее водой выделяются окрашенные хлопья.
Реакцию с α-нафтолом дают все углеводы. Появление окраски обусловлено расщеплением молекулы углевода при действии концентрированной серной кислоты с образованием фурфурола или его производных, которые вступают в реакцию конденсации с α- нафтолом, образуя окрашенные вещества.
ОПЫТ 2. ДОКАЗАТЕЛЬСТВО НАЛИЧИЯ ГИДРОКСИЛЬНЫХ ГРУПП В ГЛЮКОЗЕ.
Выполнение работы.
В пробирку помещают 1 каплю раствора глюкозы и 5 капель раствора едкого натра. К полученной смеси добавляют 1 каплю раствора сульфата меди (II) и встряхивают содержимое пробирки. Образующиеся вначале голубоватый осадок гидроксида меди (II) Cu(OH)2 мгновенно растворяется и получается прозрачный раствор сахарата меди, имеющий слабую синюю окраску:
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
CHO
CHO
CHO
CHOH
CHOH
CH2OH Глюкозат
меди
CHO
CHOH
CHOH
CHOH
CHOH
CH2OH глюкоза

+
Cu(OH)2
2
Cu
+
2H2O
Моносахариды взаимодействуют с гидроксидами, а также с оксидами тяжёлых металлов, подобно многоатомным спиртам. При этом водород гидроксильных групп замещается на металл, и образуются производные моносахаридов типа алкоголятов, называемые сахаратами.
Растворение гидроксида меди (II) Cu(OH)2 доказывает наличие гидроксильных групп в глюкозе.
Полученный раствор сохраняют для следующего опыта.
ОПЫТ 3. ОКИСЛЕНИЕ ГЛЮКОЗЫ ГИДРОКСИДОМ МЕДИ (П) В ПРИСУТСТВИИ ЩЕЛОЧИ (РЕАКЦИЯ ТРОММЕРА).
Выполнение работы.
К полученному в предыдущем опыте щелочному раствору сахарата меди добавляют 5-6 капель воды. Содержимое пробирку нагревают над пламенем горелки, держа пробирку наклонно, так чтобы нагревалась только верхняя часть раствора, а нижняя оставалась без нагрева (для контроля).
При осторожном нагревании до кипения нагретая часть синего раствора окрашивается в оранжево-жёлтый цвет вследствие образования гидроксида меди (I) CuOH. При более продолжительном нагревании может образоваться красный осадок оксида меди (I) Cu2O. Химизм процесса:
2 Cu(OH)2
2CuOH
+ H2O
+
O2
Cu(OH)2
2CuOH
+ H2O
+
O2
2CuOH Cu2O + H2O
Положительную реакцию Троммера дают только те углеводы, которые имеют свободный гликозидный гидроксил, то есть все моносахариды, а из дисахаридов- мальтоза, лактоза. Углеводы, не имеющие свободной альдегидной или кетонной группы, то есть сахароза, крахмал, гликоген и другие, реакции Троммера не дают
ОПЫТ 4. ОКИСЛЕНИЕ ГЛЮКОЗЫ РЕАКТИВОМ ФЕЛИНГА.
Выполнение работы.
В пробирку вносят 3 капли раствора глюкозы и каплю реактива Фелинга. Содержимое пробирки осторожно нагревают в пламени горелки. При этом наблюдается изменение окраски жидкости, выделение жёлтого осадка, переходящего в красный осадок закиси меди.
Реакция фелинговой жидкости с глюкозой протекает весьма сложно, но сводится к окислению глюкозы и образованию закиси меди:
COOK +
2
CHO
CHO
COONa

COOK +
2
CHOH
CHOH
COONa

Cu +2H2O
+
Cu2O


Жидкость Фелинга служит для обнаружения карбонильной группы в сахарах. Положительную реакцию о фелинговой жидкостью дают те же углеводы, которые дают положительную реакцию Троммера.
ОПЫТ 5. ОБРАЗОВАНИЕ "СЕРЕБРЯНОГО ЗЕРКАЛА".
Выполнение работы.
В пробирку помещают каплю раствора нитрата серебра, 2 капли раствора едкого натра и приливают по каплям раствор аммиака до растворения образовавшегося осадка гидроксида серебра. Затем добавляют I каплю раствора глюкозы и слегка подогревают содержимое пробирки над пламенем горелки до начала почернения раствора. Дальше реакция идет без нагревания и металлическое серебро выделяется на стенках пробирки в виде блестящего зеркального налёта. Химизм процесса:
C=O H
H-C-OH
HO-C-H
H-C-OH
H-C-OH
H2C-OH
C =O
OH
H-C-OH
HO-C-H
H-C-OH
H-C-OH
H2C-OH


+
2[Ag(NH3)2]OH
+
2Ag + 4NH3
+ H2O
Моносахариды легко окисляются, причем в зависимости от условий получаются разнообразные продукты окисления. При осторожном окислении альдоз в кислой или нейтральной среде образуются альдоновые кислоты (одноосновные многоатомные оксикислоты). Кетозы (например, фруктоза) в этих условиях не окисляются.
При окислении моносахаридов в щелочном растворе не удаётся выделить продукты окисления с тем же числом углеродных атомов.
Окисление оксидом серебра в щелочной среде служит качественной реакцией на моносахариды.
ОПЫТ 6. ОКИСЛЕНИЕ МОНОСАХАРИДОВ БРОМНОЙ ВОДОЙ.
Выполнение работы.
В одну пробирку вносят 5 капель глюкозы, в другую - 5 капель фруктозы. В каждую пробирку добавляют по 10 капель бромной воды и смесь нагревают на кипящей водяной бане в течете 15 мин. Если за это время окраска не исчезнет, то кипятят жидкость 0,5-1 мин. на пламени горелки до полного обесцвечивания.
Охладив оба полученных раствора (содержавших глюкозу и фруктозу) в воде до комнатной температуры, добавляют к каждому из них по несколько капель раствора хлорного железа и сравнивают появившуюся в них окраску.
В кислой среде окисление сахаров протекает довольно медленно: при этом алъдогексозы превращаются в полиоксикислоты, сначала в одноосновные, затем в двухосновные.
Глюкоза в условиях опыта дает одноосновную глюконовую кислоту:
B r2 + H2O HBr + HOBr
C H2OH(CHOH)4C=O
+ HOBr CH2OH(CHOH)4COOH
+ HBr
H2OH(CHOH)4C=O
+ HOBr CH2OH(CHOH)4COOH
+ HBr
H
Глюконовая кислота имеет 5 гидроксильных групп, в том числе одну в α-положении к карбоксилу, и дает характерную для α -оксикислот цветную реакцию.
Кетогексозы более устойчивы к действию окислителей: фруктоза в условиях опыта почти не окисляется. Кетогексозы при более энергичном окислении распадаются, давая оксикислоты с меньшим числом атомов углерода.
ОПЫТ 7. ОКИСЛЕНИЕ АЛЬДОЗЫ И КЕТОЗЫ ЙОДОМ.
Выполнение работы.
Опыт проводят параллельно с растворами глюкозы и фруктозы. К 5 каплям каждого из растворов добавляют одновременно по 1 капле раствора йода и затем разбавляют щелочь (одинаковое число капель) до обесцвечивания смеси: отмечают по часам время добавления щелочи и ставят обе пробирки в штатив. Через 7-8 минут приливают в обе пробирки по 1 капле разбавленной серной кислоты и сравнивают появившуюся окраску. Химизм процесса:
I 2 + 2NaOH NaI + NaOI + H2O
C H2OH(CHOH)4C=O + NaOI CH2OH(CHOH)4COOH + NaI
H
Добавление кислоты, которая связывает щелочь, сдвигает равновесие реакции влево. Однако за время опыта в растворе альдозы-глюкозы большая часть гипоиодита успевает израсходоваться на окисление глюкозы до глюконовой кислоты, и при подкислении смеси свободный йод уже почти не выделяется. Кетоза-фруктоза окисляется медленнее: за то же время йодноватистокислая соль почти не исчезает, и подкислении выделчяетя свободный йод. При более длительном стоянии гипойодит постепенно расходуется и в растворе, содержащем фруктозу.
ОПЫТ 8. ДЕЙСТВИЕ ЩЕЛОЧЕЙ НА МОНОСАХАРИДЫ.
Выполнение работы.
В пробирку наливают 10 капель 10%-ного раствора глюкозы, добавляют равный объем 20-30%-ного раствора едкого натра и осторожно нагревают до кипения. Раствор желтеет. При более продолжительном нагревании жидкость приобретает бурую окраску, и, наконец, осмоляется.
ОПЫТ 9 . РЕАКЦИЯ МОНОСАХАРИДОВ С МИНЕРАЛЬНЫМИ КИСЛОТАМИ.
Выполнение работы.
а) Несколько крупинок глюкозы и фруктозы растворяют в отдельных пробирках в 1-2мл воды. К холодному раствору осторожно, по стенкам пробирки добавляют равный объем концентрированной серной кислоты, стараясь не взболтать смесь. Серная кислота образует нижний, тяжелый слой под раствором сахара. На границе этих слоев постепенно появляется темно-бурое кольцо. Если на холоде кольца не образуется, слегка подогревают содержимое пробирки, не взбалтывая его.
б) Небольшое количество какой-либо альдопентозы кипятят с 2 мл концентрированной соляной кисты. При этом происходит дегидратация альдопентозы и переход ее в фурфурол.
CHOH-CHOH
CH2OH
CHOH-C=O
H
-3H2O
CH CH
CH
C-C=O
O
H
фурфурол







Образовавшийся фурфурол открывают прибавлением к продукту реакции несколько капель анилина н уксусной кислоты. Получается красивое розовое окрашивание.
Г
CH CH
HOH2C-C
C-C=O
O H
 ексозы
при нагревании с минеральными кислотами
в аналогичных условиях переходят в
нестойкий оксиметилфурфурол, который
распадается на муравьиную
и левулиновую кислоты.
ексозы
при нагревании с минеральными кислотами
в аналогичных условиях переходят в
нестойкий оксиметилфурфурол, который
распадается на муравьиную
и левулиновую кислоты.
-3H2O
H
 OH2C-CHOH-CHOH-CHOH-CHOH-C=O
OH2C-CHOH-CHOH-CHOH-CHOH-C=O


H
 CH3-CO-CH2-CH2-COOH
+ H-COOH
CH3-CO-CH2-CH2-COOH
+ H-COOH
Левулиновая кислота
ОПЫТ 10. РЕАКЦИЯ СЕЛИВАНОВА НА КЕТОЗЫ.
Выполнение работы.
Опыт одновременно проводят с растворами глюкозы и фруктозы.
К 0,5-1 мл каждого из растворов добавляют 2 мл реактива Селиванова, после чего погружают все пробирки на 2 мин в кипящую водяную баню.
Раствор фруктозы быстро окрашивается в ярко красный цвет. Окраска зависит от взаимодействия образующегося оксиметилфурфурола с резорцином.
Альдогексозы в этих условиях реагируют гораздо медленнее, и раствор окрашивается лишь в слабо-розовый цвет.
Сделайте вывод о химических свойствах моносахаридов.Какие химические свойства характерны для альдоз и кетоз?
Контрольные вопросы.
1. Наличие, каких функциональных групп характерны для альдоз и кетоз?
2. Что такое моносахариды? Что такое гексозы и пентозы?
3.Напишите химические реакции моносахаридов с участием гидроксильных групп и альдегидной группы.
4. Напишите уравнения химический реакций, характеризующих специфические свойства глюкозы.
5. Какие вещества называются эпимерами?
6. Какие продукты получаются при восстановлении моноз?
7. Какие продукты образуются при алкилировании и ацелировании глюкозы?
Напишите соответствующие уравнения реакции и назовите полученные соединения.
8. Напишите формулу L-глюкозы в циклической и оксикарбонильной формах.
9. В чем заключается явление таутомерии? Объясните на примере L-глюкозы.
10. Какое практическое применение имеют моносахара?
ЛАБОРАТОРНАЯ РАБОТА № 12.
ДИСАХАРИДЫ И ПОЛИСАХАРИДЫ.
Цель работы: изучение химических свойств дисахаридов и полисахаридов.
Оборудование: поляриметр, технохимические весы, электроплитка, асбестовая сетка, фарфоровые выпарительные чашки, водяная баня, спиртовки, конические колбы вместимостью 250 мл, мерные колбы вместимостью 100 мл, химические воронки, бюксы, шпатель, химические стаканчики, пробирки, часовые стекла, фильтровальная бумага, мерные цилиндры, индикаторная фенолфталеиновая бума, пинцет, термометр, стеклянные палочки..
Реактивы:
№ опыта |
Название реактива |
Концентра-ция |
№ капельницы |
Приме-чание |
1 |
Сахароза Едкий натр Сульфат меди |
2% 2 н 0, 2 н |
21 7 9 |
На полке На столе На столе |
2 |
Фелинговая жидкость Сахароза Лактоза мальтоза |
2% 2% 2% |
31 21 19 20 |
На полке На полке На полке На полке |
3 |
Нитрат серебра Аммиак Едкий натр Лактоза Сахароза мальтоза |
0,2 н 2 н 2 н 2% 2% 2% |
4 43 7 19 21 20 |
На столе Под тягой На столе На полке На полке На полке |
4 |
Сахароза Серная кислота Едкий натр Фелинговая жидкость Соляная кислота резорцин |
2% 10% 2 н
конц. тв. |
21 5 7 31 59 3 |
На полке На столе На столе
Под тягой Набор тв. в. |
5 |
Глюкоза сахароза |
Тв. тв. |
15 39 |
Набор тв. в. Набор тв. в. |
6 |
Крахмал Серная кислота Йод в иодиде калия Гидроксид натрия Реактив Фелинга |
1% 10%
10% |
30 5 44 72 31 |
На полке На столе Под тягой На столе |
7 |
Клетчатка (вата) Азотная кислота Серная кислота Этиловый спирт Диэтиловый эфир |
Конц. Конц. |
37 57 48 85 |
Под тягой Под тягой Под тягой Под тягой |
8 |
Клетчатка (вата) Уксусный ангидрид Уксусная кислота Ацетон Хлороформ Серная кислота |
Конц.
Конц. |
40 45 36 42 57 |
Под тягой Под тягой Под тягой Под тягой Под тягой |
Методика проведения исследования:
ОПЫТ 1. ДОКАЗАТЕЛЬСТВО НАЛИЧИЯ ГИДРОКСИЛЬНЫХ ГРУПП В САХАРОЗЕ.
Выполнение работы.
В пробирку помещают 5 раствора сахарозы, 10 капель раствора щелочи и 10 капель воды. Добавляют каплю раствора сульфата меди (II). Смесь приобретает слабую синеватую окраску вследствие образования сахарата меди. Раствор сахарата меди осторожно нагревают до кипения над пламенем горелки, держа пробирку так, чтобы нагревалась только верхняя часть раствора. Сахароза в этих условиях не окисляется, что указывает на отсутствие в ее молекуле свободной альдегидной группы.
ОПЫТ 2. ОТНОШЕНИЕ ДИСАХАРИДОВ К ФЕЛИНГОВОЙ ЖИДКОСТИ.
Выполнение работы.
В три пробирки наливают по 2 мл фелинговой жидкости. В одну прибавляют 2 мл раствора сахарозы, в другую - 2 мл раствора лактозы и в третыо - 2 мл раствора мальтозы. Все три пробирки нагревают одновременно на кипящей водяной бане в течение 1-2 минут. В пробирках с мальтозой и лактозой фелигова жидкость восстанавливается с образованием красного осадка закиси меди. В пробирке с раствором сахара изменений не наблюдается, что указывает на неспособность сахарозы к реакциям восстановления, так как она не имеет ни свободных гликозидных гидроксилов, ни карбонильных групп.
Лактоза и мальтоза относятся к сахарам. При нагревании одно из окисных колец в молекуле разрывается и образуется альдегидная группа, которая окисляется до карбоксильной, а фелингова жидкость восстанавливается с образованием закиси меди.
У сахарозы связь между остатками глюкозы и фруктозы образована за счет двух гликозидных гидроксилов, поэтому она не способна к реакциям восстановления фелинговой жидкости.

ОПЫТ 3. ОТНОШЕНИЕ ДИСАХАРИДОВ К АММИАЧНОМУ РАСТВОРУ ОКИСИ СЕРЕБРА.
Выполнение работы.
В три чистые пробирки, вымытые горячей щелочью с водой, наливают по 3 мл аммиачного раствора окиси серебра. В одну из них прибавляю 2 мл 2%-ного раствора лактозы, во вторую 2 мл 2%-ного мальтозы и в третью 2 мл 2%-ного раствора сахарозы. Все три пробирки помещают на несколько минут в стакан с водой, нагретой до 80-90°.
Если стенки пробирки достаточно хорошо вымыты, то в первом в во втором случаях наблюдается выделение металлического серебра в виде серебряного зеркала.
В пробирке с раствором сахарозы изменений не наблюдается, что указывает на нестабильность сахарозы к реакциям восстановления.
ОПЫТ 4. ГИДРОЛИЗ (ИНВЕРСИЯ) САХАРОЗЫ.
Выполнение работы.
В пробирку помещают 4 мл 2%-ного раствора сахарозы, несколько капель разбавленной серной кислоты и кипятят в течение 3-5 минут. Часть полученного таким образом раствора инвертного сахара после его охлаждения нейтрализуют раствором едкого натра до слабо щелочной реакции, добавляют фелинговой жидкости и вновь нагревают. Моносахариды, образовавшиеся в результате гидролиза, восстанавливают фелинговую жидкость с выделение красного осадка закиси меди:
CH2OH H-C
O- C H-C-OH
HO-C-H
HO-C-H
H-C-OH
О
O H-C-OH
H-C
H-C
CH2OH CH2OH




+
H2O
H2SO4



OH
CH2OH
H-C
HO- C
H-C-OH
HO-C-H
HO-C-H
O + H-C-OH O
H-C-OH
H-C
H-C
CH2OH
CH2OH α-Д-глюкоза
β-Д-фруктоза










Со второй частью кислого гидролиза проделывают реакцию Селиванова. К раствору добавляют концентрированной соляной кислоты, кристаллик резорцина и нагревают. Появление вишнево-красного окрашивания указывает на присутствие в гидролизе фруктозы.
ОПЫТ 5. ОПРЕДЕЛЕНИЕ УДЕЛЬНОГО ВРАЩЕНИЯ ГЛЮКОЗЫ И САХАРОЗЫ.
Выполнение работы.
УСТРОЙСТВО И ПРИНЦИП ПОЛЯРИМЕТРА.
Удельное вращение оптически активных веществ определяют с помощью поляриметра. Поляриметры бывают различных систем, но большинство из них построено по определенной схеме. Луч света от источника света 1 (рис. 1) проходит последовательно через желтый светофильтр 2, поляризатор 3, где свет поляризуется, через трубку 4 (для исследуемого раствора), анализатор 5 и окуляр 6 с лупой для наведения на фокус.
Если обе призмы (поляризатор и анализатор) установлены параллельно и трубка 4 наполнена оптически недеятельным веществом, то поляризованный луч света проходит через нее и поле зрения будет освещено. Если же в трубку 4 помещено оптически активное вещество, то оно вызывает отклонение плоскости поляризации на некоторый угол α, вследствие чего свет только частично пройдет через анализатор и поле зрения затемнится. Поворачивая анализатор с помощью связанного с ним рычага, можно снова получать полное освещение поля зрения, Угол, на который приходится поворачивать анализатор, равен углу, на который отклоняется плоскость поляризации оптически деятельным веществом.
Нулевой точкой прибора считают такое положение анализатора, при котором обе половины поля анализатора освещены равномерно, а по диаметру его расположена едва заметная линия раздела. Нулевую точку находят, слегка вращая анализатор.
Если при исследовании оптически активного вещества для получения однородно освещенного поля анализатор поворачивают вправо (по часовой стрелке), то вещество называют правовращающим и вращение обозначают знаком л+л (плюс). Если же анализатор поворачивает влево (против часовой стрелки), то это указывает на левое вращение, обозначаемое знаком "-" (минус).
При определении нулевой точки и исследовании оптической активности вещества делают несколько (4-5) отсчетов, берут среднее значение.
ОПРЕДЕЛЕНИЕ УДЕЛЬНОГО ВРАЩЕНИЯ ГЛЮКОЗЫ И САХАРОЗЫ.
Сначала определяют нулевую точку прибора. Для этого в трубку поляриметра наливают дистиллированную воду. Пузырьки воздуха мешают определению. Если в трубке окажется пузырек, то наклоном трубки его перемещают в расширение 4. Заполненную трубку помещают в желоб поляриметра между поляризатором и анализатором, с помощью выдвижного окуляра получают резкое изображение поля зрения и, медленно вращая анализатор, устанавливают нулевую точку по равномерной освещенности поля. Целое число градусов отсчитывают по верхней шкале, а десятые доли градуса - по нижней шкале (нониусу). Значение нулевой точки алгебраически вычитают из величины угла вращения, найденного при исследовании вещества.

1 2
3 4
5 6
Рис.1. Схема устройства поляриметра: 1-источник света; 2- желтый светофильтр; 3- поляризатор (призма Николя); 4 - трубка для исследуемого раствора; 5 – анализатор (трубка Николя); 6 - окуляр с лупой для наведения на фокус.
Раствор α-Д-глюкозы готовят непосредственно перед измерением угла вращения, так как в водном растворе глюкозы с течением времени величина угла вращения изменяется вследствие мутаротации.
Отвешивают в бюксе 4,5-5,0 г глюкозы с точностью до 0,01 г. Навеску переносят в мерную колбу емкостью 100 мл, растворяют глюкозу в дистиллированной воде и доводят раствор до метки. Выливают воду из трубки поляризатора, споласкивают ее 2-3 раза раствором глюкозы и наполняют. Определяют угол вращения раствора глюкозы. Из найденного угла вращения вычитают поправку - значение нулевой точки.
В другой мерной колбе на 100 мл растворяют в воде 5 г сахарозы. Трубку поляриметра ополаскивают 2-З раза раствором сахарозы, затем наполняют ее и определяют угол вращения. Оставляют раствор сахарозы в трубке поляриметра и через 1-1.5 ч снова определяют угол вращения. Убеждаются, что он остается постоянным (раствор сахарозы не мутаротирует).
Величина угла вращения оптически деятельного вещества зависит от ряда факторов: от природы вещества, концентрации раствора, температуры, толщины слоя раствора, через которую проходит луч света, длины волны поляризованного света, от природы растворителя. Поэтому определяют удельное вращение /α/, которое при конкретных условиях является постоянной величиной (константой данного вещества).
Удельным вращением называет угол вращения (в градусах) плоскости поляризации, которое вызывает раствор, содержащий в 1 мл 1 г оптически активного вещества при толщине слоя раствора в 1 дм.
Обычно
при исследований указывают температуру
раствора и длину волны света: например,
![]() означает, что определение удельного
вращения проводили при 200С
в свете желтого натриевого пламени
(спектральная линия Д). Удельное вращение
рассчитывают по формуле:
означает, что определение удельного
вращения проводили при 200С
в свете желтого натриевого пламени
(спектральная линия Д). Удельное вращение
рассчитывают по формуле:

где α - найденный в опыте угол вращения; m -количество граммов вещества в 100 мл раствора; l -толщина слоя раствора, выраженная в дециметрах.
Рассчитайте удельное вращение сахарозы и α-Д-глюкозы и сравните полученные величины с указанными в справочнике.
ОПЫТ 6. КИСЛЫЙ ГИДРОЛИЗ КРАХМАЛА.
Выполнение работы.
В коническую колбу емкостью 50 мл 20-25 мл 1%-ого крахмального клейстера и 5 мл 10%-ной серной кислоты. В 7-8 пробирок пробирок наливают по 1 мл очень разбавленного раствора йода в иодиде калия (светло-желтого цвета), пробирки ставят в штатив. В первую пробирку вносят 1-3 капли подготовленного для опыта раствора крахмала. Отмечают образовавшуюся окраску. Затем колбу нагревают на асбестовой сетке небольшим пламенем горелки. Через 30 секунд после начала кипения отбирают пипеткой вторую пробу раствора, которую вносят во вторую пробирку с растворов йода, после встряхивания отмечают цвет раствора. В дальнейшем отбирают пробу раствора через каждые 30 сек. и вносят их в последующие пробирки с раствором йода. Отмечают постепенное язменение окраски растворов при реакции с йодом. Изменение окраски происходит в следующем порядке:
-
Номер пробы
Окраска с йодом
1
Синяя
2
Сине-фиолетовая
3
Красно-фиолетовая
4
Красновато-бурая
5
Оранжевая
6
Оранжево-желтая
7
Желтая (цвета йода)
После того как реакционная смесь перестанет давать окраску с йодом, смесъ кипятят еще 2-З мин, после чего ее охлаждают и нейтрализуют 10 %-ным раствором гидроксида натрия, добавляя его по каплям до щелочной реакции среды (появление розовой окраски на фенолфталеиновой индикаторной бумаге).
Часть щелочного раствора переливают в пробирку, смешивают с равным объемом реактива Фелинга и нагревают. Выпадает красный осадок оксида меди (I). Химизм процесса:
( C6H10O5)n
(C6H10O5)x
1/2n
C12H22O11
C6H10O5)n
(C6H10O5)x
1/2n
C12H22O11
крахмал декстрины мальтоза
n C6H12O6
Д-глюкоза
Итак, гидролиз крахмала под влиянием кислот происходит ступенчато, с образованием промежуточных продуктов гидролиза декстринов, которые гидролизуются дальше до мальтозы, а последняя до глюкозы.
Амилодекстрины с раствором йода дают фиолетовое окрашивание, эритродекстрины дают красно-бурое окрашивание, ахродекстрины с раствором йода окрашивания не дают.
ОПЫТ 7. ПОЛУЧЕНИЕ АЗОТНОКИСЛЫХ ЭФИРОВ КЛЕТЧАТКИ.
В пробирку помещают 4 капли азотной кислоты и 8 капель серной кислоты. Горячий раствор слегка охлаждают и погружают в него при помощи стеклянной палочки маленький кусочек ваты. Пробирку нагревают на водяной бане при температуре 700С, осторожно помешивая палочкой вынимают образовавшийся коллоксилин, тщательно промывают проточной водой, отжимают в фильтровальной бумаге и сушат в фарфоровой чашечке на кипящей бане.
Полученный желтоватый коллоксилин делят на две частя. Кусочек коллоксилиновой ваты подносят к пламени горелки - она мгновенно вспыхивает. Другой кусочек коллоксилиновой ваты помещают в сухую пробирку, добавляют 4 капли смеси спирта и эфира 1:1 и перемешивают. Коллоксилин набухает и образует коллоидный раствор, называемый коллодием. Коллодий выливают на предметное стекло. После испарения растворителя образовавшуюся тонкую пленку снимают со стекла и вносят в пламя горелки. Пленка коллодия сгорает медленнее, чем коллоксилиновая вата. Химизм процесса:
OH
C6H7O2
OH OH
n
ONO2
C6H7O2
ONO2
ONO2
n



H2SO4


+
2n HO-NO2
+
2n H2O


ОПЫТ 8. ПОЛУЧЕНИЕ ТРИАЦЕТАТА КЛЕТЧАТКИ.
Оборудование: оптическое стекло; стеклянная палочка; химический стаканчик; фильтровальная бумага; водяная баня; фарфоровая чашечка; часовое стекло.
Реактивы: клетчатка (вата); уксусный ангидрид; уксусная кислота ледяная; ацетон; хлороформ; серная кислота d=1,84 г/см3.
В пробирку помещают 5 капель уксусного ангидрида, 5 капель ледяной уксусной кислоты и 1 каплю серной кислоты. Небольшой кусочек ваты тщательно в течение нескольких минут смачивают водой, отжимают и расщипывают. В приготовленную смесь вату вводят в несколько приемов. При этом смесь сильно разогревается, и ее охлаждают холодной водой. Когда разогревание смеси прекратится, пробирку ставят в горячую воду и перемешивают содержимое стеклянной палочкой до полного растворения клетчатки. Полученный раствор выливают в стаканчик с 25 мл холодной воды. Выпавшие хлопья отжимают в фильтровальной бумаге, расщипывают и подсушивают в фарфоровой чашечке на кипящей бане.
Небольшую часть полученного сухого триацетата клетчатки помещают в пробирку, добавляют 4 капли ацетона и медленно нагревают до слабого кипения 1-2 мин. Полученный раствор выливают на предметное стекло. После испарения ацетона на стекле остается пленка. Химизм процесса:
OH
C6H7O2
OH OH
n
OCOCH3
C6H7O2
OCOCH3
OCOCH3
n





+
3n (CH3CO)2O



+3n
CH3COOH
Сделать вывод о химических свойствах ди- и полисахаридов.
Контрольные вопросы.
1. Какие органические соединения относятся к дисахаридам?
2. Какие соединения относятся к полисахаридам? Напишите их общую формулу.
3. Напишите уравнения химический реакций, характеризующих химические свойства крахмала.
4. Напишите уравнения химических реакций, характеризующих химические свойства клетчатки.
5 Напишите структурные формулы амилозы и амилопектина.
6. Укажите общее химическое свойство, которое присуще сахарозе, крахмалу и целлюлозе. Ответ подтвердите уравнениями реакций.
7. Составьте уравнения реакций следующих превращений:
крахмал → глюкоза → этанол → оксид углерода(IV) → глюкоза.
8. Напишите структурные формулы трегалозы, мальтозы, целлобиозы, лактозы и сахарозы. Какие из этих сахаров обладают восстанавливающими свойствами.?
9. В чем суть процесса инверсии сахарозы?
10. Что лежит в основе процесса мутаротации? Дайте объяснения.
Рекомендуемая литература.
Основная.
Аверина А.В., Снегирева А.Я. Лабораторный практикум по органической химии. — М.: «Высшая школа», 1980.
Бобрівник Л.Д. та ін. Органічна хімія: Підручник для студентів вищого навчального закладу. — К., Ірпінь: ВТФ «Перун», 2002.—544с.
Кононський О.І. Органічна хімія. Підручник.— К.: Дакор, 2003.—568с.
Маковецький П.С. Курс органічноі химии: — К.: Вища школа., 1980.—472с.
Степаненко Б.Н. Курс органической химии: В 2 ч. — М.: Высшая школа, 1976. — ч.1 и 2.
Петров А.А. и др. Органическая химия. — М.: Высшая школа, 1978.—672с.
Веселовская Т.К. и др. Вопросы и задачи по органической химии.— М.: Высшая школа, 1977.—230с.
Некрасов В.В. Руководство к малому практикуму по органической химии.— М.: Химия, 1975.—328с.
Березин Б.Л., Беоезин Л.Б. Курс современной органической химии. Учебное пособие для ВУЗов.—М.: Высшая школа, 1999.—768с.
Нечаев А.П. Органическая химия. Учебник. — М.: Высшая школа, 1988.—319с.
Нечаев А.П., Еременко Т.В. Органическая химия. Учебник. — М.: Высшая школа, 1985.— 463с.
Писаренко А.П. Курс органической химии.— М.: Высшая школа, 1975.—510с.
Дополнительная
Холодова Ю.Д. та інш. Біоорганічна хімія.— К.: Альфа-принт, 2000.—268с.
Пивоваренко В.Г. Основи біоорганічної хімії. — К.: Освіта, 1998. — 176с.
Стеценко О.В. та інш. Хімія та основи біохімії. — К.: Рад.школа, 1998.—176с.
Органічна хімія в Інтернеті
http://library.chem.kniv.ua Велика бібліотека підручників з органічної хімії хімічного факультету Київського національного університету ім. Тараса Шевченка.
http:// www.chemistry.ssu.samara.ru. Органічна хімія: Інтерактивний підручник. /Під. ред.. Г.І.Дерябіної/.
http:// www.cit.ssau.ru/organics. Електронний підручник з органичної хімії.
http:// www.websab.ru/noos/chemistry/organic.htm/. Хімічна література.
http:// chemistryens.hll.ru/statiorg.htm.Хімічна енциклопедія.
http:// www.anriintern.com/ chemistry. Хімічна література.
http:// chemister.fannar.ru/Books/Chembooks. Хімічна література.
http://chembook.hard.ru. Хімічна література.
© Головач Галина Ивановна
ОРГАНИЧЕСКАЯ ХИМИЯ
Методические указания для выполнения
лабораторных работ
студентов направления 6.051701 «Пищевая технология и инженерия» специальности «Технология хранения, консервирования и переработки рыбы и морепродуктов» и направления 6.090201 «Водные биоресурсы и аквакультура»
дневной и заочной форм обучения.
Тираж __________ Экз. Подписано к печати ______________
Заказ № Объем 3,5 п.л.
Изд-во «Керченский государственный морской технологический университет»
98309, г. Керчь, Орджоникидзе, 82
