
- •Введение
- •Трансгенные мыши: методология
- •Использование ретровирусных векторов
- •Метод микроинъекций днк
- •Использование модифицированных эмбриональных стволовых клеток
- •Электропорация.
- •Биобаллистическая трансформация.
- •Липофекция (2-я модель).
- •Клонирование с помощью переноса ядра
- •Перенос генов с помощью искусственных дрожжевых хромосом
- •Трансгенные мыши: применение
- •Трансгенный крупный рогатый скот
- •Трансгенные овцы, козы и свиньи
- •Трансгенные птицы
- •Трансгенные рыбы
- •Заключение
- •Список использованной литературы
Трансгенные птицы
Микроинъекция ДНК в оплодотворенные яйцеклетки птиц с целью получения трансгенных линий — непростая процедура. Это связано с некоторыми особенностями воспроизводства и развития птиц. Так, при оплодотворении у птиц в яйцеклетку могут проникнуть сразу несколько сперматозоидов, а не один, как это обычно бывает у млекопитающих, и идентифицировать тот мужской пронуклеус, который соединится с женским, становится невозможно. Метод микроинъекции ДНК в цитоплазму тоже не подходит, поскольку в этом случае ДНК не интегрируется в геном оплодотворенной яйцеклетки. Наконец, даже если удастся осуществить микроинъекцию ДНК в ядро, дальнейшие операции будет трудно осуществить, поскольку у птиц яйцеклетка после оплодотворения достаточно быстро обволакивается прочной мембраной, покрывается слоем альбумина и внутренней и наружной известковыми оболочками.
Однако трансген можно вводить в область желтка (зародышевый диск), который содержит и женский, и мужской пронуклеусы и образуется раньше, чем скорлупа. После введения ДНК каждую яйцеклетку культивируют in vitro, и когда образуется зародыш, его помещают в суррогатное яйцо, чтобы имитировать вылупление. При помощи такой стратегии была получена одна линия трансгенных цыплят. Однако в настоящее время этот метод неэффективен и технически трудновыполним в обычных условиях.
К тому времени, когда наружная известковая оболочка яйцеклетки птиц затвердевает, зародыш, находящийся на стадии бластодермы, состоит из двух слоев по 40 000 и 80 000 клеток. Проведены эксперименты по инокуляции такого зародыша ретровирусными векторами с нарушенной репликацией, несущими бактериальные маркерные гены. В результате были получены трансгенные цыплята и обыкновенные перепела, несущие чужеродные гены в клетках зародышевой линии. Обычно такие птицы не продуцируют свободных вирусных частиц, и тем не менее применение ретровирусных векторов в качестве «поставщиков» чужеродных генов животным, которые затем могут использоваться в пищу, неизбежно вызывает вопросы относительно безопасности такого подхода. Кроме того, размер трансгена, который может быть введен в организм реципиента в составе ретровирусного вектора, не превышает ~8 т. п. н., а в некоторых случаях интеграция в исходный сайт нестабильна. Все это заставило исследователей искать альтернативные способы трансгеноза.
Никаких специфичных для птиц ЕS-клеток не обнаружено, поэтому подход, основанный на их использовании, для птиц неприменим. Более перспективным представляется метод с использованием рекомбинантных эмбриональных клеток. Он состоит в следующем. Выделяют клетки бластодермы из куриного эмбриона, трансфицируют их с помощью катионных липидов (липо-сом), связанных с трансгенной ДНК (липосомная трансфекция), и повторно вводят в подзародышевую область свежеотложенных яиц (рис. 11). Часть потомков будет нести в каком-то небольшом количестве клетки донора: таких животных называют химерами. У некоторых химер клетки, произошедшие от трансфицированных клеток, могут образовывать линии зародышевых клеток, и после нескольких раундов скрещиваний таких химер можно получить линии трансгенных животных. Чтобы увеличить вероятность создания химер, несущих чужеродные гены в клетках зародышевой линии, число донорских клеток в химерах можно увеличить облучением эмбрионов реципиента перед введением в них трансфицированных клеток (540-660 рад в течение 1 ч). Под действием облучения некоторые (но не все) клетки бластодермы погибнут, и соотношение между трансфицированными клетками и клетками реципиента увеличится в пользу первых. По-видимому, таким образом можно получать трансгенных цыплят, хотя и с малой эффективностью.
Трансгенных цыплят можно использовать для улучшения генотипа уже существующих пород — для придания им (in vivo) устойчивости к вирусным инфекциям и заболеваниям, вызываемым кокцидиями, повышения эффективности усвоения пищи, снижения уровня жира и холестерола в яйцах, повышения качества мяса. Было предложено также использовать яйцо с его высоким содержанием белка в качестве источника белковых продуктов, использующихся в фармацевтической промышленности. Экспрессия трансгена в клетках репродуктивного пути курицы, где обычно секретируется большое количество овальбумина, может способствовать накоплению соответствующего белкового продукта в яйце, откуда его можно затем выделить.
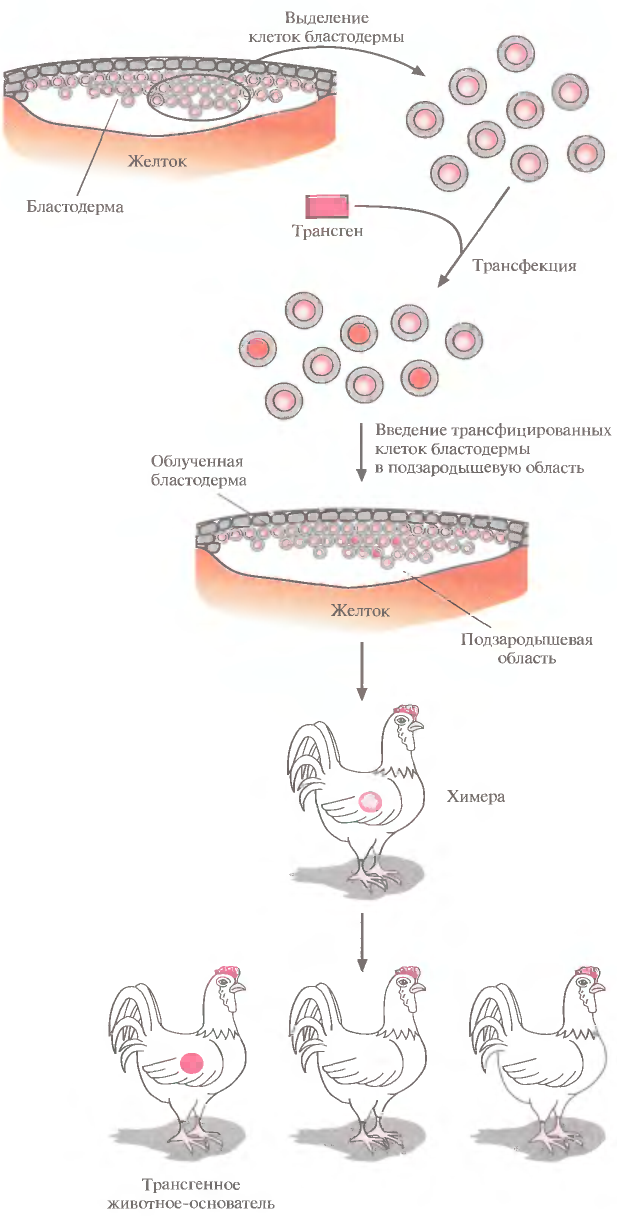
Рис. 11. Получение трансгенных цыплят трансфекцией изолированных клеток бластодермы. Выделенные клетки трансфицируют трансгеном с помощью липосом и вводят в подзародышевую область облученной бластодермы реципиента. Часть полученных потомков являются химерами, а некоторые из них, несущие трансген в клетках зародышевой линии, при скрещивании могут дать начало трансгенным линиям.
