
- •Оглавление
- •I. Теория химических процессов 3
- •Вопросы для подготовки к экзамену по курсу охт, 2019
- •Балансовое :
- •Базисная система линейно независимых уравнений реакций.
- •4. Выход продукта:
- •Термодинамические закономерности. Константа равновесия и равновесная степень превращения. Способы управления равновесием химических реакций (температура, давление, избыток реагента и т.Д.), примеры.
- •Пример расчёта Хр (хАравн, хАmax)
- •Способы смещения равновесия
- •Кинетическая модель
- •Реакционная схема и ее отличие от базисной системы независимых уравнений
- •Иерархическая структура математической модели в химическом реакторе
- •Классификация хим процессов
- •Влияние с и т на r
- •Хим процесс с простой необратимой реакцией
- •Хим процесс с обратимой реакцией:
- •Хим процесс сложной реакции
- •Гетерогенный процесс “газ-твердое”. Модель “сжимающееся ядро”. Схема и математическое описание процессов. Наблюдаемая скорость и время полного превращения. Лимитирующая стадия. Способы интенсификации.
- •Общая схема модели „сжимающееся” ядро
- •Материальный баланс по
- •Частные случаи
- •Внешняя диффузия- лимитирующая стадия
- •Внутридиффузный режим
- •Кинетический режим.
- •Процесс на пористом катализаторе (
- •Математическое описание процесса
- •Классификация
- •Влияние на сильнее, чем влияние т
- •Характерный признаки хтс
- •Элементы хтс. Классификация.
- •Подситемы хтс
- •Типы технологических связей (назначение)
- •Синтез и анализ хтс
- •Модели хтс
- •Описательные модели хтс
- •Химическая схема
- •Операционная схема
- •Математическая модель
- •Графические модели
- •Функциональная схема
- •Структурная схема
- •Технологическая схема
- •Операторная схема
- •Синтез хтс Концепции синтеза хтс (обязательные требования)
- •Окисление диокисда серы
- •Абсорбция триоксида серы
- •Система двойного контактирования и двойной абсорбции (дк/да).
- •Окисление оксида азота
- •Абсорбция оксидов азота.
- •Энерготехнологическая система в производстве азотной кислоты.
-
Кинетический режим.








Каталитический процесс. Определение катализа и катализатора. Химический процесс в пористом зерне катализатора. Схема процесса и математическое описание. Наблюдаемая скорость превращения, возможные режимы. Коэффициент эффективности зерна катализатора (степень использования внутренней поверхности) и его зависимость от модуля Тиле-Зельдовича.
Катализ
– селективное
ускорение реакции катализаторами,
действия которых заключается в
многократным взаимодействии активных
центров с участниками реакции с
образованием промежуточных соединений
образование каждого из них требует
меньше энергии активации. 




 Катализ
гомогенный
Катализ
гомогенный
Гетерогенный


Непористые пористые
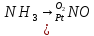 )
)
 10-500 м3/г
10-500 м3/г
Процесс на пористом катализаторе (
Общая
схема процесса


-
Внешняя диффузия
 к поверхности К
к поверхности К -
Внутреняя дифф
-
Хим реак (протекает паралельно II)
IV и V обратная диффузия (внутр и внеш)
Математическое описание процесса
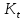 в
виде пластинки
в
виде пластинки
условия: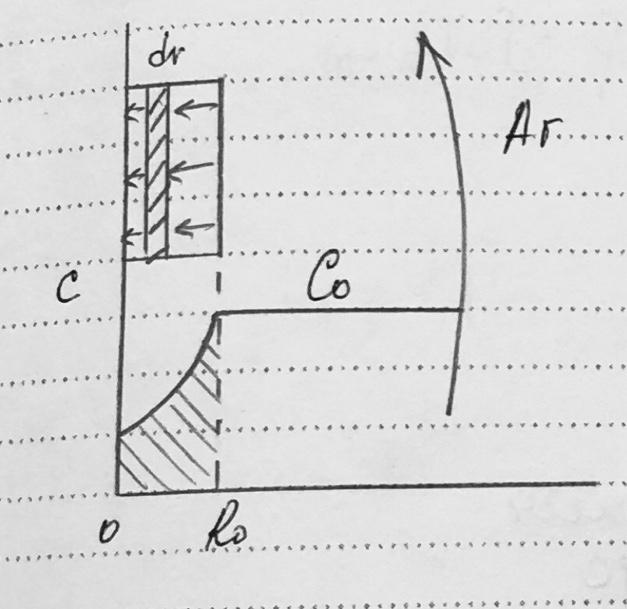
-
Отсутствие внеш диф торможения
-




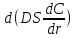 изменение
дифф потока
изменение
дифф потока


 1)при
1)при

2)
при


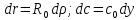
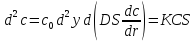


 – критерий
Тиле-Зальдовича
– критерий
Тиле-Зальдовича
Гр
усл


Общий вид:



 – гиперболический косинус
– гиперболический косинус


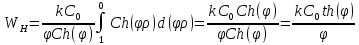
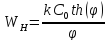

Теория химических реакторов
Химический реактор. Классификация. Функциональные элементы реактора. Общий вид математической модели химического процесса в реакторе. Основные математические модели. Реакторы идеального вытеснения и смешения. Математическое описание изотермического и неизотермического процессов в реакторах. Сравнение реакторов идеального вытеснения и смешения при осуществлении в них простых и сложных реакций в изо- и неизотермическом режиме. Явление тепловой устойчивости в химическом реакторе. Множественность и неоднозначность режимов. Способы управления тепловым режимом. Каскад реакторов идеального смешения. Аналитический и графический методы расчета К-ИС.
Хим реактор-аппарат для хим превращения веществ в в продукты.
Классификация
Вытеснения

Смешения Промежуточн


Схема
организации мат потоков (гидродинамика)

 Непрерывно
Гетерогенные
Непрерывно
Гетерогенные

назначение Класс
признак Принцип
действия



Гомогенные


полупериод
период
Схема
организации тепловых потоков



Изотермическ
Адиабатмчески С теплообемном

Автотермически Внутр Внешн
Функциональные элементы реактора
-
Реакционные зоны
-
Устроиства вход/выход
-
Вспомогательные устройства
Реактор „КС“ для „Г-Т“

Мат модерирование хим реакторов
Общий
вид уравнений материального и теплового
баланса для

Мат
баланс

Тепл
баланс
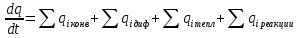
Основные мат модели:
|
ИС-п
(W – скор превращ) |
ИС-н
|
ИВ
|
Модели идеальный реакторов
-
РИС-п







Тепловой баланс:

 -
теплосодержащие
реакц зоны
-
теплосодержащие
реакц зоны


(1)+(2) -мат модель РИС-п с т/о
Типы моделей РИС-п
-
Изотермический


 t-действительное
время (можно измерить)
t-действительное
время (можно измерить)
-
Отсутствует теплообмен (адиабатический реактор)




 -max
изм
Т реакционной смеси после окончания
реакции
-max
изм
Т реакционной смеси после окончания
реакции
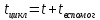
РИС-н


 – время
пребывания( контакта)
– время
пребывания( контакта)
Мат баланс:



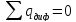
Для
А:



Тепловой баланс:
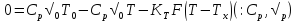
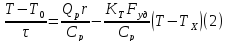
(1)+(2)- мат модель РИС-н с т/о
Типы моделей РИС-н
-
Изотерм реакт

-
Адиабат реакт

Без теплообмена:
Общее
решение:
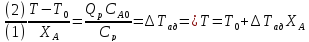 – ур адиабаты
– ур адиабаты
РИВ





Мат
и т.баланс для




Тепловой:


(1)+(2) – мат модель РИВ с теплообменником
Типы моделей РИВ
-
Изотермич реакт

-
Адибатич

Общее решение :


Сравнение и выбор эффективного реактора
Изотермические
реакторы

-
Для простых реакций(1 уравнение)-

-
Для сложных реакций
R цел
A

S побоч
Простые реакции
вход и выход одинаковы
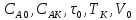






Выводы:
 равная интенсивность
равная интенсивность
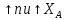 эффект РИС-н по относ к РИВ
эффект РИС-н по относ к РИВ
Графическое сравнение



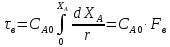


Автокалитические реакции:
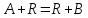
R-продукт реакции, кот
является катализатором

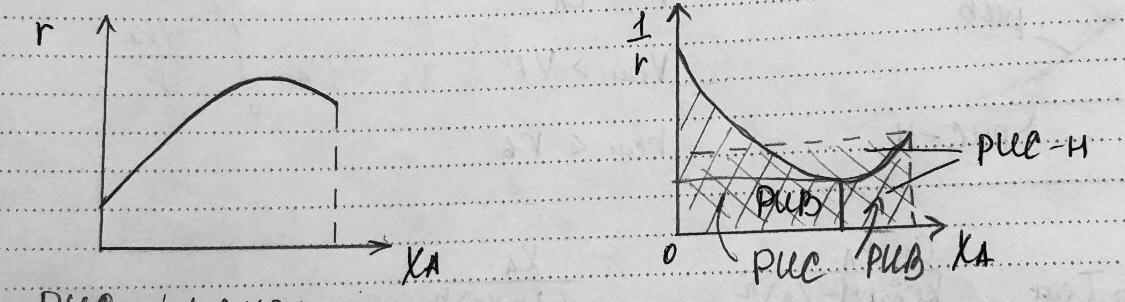
РИС – прямоуг

РИВ - площадь под кривой
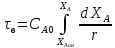
Сложные реакции
K1n1
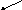
K2n2
А R

S

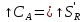 РИВ
РИВ
 РИС-н
РИС-н
Требования для сложных реакций – максимальная селективность.

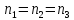


 РИВ
РИВ
Выбор реактора для неизотермических процессов
-
Простые реакции
 )
)

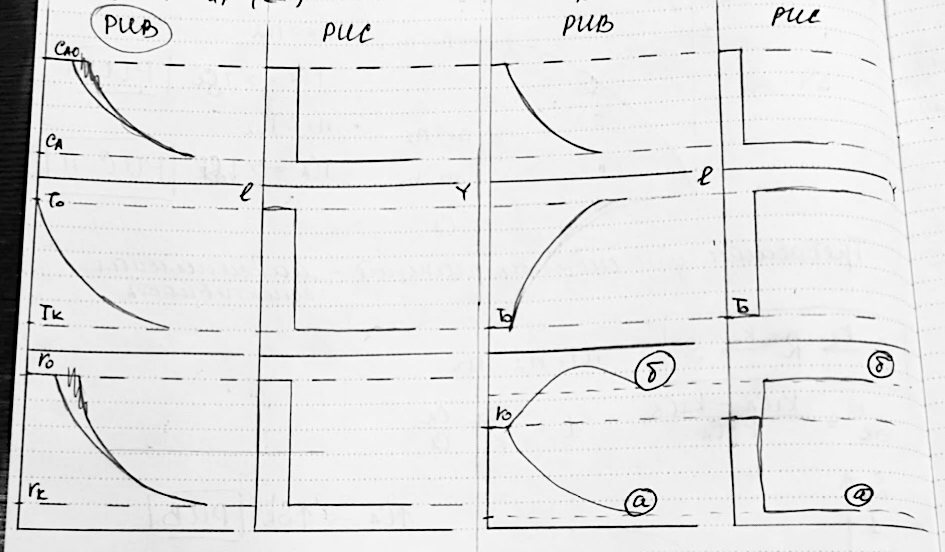

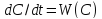 ,
,
 ,
,



