- •Оглавление
- •I. Теория химических процессов 3
- •Вопросы для подготовки к экзамену по курсу охт, 2019
- •Балансовое :
- •Базисная система линейно независимых уравнений реакций.
- •4. Выход продукта:
- •Термодинамические закономерности. Константа равновесия и равновесная степень превращения. Способы управления равновесием химических реакций (температура, давление, избыток реагента и т.Д.), примеры.
- •Пример расчёта Хр (хАравн, хАmax)
- •Способы смещения равновесия
- •Кинетическая модель
- •Реакционная схема и ее отличие от базисной системы независимых уравнений
- •Иерархическая структура математической модели в химическом реакторе
- •Классификация хим процессов
- •Влияние с и т на r
- •Хим процесс с простой необратимой реакцией
- •Хим процесс с обратимой реакцией:
- •Хим процесс сложной реакции
- •Гетерогенный процесс “газ-твердое”. Модель “сжимающееся ядро”. Схема и математическое описание процессов. Наблюдаемая скорость и время полного превращения. Лимитирующая стадия. Способы интенсификации.
- •Общая схема модели „сжимающееся” ядро
- •Материальный баланс по
- •Частные случаи
- •Внешняя диффузия- лимитирующая стадия
- •Внутридиффузный режим
- •Кинетический режим.
- •Процесс на пористом катализаторе (
- •Математическое описание процесса
- •Классификация
- •Влияние на сильнее, чем влияние т
- •Характерный признаки хтс
- •Элементы хтс. Классификация.
- •Подситемы хтс
- •Типы технологических связей (назначение)
- •Синтез и анализ хтс
- •Модели хтс
- •Описательные модели хтс
- •Химическая схема
- •Операционная схема
- •Математическая модель
- •Графические модели
- •Функциональная схема
- •Структурная схема
- •Технологическая схема
- •Операторная схема
- •Синтез хтс Концепции синтеза хтс (обязательные требования)
- •Окисление диокисда серы
- •Абсорбция триоксида серы
- •Система двойного контактирования и двойной абсорбции (дк/да).
- •Окисление оксида азота
- •Абсорбция оксидов азота.
- •Энерготехнологическая система в производстве азотной кислоты.
Окисление диокисда серы
Физико-химические свойтва процесса
Реакция
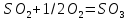 Является обратимой, экзотермической,
протекает на катализаторы смешением
объем. Тепловой эффект
Является обратимой, экзотермической,
протекает на катализаторы смешением
объем. Тепловой эффект
 реакции
при температуре
реакции
при температуре составляет 94,2 кДж/моль. Константа
равновесия
составляет 94,2 кДж/моль. Константа
равновесия
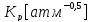 зависит
от температуры и в интервале
зависит
от температуры и в интервале
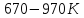 описанной следующие зависимостью:
описанной следующие зависимостью:

Согласно закону действующих масс, при равновесии
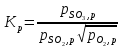
Где
 ,
,
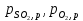 -парциальные
давления соответсвующ комп в сост
равновесия, атм.
-парциальные
давления соответсвующ комп в сост
равновесия, атм.
Равновесную степень превращения диоксиды
серы
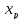 получим из ур
получим из ур
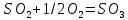 и усл равновес
и усл равновес

Выражение (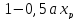 )
показывает относительное изменение
(уменьшение) объема реакционной смеси.
Уравнение (6.6) определяет x в неявном
виде и решается путем подбора значений.
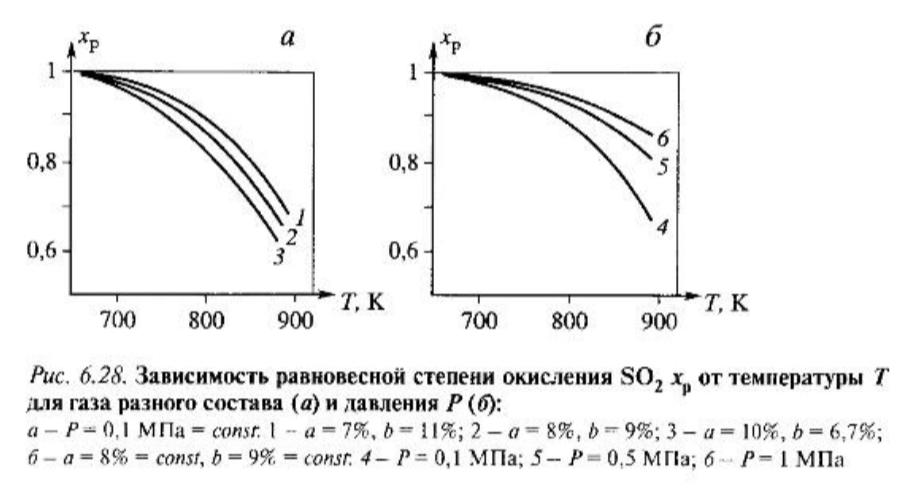
Зависимости х, от температуры, состава
реакционной смеси, полученной при обжиге
пирита, и давления приведены на рис.
6.28. Степени преврашения промышленного
интереса (около 99%) достигаются при
температурах 675-695 К. Так как давление
не сильно влияет на х в промышленности,
то процесс проводят при давлении, близком
к атмосферсному.
)
показывает относительное изменение
(уменьшение) объема реакционной смеси.
Уравнение (6.6) определяет x в неявном
виде и решается путем подбора значений.
Зависимости х, от температуры, состава
реакционной смеси, полученной при обжиге
пирита, и давления приведены на рис.
6.28. Степени преврашения промышленного
интереса (около 99%) достигаются при
температурах 675-695 К. Так как давление
не сильно влияет на х в промышленности,
то процесс проводят при давлении, близком
к атмосферсному.
Катализаторы окисления
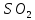 получают на основе оксида ванадия
получают на основе оксида ванадия
 с добавлением щелочных металлов,
осажденных на оксид кремния.
с добавлением щелочных металлов,
осажденных на оксид кремния.
Скорость реакции
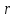 описывается уравнением Борескова-Иванова:
описывается уравнением Борескова-Иванова:
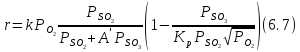
где
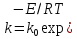 )-константа
скорости реакции; A' = 0,8-константа:
)-константа
скорости реакции; A' = 0,8-константа:
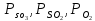 ,
- парциальные давления соответствующих
компонентов, атм.
,
- парциальные давления соответствующих
компонентов, атм.
Компоненты реакционной смеси взаимодействуют с катализатором и образуют соединения, которые фактически катализируют реакцию. Состав и свойства, в том числе каталитические, полученных соединений изменяются с изменением температуры. Энергия активации е реакции окисления изменяется сложным образом с температурой, как показано на рис. 6. 29.

На промышленном зерне катализатора окисление ингибируется реагентами в порах катализатора. Исследования показали, что наблюдаемая скорость трансформации может быть с достаточной точностью описана уравнением (6.7), но наблюдаемые значения константы скорости и энергии активации будут различны (линия 2 На фиг. 6.29). Например, для катализатора СВД:
|
Т,К………………………< 713 |
от 713 до 803 |
>803 |
|
E кДж/моль………………197 |
58.6 |
0 |
Температурные пределы и значения Е в них могут отличаться для разных катализаторов. Для катализаторов ИК-1-6 и СВД Е= 126 кДж / моль при Т < 693К. Это- низкотемпературные катализаторы. Активность промышленных катализаторов при температурах ниже 680К очень мала, а выше 880 К происходит их термическая деактивация. Поэтому диапазон рабочих температур большинства катализаторов находится в пределах 680-880 К, а степень конверсии в реакторе, определяемая нижней границей этого интевравала и составляет 98%.
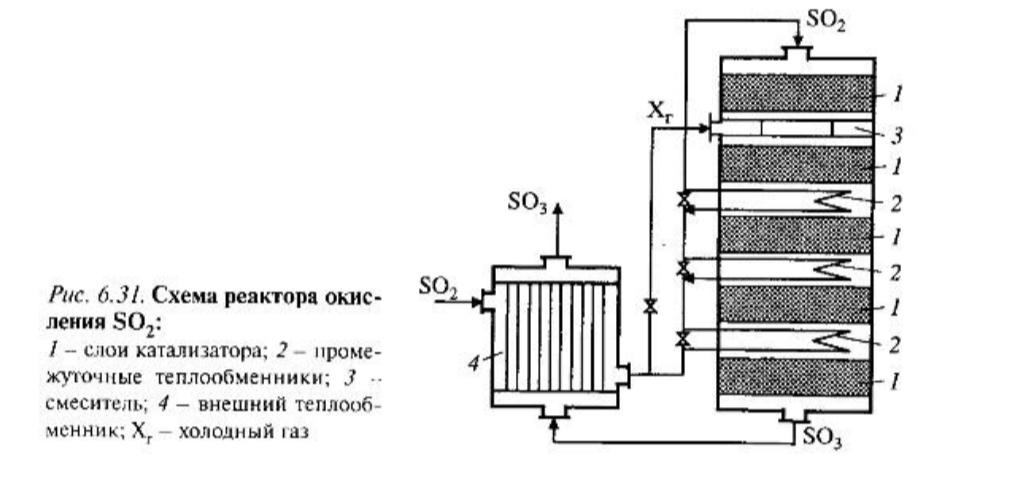
Схема реакционного узла.
Зависимость скорости превращения от
температуры характерна для обратимой
реакции. Рассчитанная по уравнению(6.7)
оптимальная температура
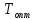 показана на рис. 6.30. В промышленности
приближение к теоретической температуре
показана на рис. 6.30. В промышленности
приближение к теоретической температуре
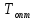 реализуется в многослойном реакторе
с адиабатическими слоями катализатора
и промежуточным отводом тепла. Охлаждение
между слоями осуществляется с помощью
теплообменников или продувки холодным
газом (обычно только верхнего слоя).
Наиболее распространенная схема реактора
приведена на рис. 6.31,
реализуется в многослойном реакторе
с адиабатическими слоями катализатора
и промежуточным отводом тепла. Охлаждение
между слоями осуществляется с помощью
теплообменников или продувки холодным
газом (обычно только верхнего слоя).
Наиболее распространенная схема реактора
приведена на рис. 6.31,
Исходная концентрация обрабатываемого газа выбирают таким образом, чтобы технологический режим находился в пределах рабочих температур катализатора. Большое значение Е при T < 713 К приводит к резкому снижению скорости реакции с понижением температуры.

Чтобы адиабатический процесс в первом
слое мог интенсивно развиваться,
начальная температура должна быть не
ниже 713 К. Ее называют «температурой
зажигания» (для низкотемпературных
катализаторов она ниже). На диаграмме
«Т-х» адиабатический процесс представлен
прямой линией, ее наклон определен
величиной адиабатического разогрева
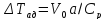 Для
окисления 1% SO2, составляет
приблизительно 28,2 градусов. Чем больше
Для
окисления 1% SO2, составляет
приблизительно 28,2 градусов. Чем больше
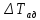 (или
исходная концентрация ад диоксида серы
а), тем больше разогрев (см. адиабаты на
рис. 6.30 для различных значений а). Процесс
может развиваться до установления в
системе равновесия, а максимальная
(равновесная) температура при этом не
должна превышать допустимую. На рис.
6.30 этому соответствует значения исходной
концентрации SO2, не превышающие
7-8%. Низкотемпературный катализатор
позволяет поднять концентрацию до
9-10%. Температуры в остальных слоях
определяют из оптимизации режима
реактора.
(или
исходная концентрация ад диоксида серы
а), тем больше разогрев (см. адиабаты на
рис. 6.30 для различных значений а). Процесс
может развиваться до установления в
системе равновесия, а максимальная
(равновесная) температура при этом не
должна превышать допустимую. На рис.
6.30 этому соответствует значения исходной
концентрации SO2, не превышающие
7-8%. Низкотемпературный катализатор
позволяет поднять концентрацию до
9-10%. Температуры в остальных слоях
определяют из оптимизации режима
реактора.
При выборе режима процесса в реакторе необходимо проверить его устойчивость. Первый слой в реакторе с теплообменником является системой «реактор с внешним теплообменником», в которой существующий режим может быть неустойчивым.