
- •Оглавление
- •I. Теория химических процессов 3
- •Вопросы для подготовки к экзамену по курсу охт, 2019
- •Балансовое :
- •Базисная система линейно независимых уравнений реакций.
- •4. Выход продукта:
- •Термодинамические закономерности. Константа равновесия и равновесная степень превращения. Способы управления равновесием химических реакций (температура, давление, избыток реагента и т.Д.), примеры.
- •Пример расчёта Хр (хАравн, хАmax)
- •Способы смещения равновесия
- •Кинетическая модель
- •Реакционная схема и ее отличие от базисной системы независимых уравнений
- •Иерархическая структура математической модели в химическом реакторе
- •Классификация хим процессов
- •Влияние с и т на r
- •Хим процесс с простой необратимой реакцией
- •Хим процесс с обратимой реакцией:
- •Хим процесс сложной реакции
- •Гетерогенный процесс “газ-твердое”. Модель “сжимающееся ядро”. Схема и математическое описание процессов. Наблюдаемая скорость и время полного превращения. Лимитирующая стадия. Способы интенсификации.
- •Общая схема модели „сжимающееся” ядро
- •Материальный баланс по
- •Частные случаи
- •Внешняя диффузия- лимитирующая стадия
- •Внутридиффузный режим
- •Кинетический режим.
- •Процесс на пористом катализаторе (
- •Математическое описание процесса
- •Классификация
- •Влияние на сильнее, чем влияние т
- •Характерный признаки хтс
- •Элементы хтс. Классификация.
- •Подситемы хтс
- •Типы технологических связей (назначение)
- •Синтез и анализ хтс
- •Модели хтс
- •Описательные модели хтс
- •Химическая схема
- •Операционная схема
- •Математическая модель
- •Графические модели
- •Функциональная схема
- •Структурная схема
- •Технологическая схема
- •Операторная схема
- •Синтез хтс Концепции синтеза хтс (обязательные требования)
- •Окисление диокисда серы
- •Абсорбция триоксида серы
- •Система двойного контактирования и двойной абсорбции (дк/да).
- •Окисление оксида азота
- •Абсорбция оксидов азота.
- •Энерготехнологическая система в производстве азотной кислоты.
Окисление оксида азота
Окисление оксида азота - гомогенная обратимая экзотермическая реакция:

При температурах ниже 400 К равновесие практически полностью сдвинуто в сторону образования NO2 Данная реакция может протекать везде: в трубопроводах, теплообменниках и в других аппаратах. Установлено, что кинетическая модель отвечает стехиометрии реакции:
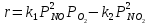
Как видно, давление значительно ускоряет реакцию, что также говорит в пользу его повышения в ХТС. Вследствие не очень высокой скорости реакции устанавливают окислитель - полый аппарат, обеспечивающий необходимое время пребывания реакционной смеси для завершения реакции.
Так как реакция окисления NO - экзотермическая, необходимо дополнительнос охлаждение нитрозного газа. При охлаждении конденсируется вода - ее образуется в 1,5 раза больше потребляемого аммиака. В результате взаимодействия конденсирующейся воды с нитрозным газом образуется азотная кислота. Целесообразно сократить время контакта газа с водой, для чего используют специальный скоростной теплообменник-конденсатор. Образующаяся в нем 30%-ная кислота направляется в соответствующее этой концентрации сечение абсорбционной колонны.
Абсорбция оксидов азота.
Физико-химические свойства процесса.
Диоксид азота взаимодействует с водой по схеме


Образующаяся по первой реакции азотистая кислота нестойка и сразу разлагается с выделением части NO в газовую фазу, Суммарно абсорбция представлена уравнением

Выбор оборудования. Для полноты
поглощения в абсорбционной колонне
необходим противоток жидкой и газовой
фаз . Определим тип насадки в ней.
Взаимодействие NO2 с
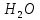 протекает быстро, так что между HNO3
в жидкости и NO2 в газе почти
устанавливается равновесие. Последующее
окисление NO (и в газовой, и в жидкой
фазах) протскаст медленнее. Необходимо
определенное время для его завершения
и пространство. В основном окисление
образовавшегося NO протекает в газовой
фазе по реакции (6.13). Так как реакция
(6.19) - гетерогенная газожидкостная, а
реакция (6.13) - гомогенная, реактор
образования азотной кислоты представляет
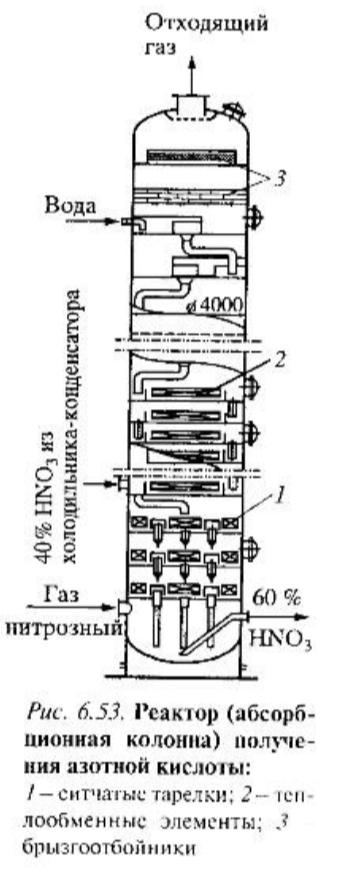
абсорбционную колонну с переливными
ситчатыми тарелками (рис. 6.53), пространство
между которыми работает как газофазный
окислитель основного количества
выделившегося NO. Баобатаж в невысоком
(на тарелке) слое жидкости обеспечивает
интенсивный массообмен с газом,
способствуя и поглощению компонентов
газовой смеси и тем самым образованию
HNO3 и жидкофазному окислению NO.
Можно считать, что в абсорбционной
колонне протекает превращение, описываемое
следующим брутто-уравнением, получен-
Вода ным сложением уравнений (6.13) и
(6.19):
протекает быстро, так что между HNO3
в жидкости и NO2 в газе почти
устанавливается равновесие. Последующее
окисление NO (и в газовой, и в жидкой
фазах) протскаст медленнее. Необходимо
определенное время для его завершения
и пространство. В основном окисление
образовавшегося NO протекает в газовой
фазе по реакции (6.13). Так как реакция
(6.19) - гетерогенная газожидкостная, а
реакция (6.13) - гомогенная, реактор
образования азотной кислоты представляет
абсорбционную колонну с переливными
ситчатыми тарелками (рис. 6.53), пространство
между которыми работает как газофазный
окислитель основного количества
выделившегося NO. Баобатаж в невысоком
(на тарелке) слое жидкости обеспечивает
интенсивный массообмен с газом,
способствуя и поглощению компонентов
газовой смеси и тем самым образованию
HNO3 и жидкофазному окислению NO.
Можно считать, что в абсорбционной
колонне протекает превращение, описываемое
следующим брутто-уравнением, получен-
Вода ным сложением уравнений (6.13) и
(6.19):
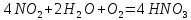
Из общего балансового уравнения превращения NH3 в HNO3
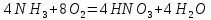
видно, что на 1 объем NH3 расходуется 2 объема кислорода. На стадии окисления аммиака с воздухом подается 1,8 объема О2
Остальной кислород (воздух) надо подавать в абсорбционную колонну для полноты окисления NO, что и реализовано в технологической схеме на рис.6. 51.
С понижением температуры поглащение NO2 улучшается. Для отвода теплоты реакции на тарелках установлены плоские змеевиковые холодильники с циркулируюшей в них водой.
Повышение давления способствует поглощению NO2 и увеличению концентрации образующейся кислоты: 47-49%-ная HNO, получается при Р= 1 атм, 58%-ная - при Р = 7 атм, 62%-ная P-=11 атм.
