
- •Оглавление
- •I. Теория химических процессов 3
- •Вопросы для подготовки к экзамену по курсу охт, 2019
- •Балансовое :
- •Базисная система линейно независимых уравнений реакций.
- •4. Выход продукта:
- •Термодинамические закономерности. Константа равновесия и равновесная степень превращения. Способы управления равновесием химических реакций (температура, давление, избыток реагента и т.Д.), примеры.
- •Пример расчёта Хр (хАравн, хАmax)
- •Способы смещения равновесия
- •Кинетическая модель
- •Реакционная схема и ее отличие от базисной системы независимых уравнений
- •Иерархическая структура математической модели в химическом реакторе
- •Классификация хим процессов
- •Влияние с и т на r
- •Хим процесс с простой необратимой реакцией
- •Хим процесс с обратимой реакцией:
- •Хим процесс сложной реакции
- •Гетерогенный процесс “газ-твердое”. Модель “сжимающееся ядро”. Схема и математическое описание процессов. Наблюдаемая скорость и время полного превращения. Лимитирующая стадия. Способы интенсификации.
- •Общая схема модели „сжимающееся” ядро
- •Материальный баланс по
- •Частные случаи
- •Внешняя диффузия- лимитирующая стадия
- •Внутридиффузный режим
- •Кинетический режим.
- •Процесс на пористом катализаторе (
- •Математическое описание процесса
- •Классификация
- •Влияние на сильнее, чем влияние т
- •Характерный признаки хтс
- •Элементы хтс. Классификация.
- •Подситемы хтс
- •Типы технологических связей (назначение)
- •Синтез и анализ хтс
- •Модели хтс
- •Описательные модели хтс
- •Химическая схема
- •Операционная схема
- •Математическая модель
- •Графические модели
- •Функциональная схема
- •Структурная схема
- •Технологическая схема
- •Операторная схема
- •Синтез хтс Концепции синтеза хтс (обязательные требования)
- •Окисление диокисда серы
- •Абсорбция триоксида серы
- •Система двойного контактирования и двойной абсорбции (дк/да).
- •Окисление оксида азота
- •Абсорбция оксидов азота.
- •Энерготехнологическая система в производстве азотной кислоты.
4. Выход продукта:
Выход продукта
совпадает с
 для простых реакций
для простых реакций
-
Селективность. Выход продукта характеризует полученный результат как долю от предельно возможного. Целесообразно оценить и реальную ситуацию, т.е. дать кол-ую оценку эффективности целевой реакции по сравнению с побочными взаимодействиями.
Критерием такой оценки явл. селективность.
Селективность-это отношение массы целевого продукта к общей массе в-в, полученных в данном процессе или к массе превращенного сырья за время t.

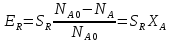
Выход продукта, степень превращения и селективность характеризуют глубину протекания хим. – технологического процесса, его полноту и направленность.
Термодинамические закономерности. Константа равновесия и равновесная степень превращения. Способы управления равновесием химических реакций (температура, давление, избыток реагента и т.Д.), примеры.
Задачи:
-
Вероятность протекания реакции
-

-
Способы сдвига равновесия в сторону продукта
 -
реакция вероятна
-
реакция вероятна
 -реакция
невозможна
-реакция
невозможна
 -равновесие
-равновесие
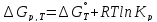
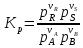
При равновесии:
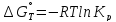 изотерма Вант-Гоффа
изотерма Вант-Гоффа


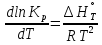 -изобара
Вант-Гоффа
-изобара
Вант-Гоффа
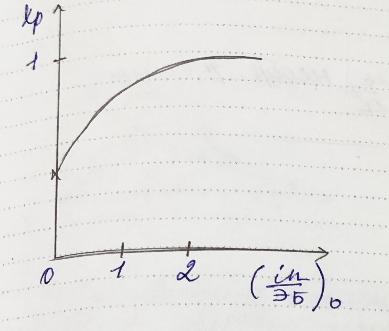
Пример расчёта Хр (хАравн, хАmax)
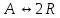
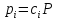
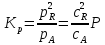
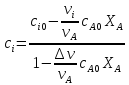




Способы смещения равновесия
-
Влияние температуры
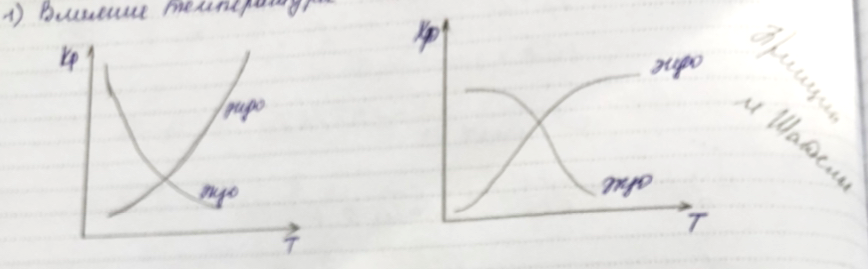

-
Влияние давления
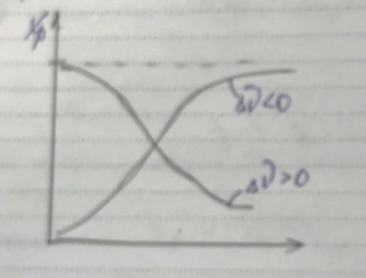
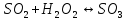


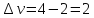
-
Влияние избытка в-ва (одного из реагентов)


Универсальный способ
-
Влияние инертного вещества на Хр

Влияние инерта аналогично снижению общего давления
-
Вывод продукта из зоны реакции
Кинетические закономерности. Понятия скорости реакции и скорости превращения вещества для простой и сложной реакции. Кинетическое уравнение, порядок реакции. Схема превращения и её отличие от базисной системы линейно независимых уравнений химических реакций.
Задачи:
-
Скорость реакции и скорость превращения компонента
-
Кинетическая модель реакции, порядок реакции, схема превращения
-
Пути интенсификации
Скорость реакции-отношение количества превращённого вещества к объему смеси, времени и стехиометрические коэффициенты.
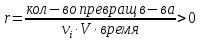
Всегда одинакова, не зависит от в-ва, по которому считают
 – для закрытых систем
– для закрытых систем

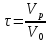
Скорость превращения вещества – количество вещества превращающегося в единицу времени в единице реакционного пространства.
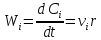
Для исходных, где

Для продуктов, где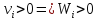
Кинетическая модель
 -кин
ур(модель) необр реакции n-ого
порядка
-кин
ур(модель) необр реакции n-ого
порядка

A
R





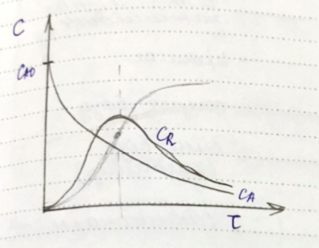
Кинетическая кривая c(t)










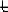


Сложные реакции:
vRR
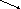 2
параллельные реакции: vAA
2
параллельные реакции: vAA
vSS
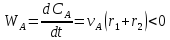
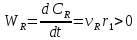




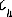










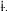

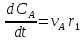

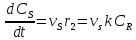
Реакционная схема и ее отличие от базисной системы независимых уравнений
Схема превращения показывает реальные взаимод между компонентами – пути превращ – в реагирующей системе. Схема превращения состоит из частных р-й, или этапов. В отличие от стехиом, кинетические ур-я не могут быть. записаны произвольно, и их число должно соотв реальным путям превращ компонентов. Схема превря необходима в предсказании и объяснении динамич измен содерж- в-в в реагирующей системе по мере протекания в ней хим превращ.
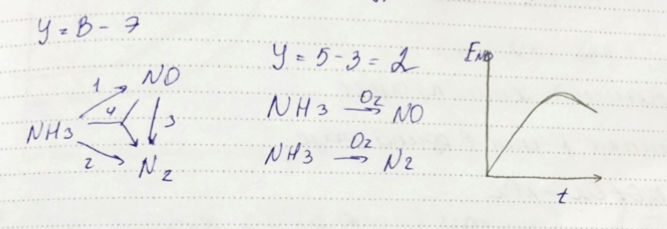
Химический процесс, определение, иерархическая структура построения математической модели в химическом реакторе, классификация процессов. Наблюдаемая скорость превращения, ее отличие от скорости химической реакции.
Химический процесс - это сложное явление, в котором химические реакции взаимодействует с масса – теплопереносом.
