
- •Оглавление
- •I. Теория химических процессов 3
- •Вопросы для подготовки к экзамену по курсу охт, 2019
- •Балансовое :
- •Базисная система линейно независимых уравнений реакций.
- •4. Выход продукта:
- •Термодинамические закономерности. Константа равновесия и равновесная степень превращения. Способы управления равновесием химических реакций (температура, давление, избыток реагента и т.Д.), примеры.
- •Пример расчёта Хр (хАравн, хАmax)
- •Способы смещения равновесия
- •Кинетическая модель
- •Реакционная схема и ее отличие от базисной системы независимых уравнений
- •Иерархическая структура математической модели в химическом реакторе
- •Классификация хим процессов
- •Влияние с и т на r
- •Хим процесс с простой необратимой реакцией
- •Хим процесс с обратимой реакцией:
- •Хим процесс сложной реакции
- •Гетерогенный процесс “газ-твердое”. Модель “сжимающееся ядро”. Схема и математическое описание процессов. Наблюдаемая скорость и время полного превращения. Лимитирующая стадия. Способы интенсификации.
- •Общая схема модели „сжимающееся” ядро
- •Материальный баланс по
- •Частные случаи
- •Внешняя диффузия- лимитирующая стадия
- •Внутридиффузный режим
- •Кинетический режим.
- •Процесс на пористом катализаторе (
- •Математическое описание процесса
- •Классификация
- •Влияние на сильнее, чем влияние т
- •Характерный признаки хтс
- •Элементы хтс. Классификация.
- •Подситемы хтс
- •Типы технологических связей (назначение)
- •Синтез и анализ хтс
- •Модели хтс
- •Описательные модели хтс
- •Химическая схема
- •Операционная схема
- •Математическая модель
- •Графические модели
- •Функциональная схема
- •Структурная схема
- •Технологическая схема
- •Операторная схема
- •Синтез хтс Концепции синтеза хтс (обязательные требования)
- •Окисление диокисда серы
- •Абсорбция триоксида серы
- •Система двойного контактирования и двойной абсорбции (дк/да).
- •Окисление оксида азота
- •Абсорбция оксидов азота.
- •Энерготехнологическая система в производстве азотной кислоты.
Система двойного контактирования и двойной абсорбции (дк/да).
Несмотря на довольно большую степень превращения - 98%, мощные сернокислотные системы, производящие до 540 т продукта в сутки, ежечасно выбрасывают в атмосферу более 300 кг диоксида серы. Под действием солнечной энергии и частиц пыли, выступающих в роли катализатора, в атмосфере SO2, может окисляться до SO3, что может привести к образованию кислых дождей и даже - к экологической катастрофе.
Увеличить степень превращения SO, образующегося в ходе протекания экзотермической реакции, сопровождающейся уменьшением объема, можно снижением температуры в последних слоях реактора ниже 610 К или увеличением давления выше 1,2 МПа. Но возможность снижения температуры ограничена активностью катализатора, а увеличение давления усложняет инженерное оформление процесса.
Другим эффективным способом увеличения степени превращения обратимой реакции является удаление ее продукта. Функциональная схема такого способа показана на рис. 6.34. Подсистема получения сернистого газа (обжиг серосодержащего сырья) принципиально не меняется. Полученный сернистый газ частично окисляется в первом реакторе, после чего в первой (промежуточной) ступени абсорбции из него удаляется SO3. Далее оставшийся SO2, окисляется во втором реакторе, и газ направляется на вторую абсорбцию. В отсутствие SO3, окисление SO2, во втором реакторе будет более полным. Каждый реактор состоит из адиабатических слоев катализатора с промежуточными теплообменниками подобно реактору в схеме одинарного окисления (см, рис. 6.31).
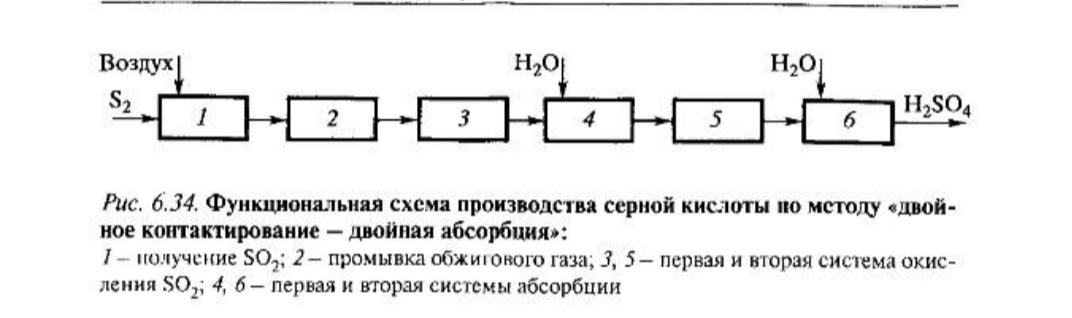
Организация данной схемы требует двойной нагрев реакционной смеси: в первом реакторе от 320 К до достижения значения темпера туры 690 К, необходимой перед первым слоем, и после его охлаждения до 320-340 К для промежуточной абсорбции SO3, - перед вторым реактором. Нагрев осуществляется за счет теплоты реакции. Но во второй ступени окисляется низкоконцентрированный газ, теплоты реакции выделятся мало - необходимы теплообменники с большой поверхностью теплообмена. Увеличить общее количество выделяемой теплоты можно за счет увеличения начальной концентрации SO2. По этой причине в системах ДК/ДА используют газ, содержащий не менее 10% SO2, Во избежание перегрева катализатора в первом слое зна- чения температуры на входе не должны превышать 695 К, для чего ис- пользуют низкотемпературные катализаторы.
Технологическая схема стадий окисления и абсорбции в системе ДК ДК/ДА представлена на рис. 6.35.
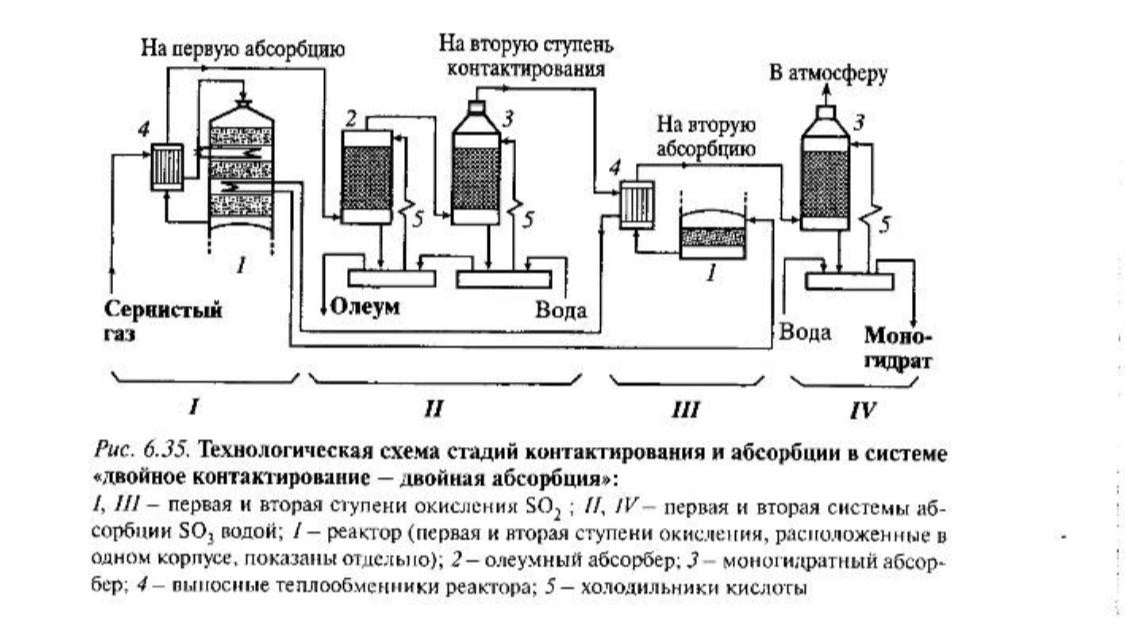
На первой стадии окисления использован трехслойный реактор 1. Концентрация SO2, в поступающем газе составляет 9,5-10,5%, степень превращения на выходе из реактора 90-95%. Промежуточная абсорбция SO3, включает олеумный 2 и моногидратный 3 абсорберы, после которых в газе содержится только 0,6-1% триоксида серы. Поскольку во второй стадии теплоты выделяется мало (низкая концентрация SO2), для нагрева газа до температуры реакции (690-695 К) используют теплообменник, расположенный после второго слоя первого реактора. Реакторы первой и второй ступени окисления конструктивно объединены в одном корпусе (на рис. 6.34 они показаны отдельно). Степень превращения оставшегося SO2 составляет примерно 95%, общая степень превращения доходит до 99,6-99,8%.
Как видно, количество непревращенноro SO2 (и, следовательно, выбросов в атмосферу) в системе ДК/ДА уменьшается почти в 10 раз по сравнению с системой однократного контактирования, что требует дополнительных экономических затрат, так как поверхность теплообменников увеличивается в 1,5-1,7 раза.
ХТС производства азотной кислоты. Химическая и функциональная схемы. Физико-химические основы и аппаратурное оформление окисления аммиака и абсорбции оксидов азота. Энерготехнология в производстве азотной кислоты.
Функциональная схема производства азотной кислоты.
Сырьем процесса служат синтетический аммиак, кислород воздуха и вода. Протекают следующие реакции:
окисление аммиака кислородом воздуха
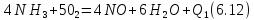
окисление оксида азота до диоксида азота
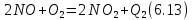
поглощение NO, водой с образованием азотной кислоты
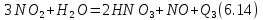
Одновременно с третьей реакцией проводят вторую, с тем, чтобы весь NO2, превращался в HNO3, Все реакции экзотермические.
Исходя из химической схемы превращения (6.12)-(6.14), функциональная схема производства будет включать подсистемы окисления аммиака, последующее охлаждение газов [реакция (6.12) протекает при высокой температуре], окисление оксида азота и абсорбцию образующихся нитрозных газов водой (рис. 6.47).

Окисление аммиака.
Физико-химические свойства процесса. Окисление аммиака - сложная необратимая экзотермическая каталитическая реакция. Аммиак окисляется до N2 и NO. Превращение описывается двумя независимыми стехиометрическими уравнениями:
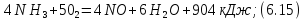
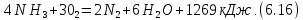
В качестве катализатора используется платина или платинапалладийродиевый сплав, содержание платины в котором находится в пределах 81-92%. Температура процесса 1100-1200 К. В этих условиях практически не образуется закись азота N2О. Из-за обратимости экзотермической реакции (6.13) ее равновесия при температуре окисления аммиака сдвинуто влево, и диоксид азота также отсутствует.
Схема преврашения отличается от системы стехиометрических уравнений (6.15)-(6.16): реакция окисления аммиака включает четыре частные реакции (этапа):

Данная схема была установлена
экспериментально: подавая только NO на
катализатор, наблюдали образование
азота и кислорода по реакции
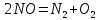 ;
подавая смесь NH3 и NO, наблюдали
образование N2, по реакции
;
подавая смесь NH3 и NO, наблюдали
образование N2, по реакции
 .
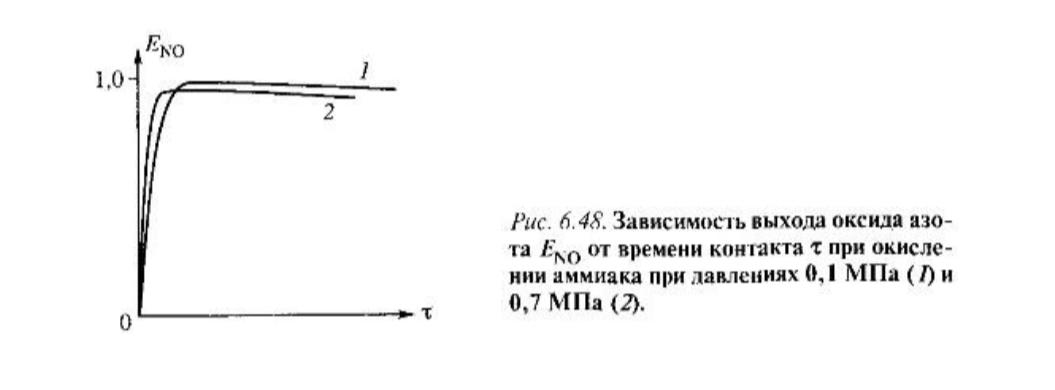
Такая схема превраще- ния дает экстремальную
зависимость выхода оксида азота от
времени превращения - рис. 6. 48.
.
Такая схема превраще- ния дает экстремальную
зависимость выхода оксида азота от
времени превращения - рис. 6. 48.
Условия процесса. Реакция происходит
быстро и протекает во внешнедиффузионной
области. Скорость процесса лимитирует
перенос теплоты и вещества между потоком
и поверхностью катализатора, а так как
последний представляет собой сетку,
сплетенную из металлической проволоки
диаметром 0,09 мм и нет необходимости
развивать его внутреннюю поверхность,
время контакта составляет
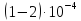 с. За это время аммиак полностью
окисляется, так что выход NO совпа- дает
с селективностью реакции по оксиду
азота.
с. За это время аммиак полностью
окисляется, так что выход NO совпа- дает
с селективностью реакции по оксиду
азота.
При учете внешнедиффузионного переноса
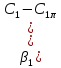
где нижние индексы 1 и 2 относятся
соответственно к NH3 и О2;
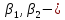 коэффициенты
массопереноса между потоком и поверхностью;
коэффициенты
массопереноса между потоком и поверхностью;
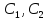 -
концентрации в потоке;
-
концентрации в потоке;
 концентрации
на поверхности; v1 = 4 v2 = 5 -
стехиометрические коэффициенты;
концентрации
на поверхности; v1 = 4 v2 = 5 -
стехиометрические коэффициенты;
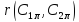 - скорость реакции.
- скорость реакции.
Полагая
 ,
и стехиометрическое соотношение
,
и стехиометрическое соотношение
 из уравнения (6.18) получим следующее
соотношение:
из уравнения (6.18) получим следующее
соотношение:
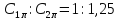 .
.
Во внешнедиффузионной области
концентрации исходных веществ на
поверхности много меньше, нем в объеме,
следовательно, у поверхности катализатора
будет мало как аммиака, так и кислорода.
В этих условиях окисление будет протекать
в основном до азота. Если обеспечить
значительный избыток кислорода у
поверхности, вытесняющий с нее аммиак,
его окисление будет более глубоким - до
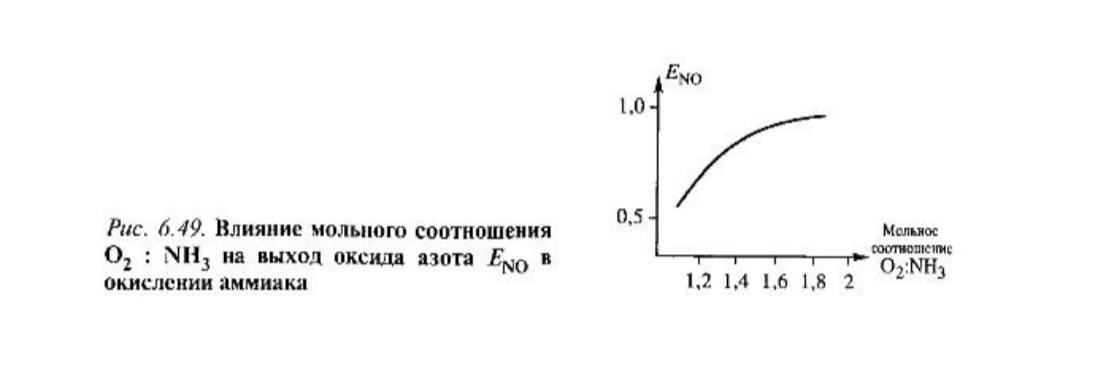
NO. Влияние соотношения О2 : NH3
в потоке на выход NO показан на рис. 6.49.
При соотношении О2 : NH3 более
1 : 1,8 селективность процесса практически
не меняется. Из уравнения (6.18) можно
оценить, что при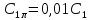 у поверхности будет более чем 50-кратный
избыток О2, что и обеспечит высокую
селективность реакции. Соотношение О2
: NH3 = 1 : 1,8 отвечает содержанию в
азотоводородной смеси 10% NH3, которое
используется в промышленности .
у поверхности будет более чем 50-кратный
избыток О2, что и обеспечит высокую
селективность реакции. Соотношение О2
: NH3 = 1 : 1,8 отвечает содержанию в
азотоводородной смеси 10% NH3, которое
используется в промышленности .
Давление усиливает разложение NO до N2 по этапу 3 в схеме (6.17) и тем самым уменьшает максимальный выход NO с 97-98% при 0,1 МПа до 95-96% при 0,7 МПа, хотя скорость превращения увеличивается . Соответственно, для проведения процесса при 0,1 МПа необходимо 8-12 катализаторных сеток, тогда как при 0,7 МПа потребуется 5-6 сеток. Влияние температуры на максимальный выход NO имеет экстремальный характер (рис. 6.50), и с повыше- нисм давления температура максимального выхода NO увеличивается.

Хотя давление и уменьшает выход NO, в промышленности процесс проводят под повышенным давлением. Широкое распространение получил разработанный в России процесс под давлением 0,73 МПа (рис. 6.51, a), величина которого обоснована оптимальностью ХТС в целом. Увеличение давления значительно улучшают абсорбцию [реакция (6.14)]: вместо 6-8 абсорбционных колонн, используемых при атмосферном давлении, при Р = 0,7 МПа достаточно одной колонны.
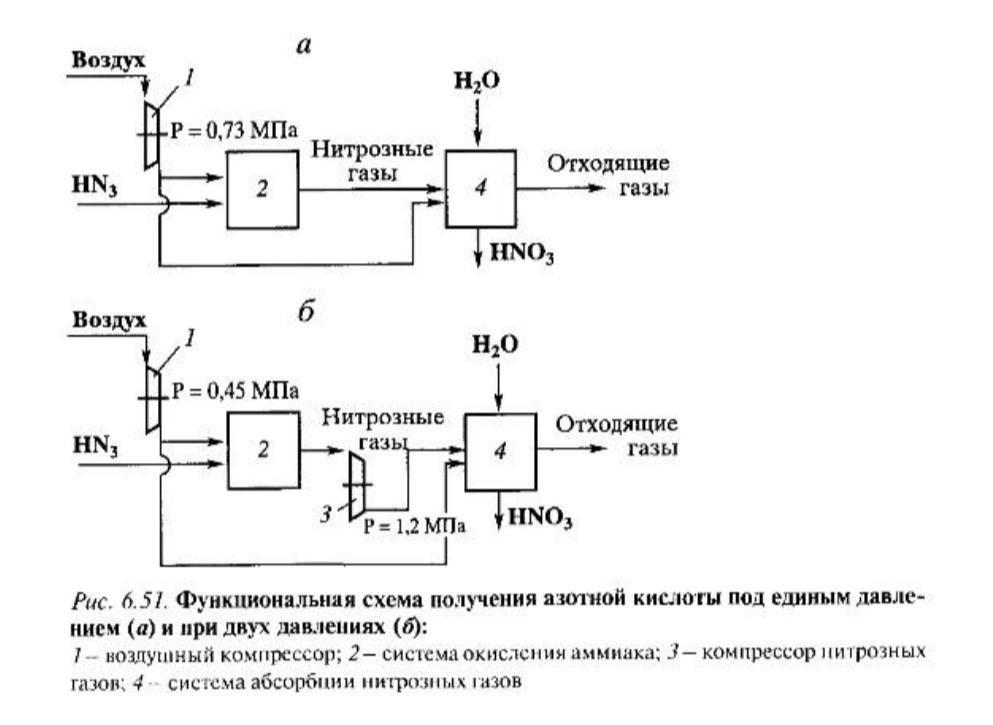
Уменьшаются габариты и остального оборудования. Еще одним неоспоримым достоинством является создание при повышенном давлении энерготехнологической системы, замкнутой по энергетике. Последняя разработка - схема при двух давлениях (система АК-72), изображенная на рис. 6.51, б, в которой окисление проводят при 0,4-0,45 МПа, нитрозный газ перст абсорбцией сжимают до 1-1,2 МПа. Очевидно, что при этом создаются лучшие условия для двух основных процессов окисления и абсорбции, чем при едином давлении, хотя это требует использования специального компрессора, работающего с нитрозным (сильно корродирующим) газом (при едином давлении используют только воздушный компрессор).
Реакторы окисления аммиака для двух описанных выше схем представлены на рис. 6.52.
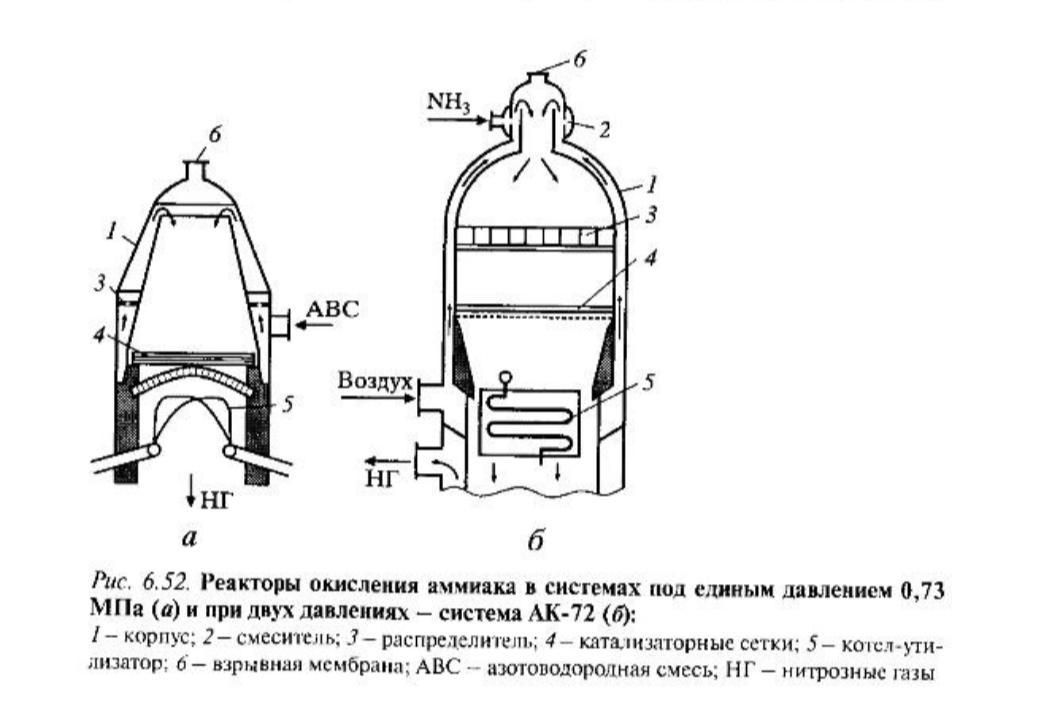
Катализатор в виде сеток 4 натянут внутри корпуса 1. Во избежание провисания сеток под ними на опорной решетке вертикально установлены кольша. Аммиак смешивают с воздухом или в выносном смесителе, или в верхней части реактора через кольцевую щель, обеспечивающую равномерную подачу NH3. Высокая конусная часть реактора служит для равномерного распределения потока по сечению, так как слой сеток очень тонкий и не может сам выравнивать поток. Также может быть установлен специальный распределитель потока. Поскольку идеально равномерное распределение потока не реализуется, то используют увеличенное число сеток (10-12) при давлении 0,7 МПа.
При высокой температуре платина частично испаряется в виде оксида PtO2 ; потери составляют 0,16 г Pt/т HNO3 (при 1200 К). Используя поглотитель платины на основе СаО, положенный под сетки, можно снизить безвозвратные потери до 0,07 rPt/т HNO3.
Теплоту газов после окисления аммиака используют для выработки пара в котле-утилизаторе. Конструктивно он совмещен с реактором.
