
2.1 Моносахариды
Строение и номенклатура
В основу номенклатуры cахаров положены тривиальные названия моносахаридов состава СnН2nОn с прямой цепью углеродных атомов: ксилоза, рибоза, глюкоза, фруктоза и др. Наименованиям кетоз придается окончание -улоза, например кетоза С5-пентулоза. Всем моносахарам присуща конфигурационная (оптическая) изомерия, т. е. они существуют в двух энантиомерных формах: D и L. Принадлежность моносахаридов к D- или L-ряду определяется по расположению ОН-группы у последнего (считая от альдегидной 1-ми кетогруппы) хирального атома углерода. В качестве стандарта сравнения конфигурации асимметрического атома углерода предложено использовать изомер глицеринового альдегида. Названный D-глицериновым альдегидом изомер вращает плоскость поляризованного света вправо, а его зеркальное отражение антипод —L-глицериновый альдегид — влево:

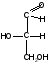
D-глицериновый альдегид L-глицериновый альдегид
Все моносахариды, которые теоретически могут быть получены из D-глицеринового альдегида путем последовательного удлинения его цепи со стороны альдегидной группы, называют D -сахарами, независимо от конфигураций остальных атомов углерода, а полученные таким же способом из L-глицеринового альдегида-L-сахарами:
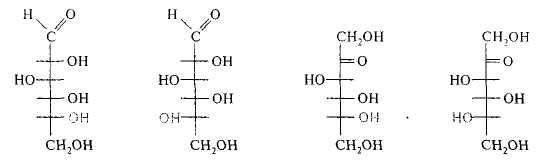
D(+)-глюкоза L(-)-глюкоза D(-)-фруктоза L(+)-фруктоза
Некоторые моносахариды, например фруктоза, отнесенные к D-ряду, являются левовращающими, а представители L-ряда — правовращающими. Чтобы указать и принадлежность сахара к D- или L-ряду, и направление вращения плоскости поляризации, после символов D или L перед названием моносахарида в скобках ставят знак (+) или (—), обозначающий соответственно правое или левое вращение.
В живых организмах моносахариды присутствуют преимущественно в D-конфигурации, которую называют природной. Исключение составляет L-арабиноза бактерий, L-рамноза и L-сорбоза растений.
D-альдозы содержащие от С-3 до С-6 углеродных атомов:
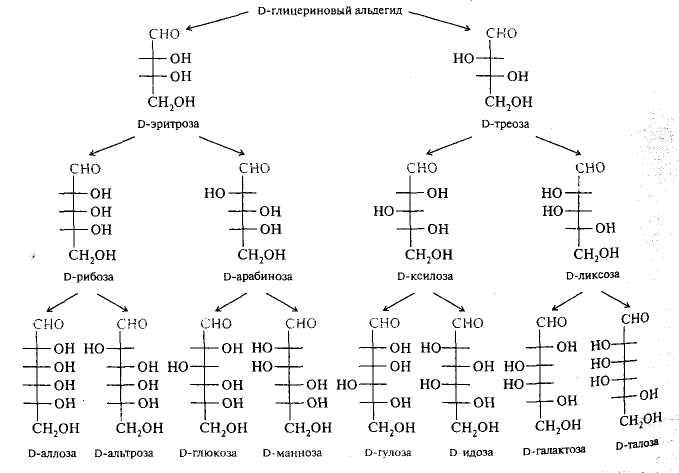
У альдоз, начиная с п = 4, и кетоз — с п = 5 имеется несколько хиральных центров, т. е. существует ряд диастереомеров, представляющих собой разные по химическим свойствам соединения, причем каждый из диастереомеров может существовать в L - и D - конфигурации. Так, число стереомеров альдогексоз с четырьмя хиральными центрами равно 24, т. е. шестнадцати. Последние можно сгруппировать в восемь пар энантиомеров в D- и L- изомерах, имеющих одинаковые химические и физические свойства и отличающихся только направлением вращения плоскости поляризованного света.
Карбонильные группы моносахаридов с длиной цепи п = 5 и более могут вступать во взаимодействие со спиртовыми группами с образованием циклической полуацетали, или полукетали, которые называются соответственно фуранозными или пиранозными по аналогии с известными соединениями фураном или пираном:
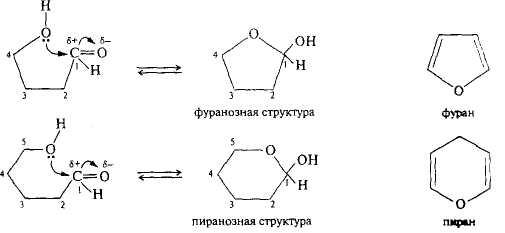
При этом в молекуле пентоз или гексоз появляется еще один хиральный центр и новая пара изомеров —α- и β-аномеры, отличающиеся расположением гид-роксильной группы при полуацетальном атоме углерода относительно плоскости кольца: у α-аномера гидроксильная и СН2ОН-группы находятся по разные плоскости кольца, а у β-аномера — по одну его сторону. Таким образом, гексоза образует четыре циклические формы (α- и β-фуранозную и α - и β -пиранозную), находящиеся в растворе в динамическом равновесии с ациклической формой. В водном растворе все эти формы способны взаимно превращаться друг в друга.
Пиранозные формы гексоз и пентоз значительно более устойчивы, чем фу- ранозные, поэтому в растворе всегда существенно преобладают первые, α – и β-Формы моносахаридов, обладающие разной величиной оптического вращения, в процессе растворения в воде взаимно переходят друг в друга, поэтому удельное вращение [α]D в свежеприготовленных растворах моносахаридов изменяется в течение времени до определенной величины. Это явление получило название муторотации (от лат.multirotatia- много вращений). Так, при растворении в воде α-D-глюкозы ([α]D20 = +112,2°) и β-D-глюкозы ( [α]D20 = +18,7°) удельное вращение меняется до установления равновесия (36% α-формы, 64% β-формы и следы нециклической формы), в момент которого оно достигает +52,7°.
В настоящее время для написания структурных формул моносахаридов чаще всего используются проекционные формулы, предложенные У. Хеуорсом. Следует помнить, что при написании структурных формул, по Хеуорсу, гидроксильная группа при С1 будет расположена ниже плоскости кольца в α -форме и выше в β-форме:
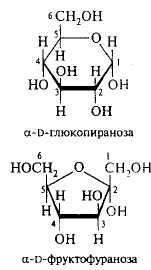

Однако эти формулы не отражают пространственного расположения атомов в молекуле сахаров. В природе пиранозное кольцо не является плоским и может возникнуть большое число конформаций: шесть в форме «лодки» и две в форме «кресла». Форма «кресла» является более устойчивой, и, по-видимому, она преобладает в большей части природных углеводов.
Ниже представлены две изомерные формы пиранозного кольца, изображенные с помощью конформационных формул («лодка» и «кресло»), а также формула α-D-глюкопиранозы, имеющая конформацию кресла:

«кресло» «лодка» формула α-D-глюкопиранозы
Физико-химические свойства моносахаридов
Сахара — полифункциональные соединения. В растворах сахаров можно обнаружить карбонильную группу, спиртовой и полуацетальный гидроксилы. Каждая из этих групп характеризуется определенными химическими реакциями, но все они вступают в реакции окисления—восстановления.
Окисление сахаров. При окислении альдоз образуется три класса кислот: альдоновые, альдаровые и альдуроновые. Альдоновые кислоты образуются при действии слабых окислителей или ферментативно при окислении альдегидной группы в положении С-1 в карбоксильную группу.
Кислоты,образующиеся при окислении D-глюкозы, представлены на следующей схеме:
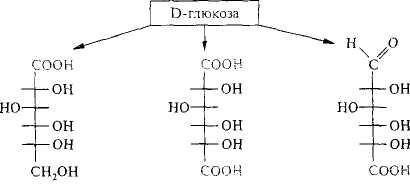
D-глюконовая D- глюкаровая D-глюкуроновая
Так, при окислении С-1 глюкозы образуется глюконовая кислота, фосфо-рилированная форма которой является промежуточным метаболитом превращения глюкозы по механизму пентозофосфатного пути. При действии более сильных реагентов окисляется как альдегидная, так и первичная спиртовая группа у последнего углеродного атома и образуются дикарбоновые, или альдаровые, кислоты. Продуктами окисления D-глюкозы являются D-глюкаровая, или сахарная, кислота, а D-галактозы — D-галактаровая, или слизевая; большого биологического значения кислоты этого класса не имеют.
Альдуроновые кислоты образуются при окислении только первичной спиртовой группы у С-6, а альдегидная группа остается неокисленной. В этом случае из D-глюкозы образуется D-глюкуроновая кислота, а из D-галактозы — D-галактуроновая. Уроновые кислоты имеют большое биологическое значение. Так, многие из них входят в состав полисахаридов, а D-глюкуроновая кислота принимает участие в организме в обезвреживании билирубина и ряда ксенобиотиков, в том числе лекарственных веществ.
Восстановление моносахаридов. Подобно всем карбонильным соединениям, моносахариды легко восстанавливаются с образованием полиспиртов. Например, из D-глюкозы образуется спирт D-сорбит, из D-маннозы — D-маннит, из D-ксилозы — ксилит, из D-рибозы — D-рибит:
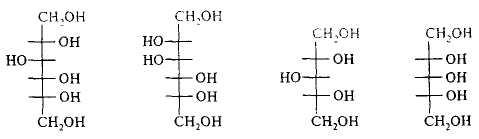
D- сорбит D- манит D- ксилит D- рибит
Восстановление моносахаридов может осуществляться не только при действии восстановителей (газообразный водород, амальгама натрия и др.), но также в организме ферментативным путем. Образующиеся спирты имеют важное биологическое значение. Так, спирт рибитол входит в состав витамина B(рибофлавин) и ряда коферментов.
Возможно также восстановление одной из гидроксигрупп моносахаридов. Такие сахара называют дезоксисахарами. Примером их является D-2-дезоксирибоза, которая содержится в свободных дезоксирибонуклеотидах и молекуле ДНК.
Производные моносахаридов. Исключительно важной реакцией моносахаридов является образование гликозидов при взаимодействии активного полуацетального или полукетального гидроксила с гидроксильной группой другого соединения. Так, D-глюкоза дает с метанолом α- и β-метил-D-глюкопиранозиды.
Гликозиды метилированных сахаров, благодаря летучести в высоком вакууме, используются для газожидкостной хроматографии и масс-спектрометрии. Неуглеводная часть молекулы, т. е. группа, замещающая протон гидроксильной группы, называется агликоном.
Соединения, имеющие одну или несколько гликозидных связей, имеют большое значение в биохимии. Это основная связь, с помощью которой образуются олиго- и полисахариды. Таким образом, гликозидная связь в химии углеводов имеет такое же значение, какое в белковой химии имеет пептидная связь, а в химии нуклеиновых кислот — фосфодиэфирная. В природе встречается большое разнообразие гликозидов. Многие из них применяют в пищевой промышленности и медицине:

сапонин
Важным классом гликозидов являются N-гликозиды, в которых связь с аг-ликоном осуществляется через азот, а не кислород. Посредством такой связи D-рибоза и 2-дезокси-D-рибоза соединяются с азотистыми основаниями в молекулах РНК, ДНК АТФ, НАД и др.
О-Ацильные производные моносахаридов. При замещении атомов водорода гидроксильных групп углеводов остатками кислот получаются вещества типа сложных эфиров. Особое значение в процессах метаболизма в организме имеют моно- и дифосфорнокислые эфиры моносахаридов как промежуточные метаболиты катаболизма, биосинтеза и взаимопревращения углеводов. При образовании фосфорных эфиров (донор фосфорильной группы АТФ) резко возрастает реакционная способность моносахаридов, их биохимическая активность.
Аминосахара. В этих соединениях гидроксильная группа у одного из углеродных атомов пиранозного кольца замещена аминогруппой. Широко распространены в растениях и животных α-D-глюкозамин и α-D-галактозамин, которые обычно встречаются в виде N-ацетильных производных:

N-ацетил-α-D-глюкозамин N-ацетил-α-D-галактозамин
Аминосахара и их производные входят в состав ряда структурных полиса-харидов. Так, N-ацетилмурановая кислота входит в состав клеточных стенок бактерий, а N-ацетилнейраминовая кислота — в состав плазматических мембран животных клеток. Все O- и N-ацильные производные нейраминовой кислоты имеют общее название — сиаловые кислоты.
N-ацетилнейраминовая кислота N-ацетилмурановая кислота или сиаловая кислота
