
- •Глава III. Металлорганические соединения
- •III.1. Получение.
- •III.2. Строение литий- и магнийорганических соединений.
- •III.3. Химические свойства литий- и магнийорганических соединений.
- •ГлаваIv. Гидроксипроизводные углеводородов
- •IV.1.Спирты [соединения со связью с(sр3)-он].
- •IV.1.1.Получение спиртов
- •Свойства спиртов
- •IV.1.2. Физические свойства
- •IV.1.3. Химические свойства
- •IV.1.3.1. Кислотно-основные свойства спиртов.
- •IV.1.3.2. Спирты как субстраты в реакциях нуклеофильного замещения и элиминирования
- •1. Образование простых эфиров (алкилирование).
- •2. Образование сложных эфиров.
- •IV.1.3.4. Реакции окисления спиртов
- •Соединения со связью с(sр2)-он
- •IV.3. Фенолы (соединения с гидроксильной группой в ароматическом ядре)
- •IV.3.1. Способы получения фенолов.
- •IV.3.2. Химические свойства фенолов.
- •IV.3.2.1. Реакции группы он фенолов.
- •IV.3.2.2. Реакции электрофильного замещения в ароматическом ядре фенолов.
- •1V.4. Природные гидроксипроизводные.
- •Глава V. Простые эфиры
- •V.1. Простые эфиры (кроме оксиранов)
- •V.2. Оксираны (эпоксиды)
IV.1.3.4. Реакции окисления спиртов
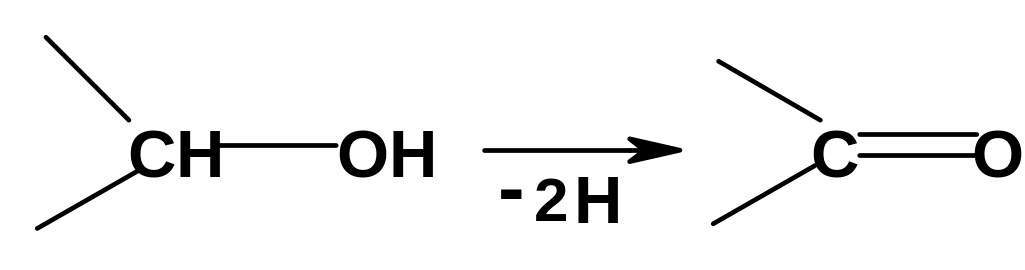 Первичные и
вторичные спирты могут окисляться;
окисление заключается в потере двух
атомов водорода с образованием
карбонильной группы:
Первичные и
вторичные спирты могут окисляться;
окисление заключается в потере двух
атомов водорода с образованием
карбонильной группы:
П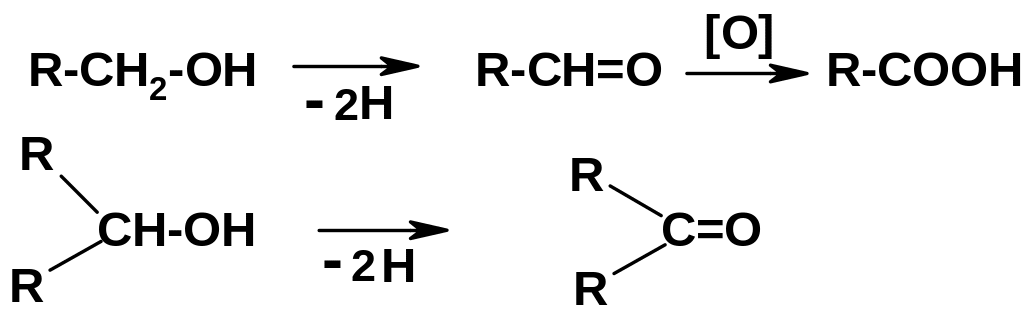 ри
этом из первичных спиртов образуются
альдегиды,
которые далее могут окисляться до
карбоновых кислот; из вторичных спиртов
образуются кетоны:
ри
этом из первичных спиртов образуются
альдегиды,
которые далее могут окисляться до
карбоновых кислот; из вторичных спиртов
образуются кетоны:
Окисление можно проводить: А. С использованием окислителей; Б. Путем дегидрирования.
А. В качестве окислителей используют достаточно сильные реагенты - бихроматы, перманганат калия в щелочной среде, диоксид марганца, азотную кислоту. При окислении первичных спиртов реакция часто идет до образования карбоновых кислот; чтобы остановить окислении на стадии альдегида, используют отгонку альдегида из реакционной смеси (альдегиды кипят ниже спиртов) или применяют специальные окислители, например, комплекс триоксида хрома с пиридином.
Б. Дегидрирование спиртов проводят, пропуская пары спирта над раскаленной медной проволокой или над медно-серебряной проволокой при 500 оС; образуется альдегид или кетон и выделяется водород.
Своеобразно протекает окисление виц-диолов иодной кислотой HJO4 или тетраацетатом свинца (CH3COO)4Pb: происходит расщепление С-С –связи с образованием двух молекул карбонильных соединений (альдегидов или кетонов):
Р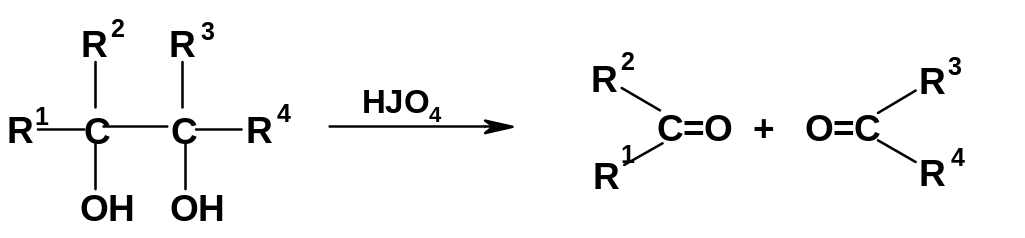 езультат
аналогичен деструктивному окислению
алкенов. Реакция используется при
изучении полигидрокисоединений, в
частности, в химии углеводов.
езультат
аналогичен деструктивному окислению
алкенов. Реакция используется при
изучении полигидрокисоединений, в
частности, в химии углеводов.
Соединения со связью с(sр2)-он
IV.2. Соединения с гидроксильной группой при связи С=С (енолы)
Соединения, содержащие гидроксигруппу при связи С=С, т.е. фрагмент С=С-ОН, называются енолами – это просто комбинация окончаний, применяемых в номенклатуре для обозначения связи С=С и группы ОН.
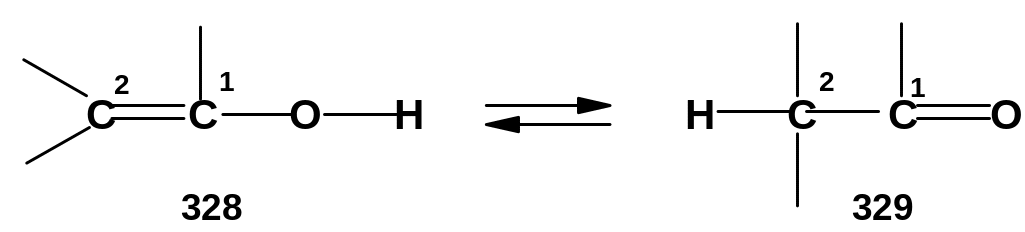 Наиболее
характерное свойство енолов –
существование равновесия между ними и
карбонильными соединениями (альдегидами
и кетонами):
Наиболее
характерное свойство енолов –
существование равновесия между ними и
карбонильными соединениями (альдегидами
и кетонами):
Структура (328) называется енольной формой, структура (329) – кето-формой.
Эти структуры являются изомерными. Явление обратимого взаимного перехода изомеров с миграцией каких-либо групп называется динамической изомерией или таутомерией. Известно достаточно много разновидностей таутомерии; приведенный пример иллюстрирует один из важнейших ее типов – кето-енольную таутомерию.
Переход от енольной формы к кето-форме происходит путем перемещения (миграции) протона от атома кислорода к атому углерода С2; -связь при этом перемещается из положения С=С в положение С=О. При переходе от кето-формы к енольной, естественно, происходят обратные перемещения.
Данное превращение является перегруппировкой; мигрирующей группой является протон; такие перегруппировки называются прототропными, а само явление миграции протона называется прототропией.
Равновесие между енольной и кето- формами устанавливается не мгновенно; его достижение требует определенного времени: при нормальных условиях – порядка часа. При значительном понижении температуры скорость перехода можно сильно уменьшить, т.е. «заморозить» одну из форм (обычно это используют для фиксации енольных форм).
В большинстве случаев кето-енольное равновесие весьма заметно сдвинуто в сторону образования кето-формы, потому что последняя термодинамически более устойчива. В случае «простых» систем, где заместители при атомах углерода – алкильные группы, равновесие настолько сильно сдвинуто в сторону кето-формы, что енольная форма присутствует в количествах 10-2 – 10-6 %; это отражено в известном положении о неустойчивости систем с группой ОН при двойной связи (правило Эльтекова – Эрленмейера).
Однако известны случаи, когда равновесие сдвинуто в сторону кето-формы не столь сильно, и в смеси содержится заметное количество енольной формы; это наблюдается в тех случаях, когда в енольной форме появляются стабилизирующие факторы, например, сопряжение. В отдельных случаях равновесие практически нацело сдвинуто в сторону образования енольной формы. Эти случаи будут рассмотрены в дальнейшем, в разделах «Фенолы», «Карбонильные соединения» и «Карбоновые кислоты».
Простые и сложные эфиры енолов достаточно устойчивы.
Получение енолов. Здесь приведены реакции, в которых первоначально образуется именно енольная форма, вслед за чем устанавливается кето-енольное равновесие:
1. Гидратация алкинов. Реакция рассмотрена в разделе «Алкины»; продуктами присоединения одной молекулы воды к связи СС являются енолы, которые далее перегруппировываются в альдегиды и кетоны.
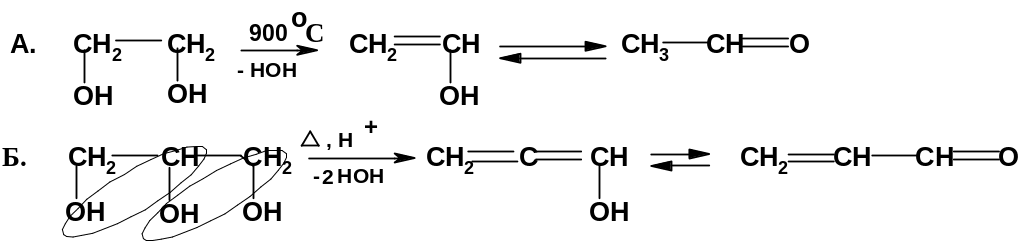 2. Дегидратация
структур с 1,2-диольным фрагментом:
2. Дегидратация
структур с 1,2-диольным фрагментом:
При нагревании этиленгликоля до очень высокой температуры образуется простейший енол, переходящий в уксусный альдегид; при нагревании глицерина до высокой температуры в присутствии слабокислых катализаторов промежуточно образуется алленовый спирт, который далее перегруппировывается в ненасыщенный альдегид – акролеин.
Енолы обладают более сильными кислотными свойствами, чем спирты; это объясняется тем, что сопряженные основания енолов – енолят-анионы (330) стабилизированы сопряжением (делокализацией заряда):
Е нолят-анионы
– амбидентные анионы; их жесткий центр
(О-центр) отвечает резонансной структуре
(330’), мягкий центр (С-центр)- форме
(330’’). Енолят-анионы широко используются
в органическом синтезе; их обычно
получают действием оснований на
карбонильные соединения, т.е. на кето-формы
(будет рассмотрено ниже в главе
«Карбонильные соединения»).
нолят-анионы
– амбидентные анионы; их жесткий центр
(О-центр) отвечает резонансной структуре
(330’), мягкий центр (С-центр)- форме
(330’’). Енолят-анионы широко используются
в органическом синтезе; их обычно
получают действием оснований на
карбонильные соединения, т.е. на кето-формы
(будет рассмотрено ниже в главе
«Карбонильные соединения»).
