
- •Глава III. Металлорганические соединения
- •III.1. Получение.
- •III.2. Строение литий- и магнийорганических соединений.
- •III.3. Химические свойства литий- и магнийорганических соединений.
- •ГлаваIv. Гидроксипроизводные углеводородов
- •IV.1.Спирты [соединения со связью с(sр3)-он].
- •IV.1.1.Получение спиртов
- •Свойства спиртов
- •IV.1.2. Физические свойства
- •IV.1.3. Химические свойства
- •IV.1.3.1. Кислотно-основные свойства спиртов.
- •IV.1.3.2. Спирты как субстраты в реакциях нуклеофильного замещения и элиминирования
- •1. Образование простых эфиров (алкилирование).
- •2. Образование сложных эфиров.
- •IV.1.3.4. Реакции окисления спиртов
- •Соединения со связью с(sр2)-он
- •IV.3. Фенолы (соединения с гидроксильной группой в ароматическом ядре)
- •IV.3.1. Способы получения фенолов.
- •IV.3.2. Химические свойства фенолов.
- •IV.3.2.1. Реакции группы он фенолов.
- •IV.3.2.2. Реакции электрофильного замещения в ароматическом ядре фенолов.
- •1V.4. Природные гидроксипроизводные.
- •Глава V. Простые эфиры
- •V.1. Простые эфиры (кроме оксиранов)
- •V.2. Оксираны (эпоксиды)
ГлаваIv. Гидроксипроизводные углеводородов
Гидроксипроизводные углеводородов – соединения, содержащие гидроксигруппу (ОН), связанную с атомом углерода. В молекуле гидроксипроизводного может находиться одна группа ОН (одноатомные производные), две (двухатомные) и т.д. Для дальнейшего рассмотрения гидроксипроизводные целесообразно разделить на две группы: I. Соединения с группой ОН, связанной с sр3-атомом углерода – спирты; II. Соединения с группой ОН, связанной с sр2-атомом углерода: а) при связи С=С- енолы; б) в ароматическом ядре – фенолы.
IV.1.Спирты [соединения со связью с(sр3)-он].
 Известны
спирты одноатомные, двухатомные (диолы),
трехатомные (триолы) и содержащие большее
число гидроксигрупп. Для низших членов
гомологического ряда насыщенных диолов
(С2-С4)
часто употребляют тривиальное название
гликоли
(этиленгликоль, пропиленгликоль и т.д.).
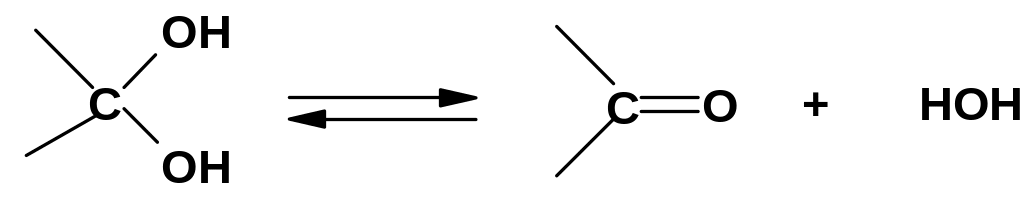
Структуры, содержащие две и, тем более,
три гидроксигруппы у
одного атома углерода (гем-диолы
и триолы), в большинстве случаев
неустойчивы
и отщепляют воду с образованием
карбонильной группы:
Известны
спирты одноатомные, двухатомные (диолы),
трехатомные (триолы) и содержащие большее
число гидроксигрупп. Для низших членов
гомологического ряда насыщенных диолов
(С2-С4)
часто употребляют тривиальное название
гликоли
(этиленгликоль, пропиленгликоль и т.д.).
Структуры, содержащие две и, тем более,
три гидроксигруппы у
одного атома углерода (гем-диолы
и триолы), в большинстве случаев
неустойчивы
и отщепляют воду с образованием
карбонильной группы:
Известны, однако, и достаточно устойчивые гем-диолы; некоторые из них будут приведены в разделе «Карбонильные соединения».
IV.1.1.Получение спиртов
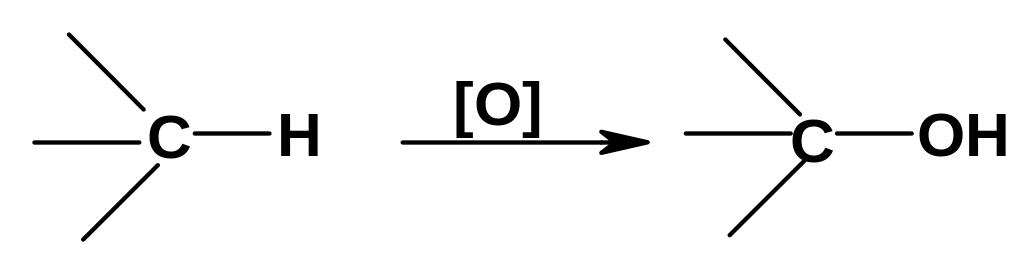 1.
Окисление
углеводородов
1.
Окисление
углеводородов
А. Окисление по sр3-атому углерода по схеме:
Ранее было рассмотрено окисление алканов, бензильного и аллильного положения с первоначальным образованием гидропероксидов; в ряде случаев дальнейшие превращения гидропероксидов приводят к образованию спиртов. В частности, был приведен пример получения трет-бутанола при окислении изобутана (стр. 63); другой пример- окисление циклогексана до циклогексанола. В этих реакциях субстрат окисляют кислородом в присутствии катализаторов (соли или комплексы Fe, Cu, Co, Mn и др.).
Известен ряд примеров биологического окисления под действием ферментов оксигеназ; пример окисления метана в метанол под действием метанмонооксигеназы был приведен ранее (стр.63). Сложные структуры (в частности, стероиды) окисляются in vivo по строго определенным положениям.
Б. Мягкое окисление С=С-связи алкенов с образованием виц-диолов (гидроксилирование) было рассмотрено в разделе «Алкены»
2. Синтезы на основе оксида углерода (II) и водорода. При каталитическом гидрировании оксида углерода (II) в зависимости от катализаторов и условий можно получать самые разнообразные продукты; одним из вариантов является получение спиртов; в частности, при нагревании с хроматом цинка образуется метанол:
СО + 2Н2 → СН3ОН
В других условиях получают другие спирты (в виде смеси).
3. Присоединение к алкенам. Эти реакции рассматривались в разделе «Алкены». Прямое присоединение воды в присутствии кислот, идущее по правилу Марковникова, позволяет получать (за исключением гидратации этилена) только вторичные и третичные спирты; однако, если проводить гидроборирование алкенов с последующим окислением аддуктов, то получаются «антимарковниковские», в том числе и первичные спирты.
4. Гидролиз галогенпроизводных (замещение галогена на гидроксигруппу) рассматривался в разделе «Галогенпроизводные».
 5.
Восстановление
карбонильных соединений.
Альдегиды и кетоны восстанавливаются
с образованием спиртов - первичных
из альдегидов
(R2=H)
и вторичных
из кетонов
(R2H):
5.
Восстановление
карбонильных соединений.
Альдегиды и кетоны восстанавливаются
с образованием спиртов - первичных
из альдегидов
(R2=H)
и вторичных
из кетонов
(R2H):
В качестве восстановителей часто используются комплексные гидриды металлов, в частности, алюмогидрид лития LiAlH4 и борогидрид натрия NaBH4. Более подробно реагенты и условия восстановления будут рассмотрены в разделе «Карбонильные соединения».
 При восстановлении
сложных эфиров образуются первичные
спирты:
При восстановлении
сложных эфиров образуются первичные
спирты:
Подробнее об этой реакции – в разделе «Карбоновые кислоты».
 6.
Взаимодействие
карбонильных соединений с металлорганическими
соединениями.
Альдегиды и кетоны взаимодействуют с
литий- и магнийорганическими соединениями
по схеме:
6.
Взаимодействие
карбонильных соединений с металлорганическими
соединениями.
Альдегиды и кетоны взаимодействуют с
литий- и магнийорганическими соединениями
по схеме:
Присоединение металлорганического соединения по связи С=О приводит к алкоголятам, гидролиз которых дает соответствующие спирты. Из альдегидов образуются вторичные спирты, из кетонов – третичные. Подробнее реакции будут обсуждаться в разделе «Карбонильные соединения».
Данный способ предоставляет, пожалуй, наибольшие возможности для синтеза самых разнообразных спиртов.
