
- •Глава III. Металлорганические соединения
- •III.1. Получение.
- •III.2. Строение литий- и магнийорганических соединений.
- •III.3. Химические свойства литий- и магнийорганических соединений.
- •ГлаваIv. Гидроксипроизводные углеводородов
- •IV.1.Спирты [соединения со связью с(sр3)-он].
- •IV.1.1.Получение спиртов
- •Свойства спиртов
- •IV.1.2. Физические свойства
- •IV.1.3. Химические свойства
- •IV.1.3.1. Кислотно-основные свойства спиртов.
- •IV.1.3.2. Спирты как субстраты в реакциях нуклеофильного замещения и элиминирования
- •1. Образование простых эфиров (алкилирование).
- •2. Образование сложных эфиров.
- •IV.1.3.4. Реакции окисления спиртов
- •Соединения со связью с(sр2)-он
- •IV.3. Фенолы (соединения с гидроксильной группой в ароматическом ядре)
- •IV.3.1. Способы получения фенолов.
- •IV.3.2. Химические свойства фенолов.
- •IV.3.2.1. Реакции группы он фенолов.
- •IV.3.2.2. Реакции электрофильного замещения в ароматическом ядре фенолов.
- •1V.4. Природные гидроксипроизводные.
- •Глава V. Простые эфиры
- •V.1. Простые эфиры (кроме оксиранов)
- •V.2. Оксираны (эпоксиды)
V.2. Оксираны (эпоксиды)
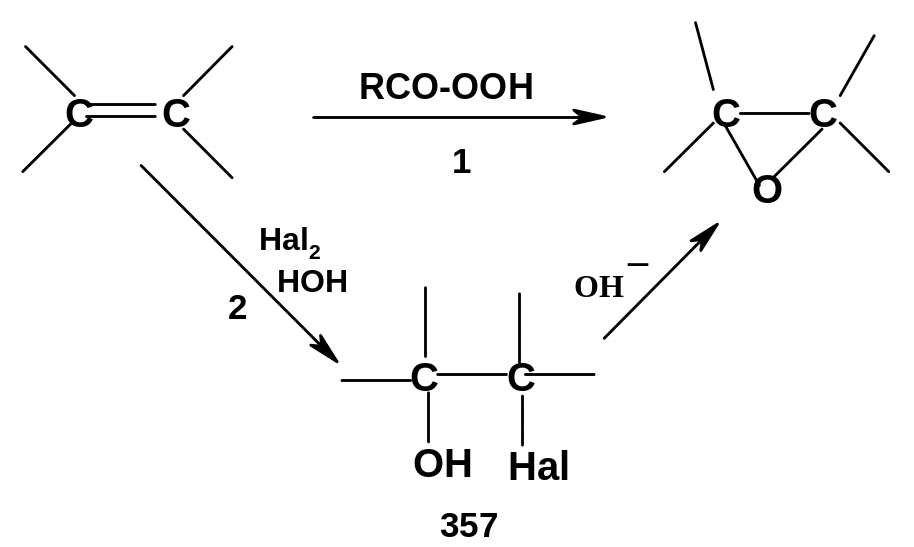
Наиболее распространенные методы синтеза оксиранов основаны на использовании алкенов:
1. Прямое эпоксидирование алкенов при действии надкислот (стр. 90);
2. Двухстадийный процесс: вначале присоединение к алкенам гипогалоидных кислот (действие хлора или брома в водной среде, см. стр. 83), затем отщепление галогеноводорода от образовавшегося галогенгидрина (357) при действии щелочей:
 Главное отличие
эпоксидов от обычных эфиров – легкость
разрыва связи С-О; причина в том, что при
этом раскрывается напряженный трехчленный
цикл; это энергетически выгодно. Раскрытие
цикла идет при действии нуклеофильных
реагентов; эпоксидный атом кислорода
является достаточно
хорошей уходящей группой.
Некоторые из типичных реакций эпоксидов
с нуклеофилами приведены ниже:
Главное отличие
эпоксидов от обычных эфиров – легкость
разрыва связи С-О; причина в том, что при
этом раскрывается напряженный трехчленный
цикл; это энергетически выгодно. Раскрытие
цикла идет при действии нуклеофильных
реагентов; эпоксидный атом кислорода
является достаточно
хорошей уходящей группой.
Некоторые из типичных реакций эпоксидов
с нуклеофилами приведены ниже:
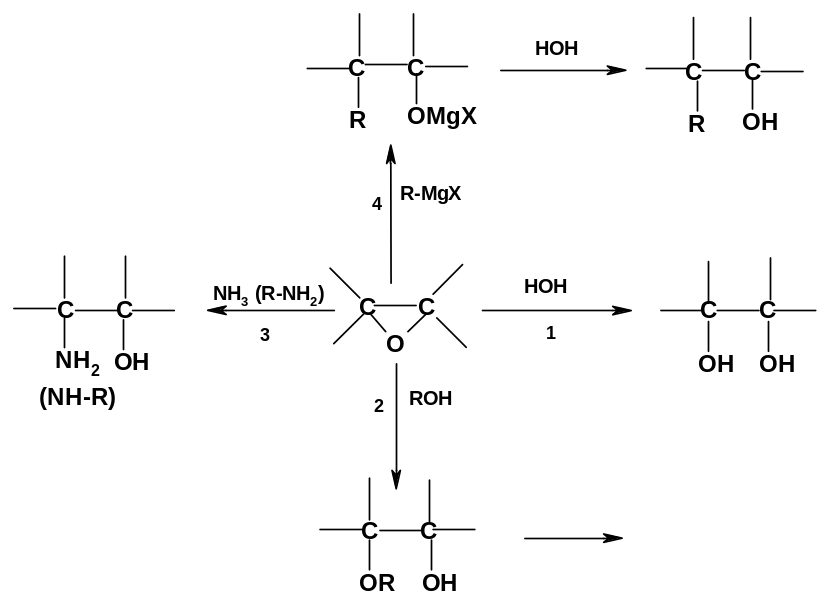
 При
реакциях с О-нуклеофилами – водой и
спиртами - в качестве первоначальных
продуктов образуются соответственно
виц-диолы
(реакция 1) или моноэфиры этих диолов
(реакция 2); при действии N-нуклеофилов
(аммиака и аминов) первичными продуктами
являются 1,2-аминоспирты (реакция 3); при
взаимодействии с С-нуклеофилами
(реактивами Гриньяра) происходит
наращивание углеродного скелета;
гидролиз получающихся при этом магниевых
алкоголятов приводит к соответствующим
спиртам (реакция 4). Первоначально
образующиеся продукты реакций 1-3 могут
далее
реагировать с исходным оксираном,
особенно при избытке оксирана, образуя
олигомерные и даже полимерные продукты:
При
реакциях с О-нуклеофилами – водой и
спиртами - в качестве первоначальных
продуктов образуются соответственно
виц-диолы
(реакция 1) или моноэфиры этих диолов
(реакция 2); при действии N-нуклеофилов
(аммиака и аминов) первичными продуктами
являются 1,2-аминоспирты (реакция 3); при
взаимодействии с С-нуклеофилами
(реактивами Гриньяра) происходит
наращивание углеродного скелета;
гидролиз получающихся при этом магниевых
алкоголятов приводит к соответствующим
спиртам (реакция 4). Первоначально
образующиеся продукты реакций 1-3 могут
далее
реагировать с исходным оксираном,
особенно при избытке оксирана, образуя
олигомерные и даже полимерные продукты:
Реакции 1-3 можно регулировать, направляя в сторону получения тех или иных продуктов (мономерных , т.е. первоначальных, олигомерных или полимерных). Реакции 1 и 2 обычно проводят либо с кислотным катализом, либо используя щелочи (ОН¯) вместо воды и алкоголяты (OR¯) вместо спиртов. Реакции 3 и 4 идут без катализа. Раскрытие эпоксидного цикла происходит по обычным механизмам нуклеофильного замещения – SN1 и SN2.
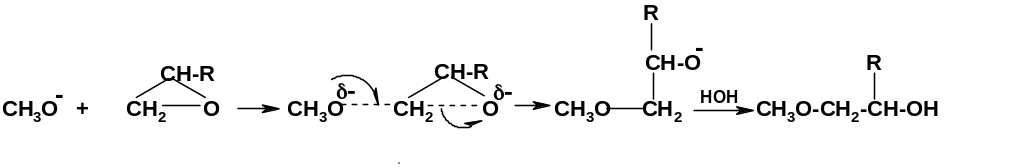 При
использовании сильных нуклеофилов
(ОН¯,OR¯)
реакция идет обычно по бимолекулярному
механизму:
При
использовании сильных нуклеофилов
(ОН¯,OR¯)
реакция идет обычно по бимолекулярному
механизму:
Если эпоксид несимметричен, нуклеофильный реагент атакует менее замещенный атом углерода, т.к. в этом случае переходное состояние менее пространственно напряжено.
При использовании слабых нуклеофилов (вода, спирты) реакция идет при кислотном катализе и преимущественно по мономолекулярному механизму:
В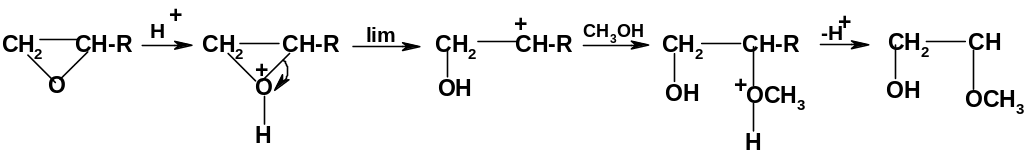 случае несимметричного эпоксида
нуклеофил присоединяется к более
замещенному
атому углерода, потому что на лимитирующей
стадии образуется более замещенный и,
следовательно, более устойчивый
карбокатион. [Строго говоря, эти реакции
идут не по «чистому» механизму SN1,
а по смешанному, промежуточному между
SN1
и SN2,
но регионаправленности это не меняет].
случае несимметричного эпоксида
нуклеофил присоединяется к более
замещенному
атому углерода, потому что на лимитирующей
стадии образуется более замещенный и,
следовательно, более устойчивый
карбокатион. [Строго говоря, эти реакции
идут не по «чистому» механизму SN1,
а по смешанному, промежуточному между
SN1
и SN2,
но регионаправленности это не меняет].
Известно большое число других нуклеофильных реакций эпоксидов, приводящих к самым разнообразным продуктам. Благодаря высокой реакционной способности и легкости получения, оксираны очень широко используются в органическом синтезе.
Достаточно легко (хотя и труднее, чем оксираны) реагируют с нуклеофилами оксетаны (четырехчленные циклические простые эфиры); они несколько менее доступны, чем оксираны, и поэтому используются реже.
Резюме
Простые эфиры проявляют свойства слабых оснований. Характерной особенностью простых эфиров является образование комплексов с ионами металлов; весьма эффективными ион-селективными комплексо- образователями являются краун-эфиры; эта способность обусловливает их использование в межфазном катализе. Связь С-О в большинстве типов простых эфиров разрывается с трудом. Исключением являются оксираны, для которых разрыв связи С-О протекает легко, т.к. при этом раскрывается напряженный трехчленный цикл; благодаря этому, оксираны вступают в реакции с большим кругом нуклеофильных реагентов и широко используются в органическом синтезе.
