
- •Глава III. Металлорганические соединения
- •III.1. Получение.
- •III.2. Строение литий- и магнийорганических соединений.
- •III.3. Химические свойства литий- и магнийорганических соединений.
- •ГлаваIv. Гидроксипроизводные углеводородов
- •IV.1.Спирты [соединения со связью с(sр3)-он].
- •IV.1.1.Получение спиртов
- •Свойства спиртов
- •IV.1.2. Физические свойства
- •IV.1.3. Химические свойства
- •IV.1.3.1. Кислотно-основные свойства спиртов.
- •IV.1.3.2. Спирты как субстраты в реакциях нуклеофильного замещения и элиминирования
- •1. Образование простых эфиров (алкилирование).
- •2. Образование сложных эфиров.
- •IV.1.3.4. Реакции окисления спиртов
- •Соединения со связью с(sр2)-он
- •IV.3. Фенолы (соединения с гидроксильной группой в ароматическом ядре)
- •IV.3.1. Способы получения фенолов.
- •IV.3.2. Химические свойства фенолов.
- •IV.3.2.1. Реакции группы он фенолов.
- •IV.3.2.2. Реакции электрофильного замещения в ароматическом ядре фенолов.
- •1V.4. Природные гидроксипроизводные.
- •Глава V. Простые эфиры
- •V.1. Простые эфиры (кроме оксиранов)
- •V.2. Оксираны (эпоксиды)
Глава V. Простые эфиры
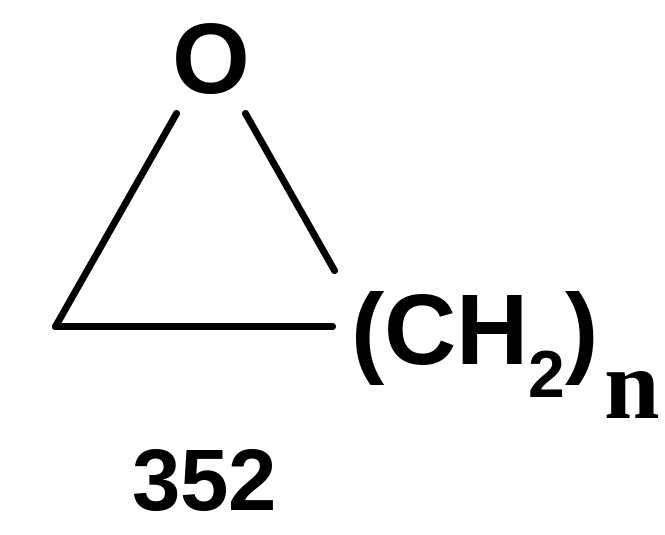 Ациклические
простые эфиры имеют общую формулу
R1-O-R2,
где R
– алкильные, алкенильные, арильные
радикалы. Простые эфиры могут также
быть циклическими; в наиболее простом
варианте они имеют строение (352):
Ациклические
простые эфиры имеют общую формулу
R1-O-R2,
где R
– алкильные, алкенильные, арильные
радикалы. Простые эфиры могут также
быть циклическими; в наиболее простом
варианте они имеют строение (352):
n=1,2….
Соединения типа (352) раньше называли окисями: при n=1 - -окисями, при n=2 - -окисями и т.д.; сейчас соединения с трехчленным кислородсодержащим циклом (n=1) называют оксиранами, а также эпоксидами, соединения с четырехчленным циклом (n=2) – оксетанами. В цикле может содержаться и более одного атома кислорода – это, в частности, упоминавшиеся ранее 1,4-диоксаны, а также краун-эфиры, речь о которых будет идти ниже.
Оксираны заметно отличаются по химическому поведению от других типов простых эфиров, и их целесообразно рассматривать отдельно. Определенное своеобразие характерно для оксетанов, но оно выражено менее заметно, чем для оксиранов. Циклические простые эфиры с 5- и более членными циклами, как правило, не отличаются по свойствам от ациклических простых эфиров; исключение – краун-эфиры (см. ниже).
V.1. Простые эфиры (кроме оксиранов)
Основные способы получения простых эфиров – алкилирование спиртов или алкоголятов, а также фенолятов (см. выше). Эфиры с алкенильными радикалами получают присоединением спиртов к алкинам (стр. 114).
Основные химические свойства простых эфиров связаны: А. С наличием неподеленных пар электронов на атоме кислорода; Б. С возможностью разрыва связи С-О; В. С активацией связей С-Н рядом с атомом кислорода.
А. Благодаря неподеленным парам электронов на атоме кислорода простые эфиры с алкильными радикалами (но не с арильными) проявляют свойства оснований и нуклеофилов, а также способность к координации с ионами металлов.
 1.
Они способны к О-протонированию (т.е.
проявляют свойства оснований
Бренстеда);
при этом образуются оксониевые соли:
1.
Они способны к О-протонированию (т.е.
проявляют свойства оснований
Бренстеда);
при этом образуются оксониевые соли:
Благодаря этому эфиры могут растворяться в концентрированных минеральных кислотах.
 2.
Они координируются с неорганическими
кислотами Льюиса (AlCl3,
SnCl4,
BF3)
(т.е. проявляют свойства оснований
Льюиса) также
с образованием оксониевых соединений;
особенно прочными являются аддукты с
BF3:
2.
Они координируются с неорганическими
кислотами Льюиса (AlCl3,
SnCl4,
BF3)
(т.е. проявляют свойства оснований
Льюиса) также
с образованием оксониевых соединений;
особенно прочными являются аддукты с
BF3:
Продукты взаимодействия – эфираты трифторида бора (353) – устойчивые соединения: при R=Et эфират перегоняется без разложения; этот эфират достаточно широко используется как кислотный катализатор.
 3. В реакциях
нуклеофильного
замещения
(как реагенты) простые эфиры используются
только в специальных случаях, при наличии
в субстрате очень хорошей уходящей
группы; результатом является, как и в
предыдущих случаях, образование
оксониевой соли:
3. В реакциях
нуклеофильного
замещения
(как реагенты) простые эфиры используются
только в специальных случаях, при наличии
в субстрате очень хорошей уходящей
группы; результатом является, как и в
предыдущих случаях, образование
оксониевой соли:
[группа СF3-SO2-O, называемая трифлатной, является одной из наиболее легко уходящих групп (лучшей, чем тозилатная), т.к. при отрыве образует весьма стабильный анион (- М-эффект фрагмента SO2 и сильнейший –I-эффект CF3)].
4. Простые эфиры образуют комплексы с ионами металлов и с металлорганическими соединениями; образование комплексов с магнийорганическими соединениями уже рассматривалось ранее (стр. 212). Именно по этой причине простые эфиры (диэтиловый эфир, тетрагидрофуран) – наилучшие растворители для получения реактивов Гриньяра и ряда других металлорганических соединений.
 Особой
комплексообразующей способностью по
отношению к ионам металлов обладают
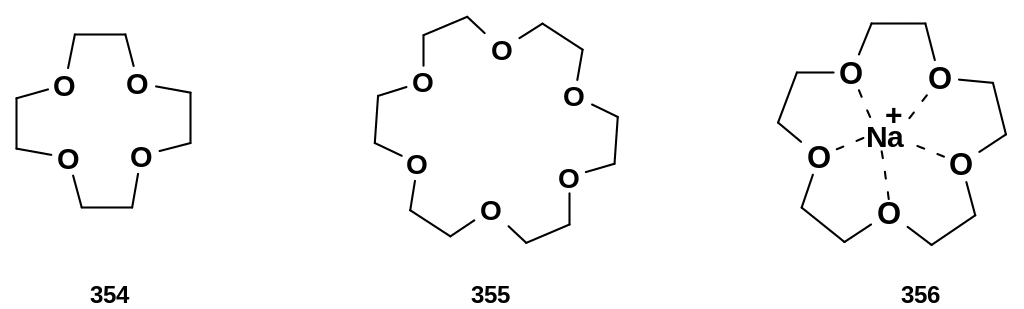
краун-эфиры
– макроциклические эфиры, содержащие
не менее четырех атомов кислорода в
цикле:
Особой
комплексообразующей способностью по
отношению к ионам металлов обладают
краун-эфиры
– макроциклические эфиры, содержащие
не менее четырех атомов кислорода в
цикле:
Название соединения (354) – 12-краун-4, соединения (355) – 18-краун-6; первая цифра соответствует общему числу атомов в цикле, вторая – числу атомов кислорода.
Краун-эфиры обладают способностью специфически координироваться с ионами металлов, прежде всего щелочных и щелочноземельных. Ион металла внедряется в середину макроцикла; при этом он ассоциируется сразу со всеми атомами кислорода. Наиболее прочные комплексы образуются с теми ионами, размер которых соответствует размерам «клетки» из атомов кислорода. В частности, ион натрия специфически комплексуется эфиром 15-краун-5 [(структура (356)], а ион калия – эфиром 18-краун-6. Такое специфическое комплексообразование является простой моделью так называемого молекулярного узнавания (молекулярного распознавания), когда реагент «узнает» комплементарный ему субстрат; узнавание осуществляется за счет многоточечных нековалентных взаимодействий. Молекулярное узнавание играет исключительно важную роль при протекании важнейших биохимических процессов (генетических процессов, реакций с ферментативным катализом), обеспечивая их высочайшую специфичность; без этого функционирование биологических систем было бы попросту невозможно.
Наиболее важное применение краун-эфиров в органической химии – использование их в межфазном катализе. Межфазный катализ – ускорение химической реакции между веществами, находящимися в различных фазах (две несмешивающиеся жидкости или жидкость – твердая фаза), под действием межфазных катализаторов (катализаторов межфазного переноса). Такими катализаторами являются соединения, которые переносят одно из реагирующих веществ из одной фазы в другую, где и встречаются партнера.
 Наиболее
типичные реакции в двухфазных системах
– взаимодействие между органическим
субстратом и неорганическим реагентом,
если первый растворим в органическом
растворителе и нерастворим в воде, а
второй – наоборот. В качестве примера
можно привести взаимодействие
галогенпроизводных со щелочами (R-Hal
+ КОН) по механизму
SN2
[использование смеси воды с органическим
растворителем здесь неприменимо – в
присутствии полярного протонного
растворителя (воды) реакции SN2
идут плохо]. Другой пример – окисление
водонерастворимых субстратов KMnO4.
Межфазные катализаторы обычно переносят
неорганический
реагент из водной фазы в фазу органического
растворителя.
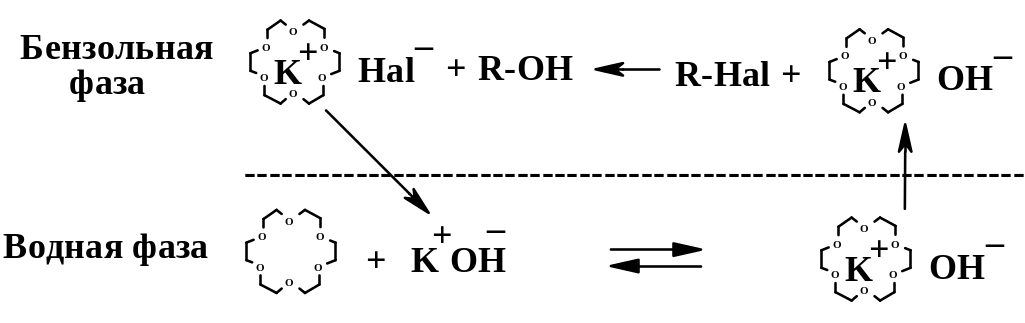
Краун-эфиры – один из основных типов
межфазных катализаторов; связывая
катион металла, они переносят неорганическую
соль или щелочь из водной фазы в
органическую:
Наиболее
типичные реакции в двухфазных системах
– взаимодействие между органическим
субстратом и неорганическим реагентом,
если первый растворим в органическом
растворителе и нерастворим в воде, а
второй – наоборот. В качестве примера
можно привести взаимодействие
галогенпроизводных со щелочами (R-Hal
+ КОН) по механизму
SN2
[использование смеси воды с органическим
растворителем здесь неприменимо – в
присутствии полярного протонного
растворителя (воды) реакции SN2
идут плохо]. Другой пример – окисление
водонерастворимых субстратов KMnO4.
Межфазные катализаторы обычно переносят
неорганический
реагент из водной фазы в фазу органического
растворителя.
Краун-эфиры – один из основных типов
межфазных катализаторов; связывая
катион металла, они переносят неорганическую
соль или щелочь из водной фазы в
органическую:
В данном примере краун-эфир (18-краун-6), реагируя в водной фазе с КОН , образует гидроксид с комплексно связанным катионом К+. Этот гидроксид, благодаря краун-эфирной «рубашке» вокруг катиона, способен растворяться в неводной фазе (бензоле); он диффундирует из водной фазы в бензольную, где и происходит реакция SN2 с галогенпроизводным. При этом нуклеофильность аниона ОН‾ очень заметно возрастает, т.к. противоион К+ прочно связан краун-эфиром и лишь слабо взаимодействует с анионом. Таким образом, скорость реакции возрастает [подобная активация наблюдается при использовании в реакциях SN2 диполярных апротонных растворителей (стр. 161); при использовании краун-эфиров активация еще сильнее]. Галогенид комплексно связанного катиона К+ диффундирует из бензольной фазы в водную, по реакции с КОН обменивает С1‾ на ОН‾ и т.д.
Использование межфазного катализа весьма существенно расширило возможности препаративной органической химии: стало возможным проводить многие известные реакции быстрее и с лучшими выходами, а также осуществить реакции, которые ранее проводить не удавалось. Межфазный перенос – модель транспорта ионов через биологические мембраны.
Кроме краун-эфиров, в качестве катализаторов межфазного переноса используют четвертичные аммонийные соли; это будет рассмотрено в разделе «Амины».
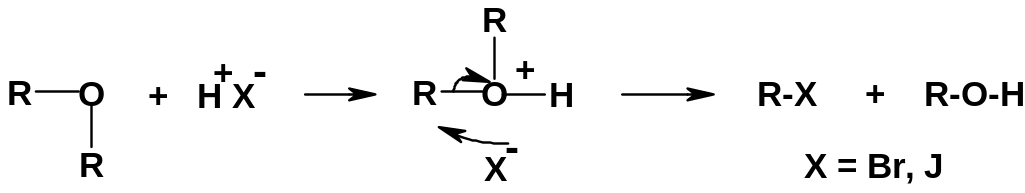 Б.
Группа OR
– еще более плохая уходящая группа, чем
группа ОН;
к тому же ее нельзя превратить в группу
типа тозилата. Разрыв
связи С-О в
простых эфирах идет с большим трудом и
только после О-протонирования, т.е. в
сильнокислых средах (HCl
или HBr):
Б.
Группа OR
– еще более плохая уходящая группа, чем
группа ОН;
к тому же ее нельзя превратить в группу
типа тозилата. Разрыв
связи С-О в
простых эфирах идет с большим трудом и
только после О-протонирования, т.е. в
сильнокислых средах (HCl
или HBr):
В. Реакции связей С-Н в -положении к атому кислорода. Связи С-Н, находящиеся рядом с атомом кислорода, легко разрываются гомолитически, поэтому для эфиров легко протекают радикальные реакции галогенирования и аутоокисления. Последняя реакция приводит к тому, что при хранении простых эфиров в них накапливаются гидропероксиды:
П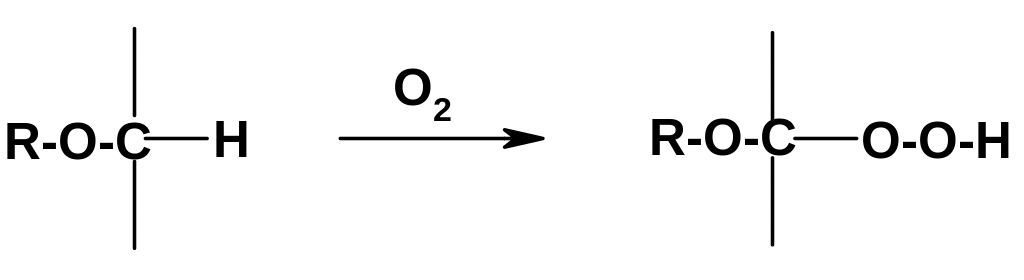 ри
перегонке долго хранившихся эфиров
возможен взрыв гидропероксидов, которые
накапливаются в перегонной колбе по
мере отгонки эфира; поэтому перед
перегонкой эфир следует очистить от
пероксидов при помощи известных методов.
Это относится к наиболее широко
используемому диэтиловому эфиру и,
особенно, к диизопропиловому эфиру,
который окисляется еще более легко.
ри
перегонке долго хранившихся эфиров
возможен взрыв гидропероксидов, которые
накапливаются в перегонной колбе по
мере отгонки эфира; поэтому перед
перегонкой эфир следует очистить от
пероксидов при помощи известных методов.
Это относится к наиболее широко
используемому диэтиловому эфиру и,
особенно, к диизопропиловому эфиру,
который окисляется еще более легко.
Некоторые простые эфиры (диэтиловый эфир, 1,4-диоксан, тетрагидрофуран) широко используются в качестве растворителей. трет-Бутилэтиловый эфир используют в качестве добавки к бензину, повышающей его октановое число.
