
1.5 Рух мікрочастинки у водневоподiбному атомі
У
воднеподiбному атомi навколо ядра з
зарядом
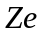 (
(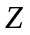 -
порядковий номер хiмiчного елементу)
рухається тiльки один електрон. Потенцiйна
енергiя взаємодiї його з ядром дорiвнює:
-
порядковий номер хiмiчного елементу)
рухається тiльки один електрон. Потенцiйна
енергiя взаємодiї його з ядром дорiвнює:
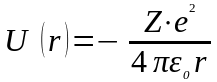 .
(76)
.
(76)
На
рисунку 8 показано криву
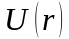 .
З нього видно, що водневоподiбний атом
можна розглядати як своєрiдну потенцiйну
яму, обмежену потенцiйною кривою. Електрон
у цiй ямi володiє негативною енергiєю.
.
З нього видно, що водневоподiбний атом
можна розглядати як своєрiдну потенцiйну
яму, обмежену потенцiйною кривою. Електрон
у цiй ямi володiє негативною енергiєю.
Пiдставляючи (76) у (14), одержимо рiвняння Шредiнгера, яке описує стацiонарний стан водневоподiбного атому:
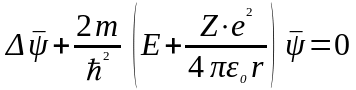 .
(77)
.
(77)

Рис. 8. Залежнiсть енергiї взаємодiї електрону з ядром
воднеподiбного атома вiд вiдстанi.
Рiшення цього рiвняння дає наступні основні результати.
1. Електрон у водневоподiбному атомi володiє дискретним енергетичним спектром. Власнi значення енергiї визначаються формулою:
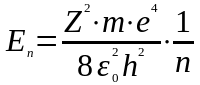 ,
(78)
,
(78)
де - головне квантове число.
На рисунку 8 показане розташування енергетичних рiвнiв у водневоподiбному атомi.
2. Орбiтальний момент кiлькостi руху електрона може приймати лише наступний ряд дискретних значень:
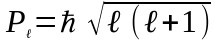 ,
(79)
,
(79)
де
 -
орбiтальне
(азимутальне) квантове число.
-
орбiтальне
(азимутальне) квантове число.
Воно може приймати будь-які значення з наступного цiлочисельного ряду:
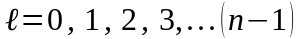 (80)
(80)
- усього значень.
3.
Стан з
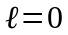 (при будь-якому
)
прийнято називати
(при будь-якому
)
прийнято називати
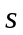 -станом,
-станом,
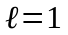 -
-
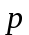 -станом,
-станом,
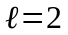 -
d-станом,
-
d-станом,
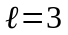 -
-
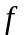 -станом
і т.д.
-станом
і т.д.
4.
Орбiтальний момент кiлькостi руху може
орiєнтуватися вiдносно вибраного напрямку
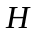 лише таким чином, що проекцiя його на
цей напрямок цiлократна
лише таким чином, що проекцiя його на
цей напрямок цiлократна
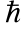 (рис. 9):
(рис. 9):
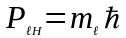 .
(81)
.
(81)
Число
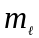 зветься магнiтним
квантовим числом.
Воно може приймати усi цiлочисельнi
значення вiд
зветься магнiтним
квантовим числом.
Воно може приймати усi цiлочисельнi
значення вiд
 до
до
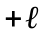 ,
включаючи нуль:
,
включаючи нуль:
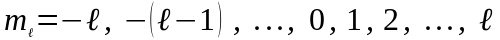 (82)
(82)
-
усього
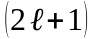 значень.
значень.

Рис. 9. Орiєнтацiя орбiтального моменту кiлькостi руху вiдносно обраного напрямку Н.
Висновки
1.
Стан електорну у водневоподiбному атомi
визначається трьома квантовими числами
- головним
,
що характеризує енергiю
;
орбiтальним
,
що визначає орбiтальний момент кiлькостi
руху електрона
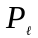 ,
та магнiтним
,
що характеризує орiєнтацiю
вiдносно вибраного напрямку.
,
та магнiтним
,
що характеризує орiєнтацiю
вiдносно вибраного напрямку.
2.
Цi стани описуються власними хвильовими
функцiями
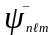 ,
якi є рiшеннями рiвняння Шредiнгера (77).
,
якi є рiшеннями рiвняння Шредiнгера (77).
3.
Iмовiрнiсть знаходження електрону у
кульковому шарi товщиною
 ,
замкненому помiж
та
,
замкненому помiж
та
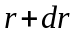 ,
дорiвнює добутку
,
дорiвнює добутку
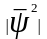 на об'єм цього шару
на об'єм цього шару
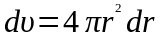 :
:
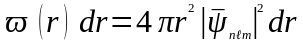 .
(83)
.
(83)
Щільність
iмовiрностi знаходження електрону на
вiдстанi r
вiд ядра дорiвнює
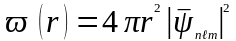 .
.
Перехiд до багатоелектронних атомiв
У багатоелектронних атомах валентний електрон взаємодiє не тiльки з ядром, але й з iншими електронами, внаслiдок чого у виразi для потенцiйної енергiї з'являються додатковi члени, якi вiдповiдають цю взаємодiю. Наявнiсть таких членiв не дозволяє одержати точне рiшення рiвняння Шредiнгера. Тому вдаються до наближених методів рiшення.
У
простiших випадках рахують, що потенцiал
взаємодiї валентного електрону з
електронною оболонкою являється
приблизно сферично симетричним i задачу
вирiшують, як для водневоподiбного атому.
Природньо, що таке рiшення повинно мати
багато спiльного з рiшенням задачi про
водневоподiбний атом. Зокрема, стан
електрону у атомi характеризується
завданням таких же трьох квантових
чисел, що й стан у атомi водню. Проте
вiдхилення потенцiалу поля вiд чисто
кулонiвського, що викликане взаємодiєю
електронiв мiж собою, призводить до того,
що енергiя електрону стає функцiєю не
тiльки головного, але й орбiтального
квантового числа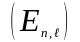 .
.
Спiн електрону
Iз
загальних принципiв квантової механiки
випливає, що крiм маси та заряду, електрон
повинен володiти власним моментом
кiлькостi руху
 :
:
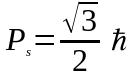 .
(84)
.
(84)
Гiпотеза про iснування цього моменту була вперше висунута у 1927 р. Гаудсмiтом та Уленбеком для пояснення законо-мiрностей у лiнiйчастих спектрах та експериментально доведена Штерном і Герлахом. На початку припускалось, що власний момент кiлькостi руху виникає внаслiдок обертання електрона навколо власної осi. Тому вiн одержав назву спiну (вiд англiйського "spin" - обертання, веретено). Проте таке уявлення про спiн є первiсним, невiд'ємною властивiстю електрону, що не зводиться до бiльш простого.
Проекцiя спiну на напрямок може мати лише два значення:
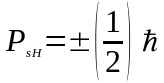 .
(85)
.
(85)
По аналогiї з формулою (81), цей вираз можна записати таким чином:
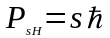 ,
(86)
,
(86)
де
називається спiновим квантовим числом.
Iз порiвняння (85) та (86) видно, що
 може приймати тiльки два значення:
може приймати тiльки два значення:
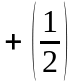 та
та
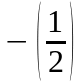 .
.
