
- •2. Что такое интерференция света и каковы необходимые условия ее осуществления?
- •3. Дайте вывод и объяснение условий максимумов и минимумов при интерференции света.
- •4. Что такое показатель npeломления вещества, чем он обусловлен, от чего зависит и
- •5. Почему в отраженном от пленки свете интерференционная картина получается гораздо более контрастной, нежели в проходящем свете?
- •6. Как образуется интерференционная картина в экспериментальной установке
- •2. Охарактеризуйте основную задачу дифракции и способы подхода к ее решению с позиций принципа Гюйгенса - Френеля и метода зон Френеля.
- •3. Объясните соотношение между волновой и геометрической оптиками на примере анализа методом зон Френеля дифракции света на непрозрачном диске и на круглом отверстии.
- •6. Что такое дисперсия и разрешающая сила (способность) решетки и как, и почему они зависят от постоянной (периода) решетки, числа щелей в ней и порядка спектра?
- •2. Охарактеризуйте виды поляризации света и их взаимосвязь, взаимопредставления.
- •3. Охарактеризуйте методы получения поляризованного света и дайте вывод закона Малюса.
- •4. Дайте детальный физический анализ закону Брюстера.
- •5. Проанализируйте полученные в работе результаты на их физическую достоверность и соответствие целям и задачам работы.
- •2. Каковы основные закономерности внешнего фотоэффекта?
- •4. Что такое фотоны, и почему фотоэффект относят к типично квантовым оптическим явлениям?
- •2. Почему энергия электрона в атоме квантуется? Как это подтверждается экспериментом?
- •3. Чем объясняется упорядоченность линий в спектре излучения водородоподобных атомов? Почему разные серии не перекрываются друг с другом?
- •4. Объясните вывод из теории Бора обобщённой формулы Бальмера.
- •2. Как де Бройль «объяснил» правило Бора квантования орбит электрона в атоме водорода?
- •5. Чем объясняется размытость спадов анодного тока в опыте Франка – Герца, и почему в них анодный ток уменьшается не до нуля?
- •6. Почему в данной работе не наблюдается второй потенциал возбуждения?
- •2. Что такое радиоактивность? Как объясняется механизм испускания ядрами альфа-, бета- и гамма- лучей? Какие изменения происходят при этом с ядром?
- •4. Как выводится закон радиоактивного распада и почему он носит экспоненциальный характер? Какой физический смысл имеют его основные характеристики?
2. Как де Бройль «объяснил» правило Бора квантования орбит электрона в атоме водорода?
Де Бройль использовал представление о волнах (де Бройля) для наглядного представления таинственного правила квантования орбит Бора в случае одноэлектронного атома. Он рассматривал волну де Бройля, бегущую вокруг ядра по круговой орбите электрона. Если на длине орбиты 2r длина волны укладывается целое число раз, то при обходе ядра она будет всякий раз возвращаться в исходную точку с той же фазой и амплитудой. В каждой точке орбиты установится неизменный во времени колебательный режим стоячей волны (не переносящей энергию), и не возникнет излучения, что и есть условие стационарности орбиты. Исходя из этих соображений, де Бройль записал условие стационарности орбиты или правило квантования, в виде: 2r/ = n, где n = 1, 2, 3…
Полагая,
что
= h/р и замечая, что pr = L (L – момент импульса
электрона), получим:
2rр/h
= n
L = n![]() - квантовое условие Бора (целочисленность
момента импульса L в постоянных Планка
- квантовое условие Бора (целочисленность
момента импульса L в постоянных Планка
![]() ).
В этом де Бройль видел успех своей
концепции волн материи. В дальнейшем
квантовое условие удалось обобщить и
на случай некруговых, эллиптических
орбит. Но этот успех оказался призрачным.
В рассуждениях де Бройля предполагалось,
что волна распространяется не в
пространстве, а вдоль линии – вдоль
стационарной орбиты электрона. Такая
идеализация соответствует приближению
геометрической (лучевой оптики),
справедливому лишь в предельном случае
малости
в сравнении с радиусом r орбиты, т. е. при
больших квантовых числах. А тогда сама
проблема квантования оказывается
несущественной.
).
В этом де Бройль видел успех своей
концепции волн материи. В дальнейшем
квантовое условие удалось обобщить и
на случай некруговых, эллиптических
орбит. Но этот успех оказался призрачным.
В рассуждениях де Бройля предполагалось,
что волна распространяется не в
пространстве, а вдоль линии – вдоль
стационарной орбиты электрона. Такая
идеализация соответствует приближению
геометрической (лучевой оптики),
справедливому лишь в предельном случае
малости
в сравнении с радиусом r орбиты, т. е. при
больших квантовых числах. А тогда сама
проблема квантования оказывается
несущественной.
3. Охарактеризуйте физическую сущность и значимость в атомной физике опыта Франка – Герца.
Д
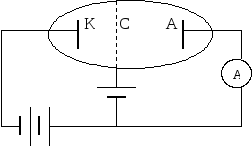
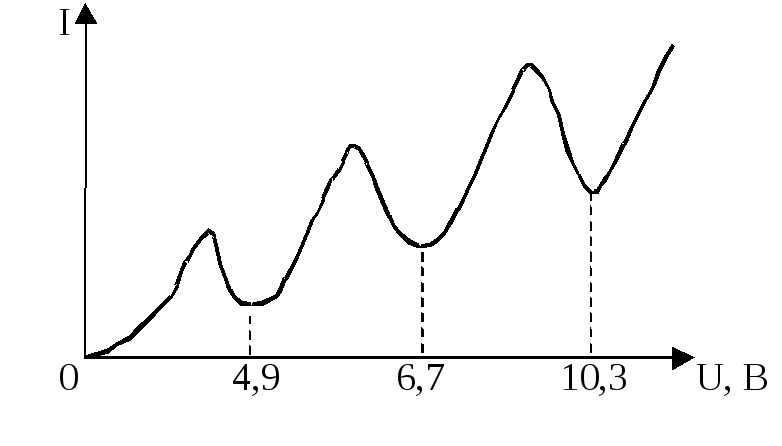
триод, наполненную парами ртути, они обнаружили провалы на вольтамперной характеристике I(U). Эти провалы, т. е. снижения силы тока при некоторых значениях напряжения между анодом А и сеткой С, были объяснены ими как результат неупругого соударения носителей тока – электронов с атомами ртути10. Сетка С, на которую подавался небольшой, порядка 0,5 В положительный потенциал относительно анода, «перехватывала» «ослабевшие» электроны, потерявшие свою кинетическую энергию в результате неупругих соударений с атомами ртути. Соответственно на анод попадало меньше электронов, что и проявляло себя в уменьшении анодного тока. Атомы ртути могли воспринять (забрать) от электронов лишь определенную энергию, кратную энергии их возбуждения. Если пары ртути достаточно разрежены, то столкновения ускоряемого электрическим полем электрона с атомами ртути достаточно редки. Электрон успевает накопить энергию достаточную для возбуждения атомов ртути не только в ближайшее, но и более высокие возбужденные состояния. При этом атомы ртути переходят в возбуждённые состояния, отстоящие от основного по энергии на 4,9 эВ; 6,7 эВ; 10,3 эВ… . Это говорит о том, что энергия атома ртути обладает дискретным спектром значений.
В более плотных парах второй минимум тока на ВАХ объясняется тем, что электрон ускоренный до энергии, в два раза превышающей энергию возбуждения, оказывается в состоянии достаточно быстро произвести последовательное возбуждение двух атомов ртути. Поэтому первый и второй минимумы тока на ВАХ отстоят на величину, равную первому потенциалу возбуждения.
4. Что такое потенциал возбуждения атома и какова физическая идея его опытного определения в данной работе?
Разность
энергий электрона на втором и первом
энергетических уровнях называется
энергией
![]() возбуждения
атома. Выраженная в вольтах эта энергия
называется первым потенциалом возбуждения
атома. Для водорода: Ев
= Е2
– Е1
= 10,2 эВ и 1
= Ав/qе
= 10,2 В.
возбуждения
атома. Выраженная в вольтах эта энергия
называется первым потенциалом возбуждения
атома. Для водорода: Ев
= Е2
– Е1
= 10,2 эВ и 1
= Ав/qе
= 10,2 В.
В основу метода экспериментального определения первого потенциала возбуждения положена выявленная Франком и Герцем особенность вольтамперной характеристики лампы, содержащей разреженный газ из соответствующих атомов. Эта особенность заключается в том, что на вольтамперной характеристике чередуются провалы, отстающие друг от друга по напряжению на величину, равную первому потенциалу возбуждения атомов газа. Расстояние по напряжению между первыми двумя провалами на ВАХ, равное первому потенциалу возбуждения, и определяется опытным путем в данной работе.
