
- •2. Что такое интерференция света и каковы необходимые условия ее осуществления?
- •3. Дайте вывод и объяснение условий максимумов и минимумов при интерференции света.
- •4. Что такое показатель npeломления вещества, чем он обусловлен, от чего зависит и
- •5. Почему в отраженном от пленки свете интерференционная картина получается гораздо более контрастной, нежели в проходящем свете?
- •6. Как образуется интерференционная картина в экспериментальной установке
- •2. Охарактеризуйте основную задачу дифракции и способы подхода к ее решению с позиций принципа Гюйгенса - Френеля и метода зон Френеля.
- •3. Объясните соотношение между волновой и геометрической оптиками на примере анализа методом зон Френеля дифракции света на непрозрачном диске и на круглом отверстии.
- •6. Что такое дисперсия и разрешающая сила (способность) решетки и как, и почему они зависят от постоянной (периода) решетки, числа щелей в ней и порядка спектра?
- •2. Охарактеризуйте виды поляризации света и их взаимосвязь, взаимопредставления.
- •3. Охарактеризуйте методы получения поляризованного света и дайте вывод закона Малюса.
- •4. Дайте детальный физический анализ закону Брюстера.
- •5. Проанализируйте полученные в работе результаты на их физическую достоверность и соответствие целям и задачам работы.
- •2. Каковы основные закономерности внешнего фотоэффекта?
- •4. Что такое фотоны, и почему фотоэффект относят к типично квантовым оптическим явлениям?
- •2. Почему энергия электрона в атоме квантуется? Как это подтверждается экспериментом?
- •3. Чем объясняется упорядоченность линий в спектре излучения водородоподобных атомов? Почему разные серии не перекрываются друг с другом?
- •4. Объясните вывод из теории Бора обобщённой формулы Бальмера.
- •2. Как де Бройль «объяснил» правило Бора квантования орбит электрона в атоме водорода?
- •5. Чем объясняется размытость спадов анодного тока в опыте Франка – Герца, и почему в них анодный ток уменьшается не до нуля?
- •6. Почему в данной работе не наблюдается второй потенциал возбуждения?
- •2. Что такое радиоактивность? Как объясняется механизм испускания ядрами альфа-, бета- и гамма- лучей? Какие изменения происходят при этом с ядром?
- •4. Как выводится закон радиоактивного распада и почему он носит экспоненциальный характер? Какой физический смысл имеют его основные характеристики?
2. Почему энергия электрона в атоме квантуется? Как это подтверждается экспериментом?
Атом является квантовой системой. Движение электронов в нем пространственно ограничено, и их энергия (а с нею и энергия атома в целом) квантуется, то есть принимает дискретный ряд значений. Согласно квантовой механике, аналитически общие условия квантования энергии микрочастицы задаются как условия ее локализации (двухсторонней пространственной ограниченности области ее движения):
![]() .
.
Волновая функция (х) квадратом своего модуля |(х)|2 выражает плотность вероятности местонахождений частицы. Поэтому условие (х) 0 при х означает, что с ненулевой вероятностью частица обнаруживается в некоторой конечной, ограниченной области (между – и + ), которая и есть область ее локализации.
Д

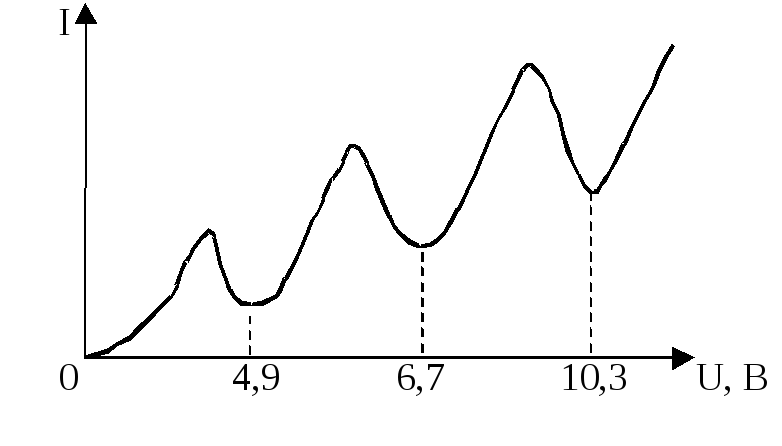
триод, наполненную парами ртути, они обнаружили провалы на вольтамперной характеристике I(U). Эти провалы, т. е. снижения силы тока при некоторых значениях напряжения между анодом А и сеткой С, были объяснены ими как результат неупругого соударения носителей тока – электронов с атомами ртути7. Сетка С, на которую подавался небольшой, порядка 0,5 В положительный потенциал относительно анода, «перехватывала» «ослабевшие» электроны, потерявшие свою кинетическую энергию в результате неупругих соударений с атомами ртути. Соответственно на анод попадало меньше электронов, что и проявляло себя в уменьшении анодного тока. Атомы ртути могли воспринять (забрать) от электронов лишь определенную энергию, кратную энергии их возбуждения. Если пары ртути достаточно разрежены, то столкновения ускоряемого электрическим полем электрона с атомами ртути достаточно редки. Электрон успевает накопить энергию достаточную для возбуждения атомов ртути не только в ближайшее, но и более высокие возбужденные состояния. При этом атомы ртути переходят в возбуждённые состояния, отстоящие от основного по энергии на 4,9 эВ; 6,7 эВ; 10,3 эВ… . Это говорит о том, что энергия атома ртути обладает дискретным спектром значений.
В более плотных парах второй минимум тока на ВАХ объясняется тем, что электрон ускоренный до энергии, в два раза превышающей энергию возбуждения, оказывается в состоянии достаточно быстро произвести последовательное возбуждение двух атомов ртути. Поэтому первый и второй минимумы тока на ВАХ отстоят на величину, равную первому потенциалу возбуждения.
3. Чем объясняется упорядоченность линий в спектре излучения водородоподобных атомов? Почему разные серии не перекрываются друг с другом?
Вытекающая из теории Бора дискретная структура энергетических уровней электрона в атоме позволяет объяснить закономерности в спектре излучения атома водорода. Из опыта известно, что спектр теплового излучения невзаимодействующих атомов имеет дискретный характер в виде совокупности отдельных спектральных линий, которые определённым образом упорядочены в некоторые группы, называемые сериями. Такая сериальная упорядоченность спектра излучения атома водорода описывается обобщённой формулой Бальмера:
![]() ,
где
,
где
![]() и
и
![]() - постоянные Ридберга:
- постоянные Ридберга:
n - номер спектральной серии; n = 1, 2, 3 …
m - номер спектральной линии в серии; m = n + 1, m + 2 …
При
n = 1;
=![]() (1
– 1/m2),
где m = 2, 3, 4 … - серия Лаймана – лежит в
ультрафиолетовом
диапазоне. Она включает в себя спектральные
линии, порождаемые при переходах
электрона с более высоких энергетических
уровней (орбит) с m = 2, 3, 4 … на самый низкий
– первый.
(1
– 1/m2),
где m = 2, 3, 4 … - серия Лаймана – лежит в
ультрафиолетовом
диапазоне. Она включает в себя спектральные
линии, порождаемые при переходах
электрона с более высоких энергетических
уровней (орбит) с m = 2, 3, 4 … на самый низкий
– первый.
При
n = 2;
=![]() (1/22
– 1/m2),
где m = 3, 4, 5… - серия Бальмера. Она включает
в себя спектральные линии, порождаемые
при переходах электрона с более высоких
энергетических уровней (орбит) с m = 3, 4,
5… на второй уровень. Первые четыре ее
линии лежат в видимой
области
спектра, то есть наблюдаются в опыте.
(1/22
– 1/m2),
где m = 3, 4, 5… - серия Бальмера. Она включает
в себя спектральные линии, порождаемые
при переходах электрона с более высоких
энергетических уровней (орбит) с m = 3, 4,
5… на второй уровень. Первые четыре ее
линии лежат в видимой
области
спектра, то есть наблюдаются в опыте.
n

![]() (1/32
– 1/m2), где
m = 4, 5, 6 … - серия Пашена – лежит в
инфракрасной
области.
(1/32
– 1/m2), где
m = 4, 5, 6 … - серия Пашена – лежит в
инфракрасной
области.
Наглядное представление механизма образования сериально упорядоченного линейчатого спектра атома водорода дано на схеме его энергетических уровней.
