
- •Оглавление
- •1.Предмет и задачи тд. Модели тд.
- •2.Модели тд. Объяснение агрегатных состояний вещества.
- •3.Методы тд.
- •4.Исходные понятия тд.
- •5.Постулаты термодинамики.
- •6.Начала тд.
- •7.Термическое и калорическое уравнения состояния. Термическое уравнение состояние идеального газа.
- •8.Внутренняя энергия идеального газа. Калорическое уравнение состояние идеального газа.
- •9.I начало термодинамики.
- •I начало тд обобщает закон сохранения энергии для тд процессов: количество теплоты, сообщаемое системе, идет на изменение ее внутренней энергии и совершение системой работы.
- •10.Теплоемкость.
- •11.Теплоемкость идеального газа.
- •12. 13.Теорема о равнораспределении энергии по степеням свободы. Число степеней свободы молекул. Число степеней свободы молекул. Выражение для внутренней энергии идеального газа.
- •14.Изохорический процесс: уравнение, график в pv, pt, vt координатах.
- •15.I начало термодинамики в изохорическом процессе.
- •16.Изобарический процесс: уравнение, график в pv, pt, vt координатах.
- •17. I начало термодинамики в изобарическом процессе.
- •18.Изотермический процесс: уравнение, график в pv, pt, vt координатах.
- •19.I начало термодинамики в изотермическом процессе.
- •20.Адиабатический процесс. Уравнение адиабаты. График адиабаты.
- •21.I начало термодинамики в адиабатическом процессе.
- •22.Политропный процесс. Уравнение политропы, показатель политропы, график политропы.
- •23.I начало термодинамики в политропном процессе.
- •24.Изопроцессы как предельные случаи политропного процесса.
- •25.Обратимые и циклические процессы.
- •26. Тепловые машины. Эффективность работы тепловой машины.
- •27.Холодильные машины. Эффективность работы холодильной машины.
- •28.29.Цикл Карно. К.П.Д. Цикла Карно. Идеальная тепловая машина Карно.
- •30. I Теорема Карно.
- •31.II теорема Карно. Реальные тепловые машины.
- •32.II начало термодинамики в формулировках Кельвина и Клаузиуса.
- •33.Тождество Клаузиуса, неравенство Клаузиуса.
- •34. Понятие энтропии. Свойства энтропии. Размерность.
- •35.Энтропия в обратимых и необратимых процессах.
- •36. Энтропия идеального газа.
- •37.III начало тд. Следствия III начала тд.
- •38.Энтальпия.
- •39.Свободная энергия идеального газа.
- •40.Метод тд потенциалов.
- •С 41 по 46 не разделила!смотреть тут(то что красным)!!!:
- •48.Условия равновесия и устойчивости системы в термостате при постоянном объеме.
- •49.Условия равновесия и устойчивости системы в термостате при постоянном внешнем давлении.
- •50.Условия равновесия и устойчивости системы при постоянных энтропии и давлении.
- •51. Условия равновесия и устойчивости системы при постоянных энтропии и объеме.
- •52.Условия равновесия и устойчивости системы с переменным числом частиц в термостате, при постоянных химическом потенциале и объеме.
- •53. Условия равновесия и устойчивости двухфазной однокомпонентной изолированной системы.
- •54.Принцип Ле Шателье-Брауна. Примеры проявления принципа Ле Шателье-Брауна.
- •55.Начала статистической физики: исходные понятия теории вероятности.
- •56.Начала статистической физики: макро- и микросостояния, статистический ансамбль, микроканонический ансамбль, постулат равновероятности.
- •57.Начала статистической физики: эргодическая гипотеза, статистический вес, статистическое толкование энтропии.
- •58.Начала статистической физики: флуктуации.
- •65.Характерные скорости распределения Максвелла: средняя квадратичная скорость.
- •66.Характерные скорости распределения Максвелла: наиболее вероятная скорость.
- •67. Подсчет числа молекул скорости, которых лежат в заданном диапазоне.
- •68.Экспериментальная проверка закона распределения.
- •69.Вывод основного уравнения молекулярно-кинетической теории идеального газа.
- •70.Вывод уравнения состояния. Закон Дальтона. Закон Авогадро.
- •71.72.( Не разделены!)Распределение Больцмана. (72)Барометрическая формула.
- •73.Экспериментальное определение постоянной Авогадро.
- •74.Теорема о равнораспределении энергии по степеням свободы.
- •75.Расхождение теории теплоемкости идеального газа с экспериментом.
- •76.Статистика Ферми-Дирака (подсчет числа микросостояний, функция распределения).
- •77.Статистика Бозе-Эйнштейна (подсчет числа микросостояний, функция распределения).
- •78.Длина свободного пробега.
- •79.Частота столкновений в единицу времени, понятие физического вакуума.
- •80.Явления переноса: теплопроводность.
- •81.Явления переноса: диффузия.
- •82.Явления переноса: вязкое трение.
- •83.Молекулярная теория явлений переноса: вывод уравнения переноса параметра .
- •84.Молекулярная теория явлений переноса: вывод уравнения коэффициента диффузии.
- •85.Молекулярная теория явлений переноса: вывод уравнения коэффициента теплопроводности.
- •86.Молекулярная теория явлений переноса: вывод уравнения коэффициента вязкости.
- •87.Силы и потенциальная энергия межмолекулярного взаимодействия.
- •88.Вывод уравнения Ван-дер-Ваальса.
- •89.Изотермы Ван-дер-Ваальса.
- •Часть 7—6 — отвечает газообразному состоянию;
- •Часть 2—1 — жидкому;
- •Часть 6—2, — горизонтальный участок, соответствующий равновесию жидкой и газообразной фаз вещества.
- •90.Фазовые переходы. Уравнения Клайперона-Клаузиуса.
- •91.Поверхностное натяжение в жидкостях.
- •92.Смачивание
- •93.Капиллярные явления. Формула Лапласса.
- •94.Строение твердых тел. Классификация элементарных ячеек.
- •95.Дефекты кристаллических решеток.
- •96.Температура. Температурные шкалы. Способы измерения.
74.Теорема о равнораспределении энергии по степеням свободы.
Среднее значение
энергии одной молекулы
![]() .
Если бы мы посчитали отдельно
.
Если бы мы посчитали отдельно
![]() ,
то получили бы величину ровно в три раза
меньшую, чем полная энергия. Такие же
значения и для
,
то получили бы величину ровно в три раза
меньшую, чем полная энергия. Такие же
значения и для
![]() .
.
Таким образом,
если вы молекула могла двигаться только
вдоль оси
,
ее средняя энергия была бы
![]() .
Говорят, что у молекулы, которая может
совершать только одномерные движения
– одна степень свободы:
.
Говорят, что у молекулы, которая может
совершать только одномерные движения
– одна степень свободы:
![]() .
Это значит. Что нужна только одна
переменная, чтобы описать движение
частицы. Для материальной точки таких
переменных нужно 3:
.
Это значит. Что нужна только одна
переменная, чтобы описать движение
частицы. Для материальной точки таких
переменных нужно 3:
![]() .
Если же молекула может еще и вращаться,
то число степеней свободы увеличивается.
Средняя энергия, приходящаяся на одну
степень свободы вращательного движения,
а также на одну колебательную степень
свободы (как потенциальной , так и
кинетической) равна
.
.
Если же молекула может еще и вращаться,
то число степеней свободы увеличивается.
Средняя энергия, приходящаяся на одну
степень свободы вращательного движения,
а также на одну колебательную степень
свободы (как потенциальной , так и
кинетической) равна
.
Теорема о равнораспределении энергии по степеням свободы: на все степени свободы статистической системы приходится одна и та же энергия . Это не относится к потенциальной энергии системы во внешних полях.
Средняя энергия
одной молекулы
![]() ,
где число степеней свободы
,
где число степеней свободы
![]() .
.
75.Расхождение теории теплоемкости идеального газа с экспериментом.
Н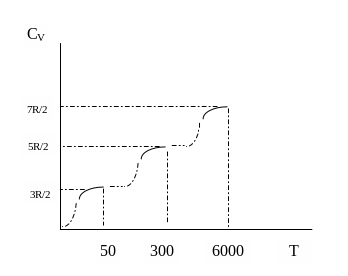 апример,
для некоторого количества идеального
газа:
апример,
для некоторого количества идеального
газа:
![]() ,
его молярная теплоемкость
,
его молярная теплоемкость
![]()
Для двух атомных
молекул всего может быть 3-поступательных,
2-вращательных, 1-колебательная степени
свободы. По расчетам для водорода
(идеального газа) теплоемкость не зависит
от температуры
![]() .
.
Зависимость
теплоемкости молекулярного водорода
от температуры, полученная в ходе
экспериментов, дается на графике (![]() ).
).
Молекула водорода ведет себя при низкой температуре как точечная частица, у которой отсутствуют внутренние движения, при нормальной температуре – как жесткая гантель и наряду с поступательным движением также совершает вращательные движения, а при очень высокой температуре к этим движениям добавляются также колебательные движения атомов, входящих в молекулу. Объяснить эту зависимость классической теории не удалось.
Отличие экспериментальной кривой от теоретической прямой имеет квантовое объяснение. При низких температурах вращательные и колебательные степени свободы «выключены», т.е. они не возбуждаются. При температурах 116К могут возбуждаться вращательные степени свободы, а при температурах 4100К возбуждаются и колебательные степени свободы. Однако переход от одного режима движения к другому происходит не скачком при определенной температуре, а постепенно в некотором интервале температур. Это объясняется тем, что при определенной температуре возникает лишь возможность перехода молекул в другой режим движения, но эта возможность не реализуется сразу всеми молекулами, а лишь их частью.
76.Статистика Ферми-Дирака (подсчет числа микросостояний, функция распределения).
Подсчет числа
состояний в статистике Ферми-Дирака.
Различаем уровни энергии и различные
состояния в пределах одной и той же
энергии. Число различных состояний в
пределах
-го
энергетического уровня
![]() ,
число этих состояний вообще различно
для различных энергетических уровней.
В этой модели частицы представляются
шариками, которые нужно разместить по
различным состояниям. Причем в модели
Бозе-Эйнштейна в каждом состоянии может
быть любое число шаров, а в модели
Ферми-Дирака в одном состоянии может
быть только один шар. Шары неразличимы
между собой. Обозначим число шаров
и проведем расчет числа возможных
размещений шаров для модели Ферми-Дирака.
,
число этих состояний вообще различно
для различных энергетических уровней.
В этой модели частицы представляются
шариками, которые нужно разместить по
различным состояниям. Причем в модели
Бозе-Эйнштейна в каждом состоянии может
быть любое число шаров, а в модели
Ферми-Дирака в одном состоянии может
быть только один шар. Шары неразличимы
между собой. Обозначим число шаров
и проведем расчет числа возможных
размещений шаров для модели Ферми-Дирака.
На каждом
энергетическом уровне может находиться
![]() частиц, причем
частиц, причем
![]() .
Полное число частиц на всех уровнях
равно
.
Полное число частиц на всех уровнях
равно
![]() .
Прежде всего найдем число способов,
сколькими
не различимых между собой предметов
могут быть размещены по
местам. Ответ дается формулой, которая
для рассматриваемых величин имеет вид:
.
Прежде всего найдем число способов,
сколькими
не различимых между собой предметов
могут быть размещены по
местам. Ответ дается формулой, которая
для рассматриваемых величин имеет вид:
![]() .
.
На каждом энергетическом уровне микросостояния независимы, и не играет роли, какие именно из частиц, находятся в каком именно состоянии, поэтому полное число состояний в совокупности всех энергетических уровней равно произведению числа микросостояний на каждом отдельном энергетическом уровне. - в произведении учитывает все возможные энергетические уровни.
![]() - число микросостояний
для модели Ферми-Дирака.
- число микросостояний
для модели Ферми-Дирака.
Удовлетворяя требование максимума числа микросостояний в равновесном состоянии, являющемся наиболее вероятным состоянием системы получаем формулу:
![]() - распределения
Ферми-Дирака, где
- распределения
Ферми-Дирака, где
![]() - число частиц, приходящихся на одно
квантовое состояние с энергией
- число частиц, приходящихся на одно
квантовое состояние с энергией
![]() .
Параметр
.
Параметр
![]() .
Параметр
определяется нормировкой на полное
число частиц, выражающей условие
сохранения числа частиц:
.
Параметр
определяется нормировкой на полное
число частиц, выражающей условие
сохранения числа частиц:
![]() .
.
При очень малых
значениях
экспоненциальный член в знаменателе
правой части должен быть значительно
больше единицы. Поэтому единицей в
знаменателе можно пренебречь и записать
распределение в виде
![]() ,
где
,
где
![]() .
Если теперь перейти к непрерывному
спектру, то получится экспоненциальное
распределение Максвелла-Больцмана.
.
Если теперь перейти к непрерывному
спектру, то получится экспоненциальное
распределение Максвелла-Больцмана.
Формулы статистики Ферми-Дирака переходят в формулы статистики Максвелла-Больцмана, когда среднее число частиц, приходящееся на одно квантовое состояние мало.
