
Поджелудочная железа.
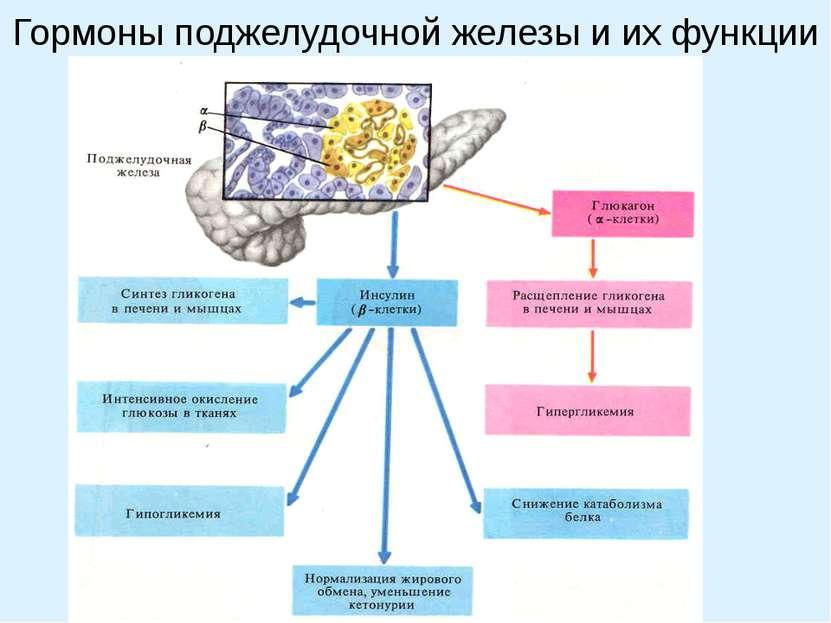
Расположена забрюшинно на уровне 12 грудного позвонка. Имеет головку, тело и хвост. Является сложной железой альвеолярно-трубчатого строения. Структурной единицей железы является ацинус, клетки которого продуцируют поджелудочный сок. Секрет железы отводится в дуоденум по протоку Вирсунга и добавочному протоку Санторини. Между ацинусами железы располагаются островки Лангерганса клетки которых выполняют эндокринную функцию. Островками вырабатываются инсулин, глюкогон, соматостатин. В островках вблизи 12 пк панкреатический полипептид. Между клетками островка имеются плотные и щелевые контакты, через которые осуществляется обмен низкомолекулярными веществами, при чем и между клетками различных популяций. Паракринные взаимоотношения между клетками островков: инсулин ингибирует активность альфа-клеток, глюкагон стимулирует бета и дельта клетки, соматостатин ингибирует активность альфа и бета клеток.
Гормон поджелудочной железы инсулин является белковым гормоном, состоит из 2 пептидных цепей. Синтезируется -клетками островков Лангерганса поджелудочной железы. Нормальная секреция инсулина включает 2 компонента:
-
Базальную (препятствующую катаболизму натощак);
-
Стимулированную приемом пищи.
Стимуляторы секреции инсулина: глюкоза, аминокислоты, свободные жирные кислоты, энтерогормоны, действие их усиливают ионы кальция, парасимпатическая нервная система. Гипергликемию вызывают глюкагон, катехоламины, глюкокортикоиды, СТГ, гипогликемию – инсулин. Главным стимулятором выброса инсулина является глюкоза, поступившая в организм в/в или в составе пищи. Гормон ЖКТ (гастрин, ХЦКП и т.д.) усиливает выброс инсулина на глюкозу. Белковая пища или смесь аминокислот стимулируется выделением инсулина и глюкогона. Ацетилхолин стимулирует, катехоламины тормозят секрецию инсулина.
Ингибиторы: соматостатин, простагландины, адреналин и инсулин; симпатическая нервная система. Гормональные антагонисты: глюкокортикоиды, тиреоидные гормоны, соматотропный гормон и соматостатин, глюкагон, катехоламины.
Биологическое действие инсулина
1. Ускорение трансмембранного транспорта в клетку глюкозы, аминокислот, свободных жирных кислот, ионов (К+, Мg2+, РО43+), нуклеотидов.
2. Активация синтеза ДНК, РНК.
3. Стимуляция синтеза белка, гликогена, липидов.
4. Антагонизм по отношению к катаболическим гормонам.
5. Торможение протеолиза, липолиза и кетогенеза, гликогенолиза, глюконеогенеза.
Рецептор инсулина имеет альфа субъединицу, содержащую инсулин-связывающий центр и в субъединицу трансмембранный белок, закрепляющий рецепторный комплекс в мембране.
Мембранные рецепторы к инсулину, связанные и провзаимодействовавшие с инсулином эндоцитозом проникают в клетку. В клетке инсулин распадается (период полураспада 30 мин), часть рецепторов повторно встраивается в мембрану.
Биологические эффекты инсулина во времени объединяются в 4 группы:
1. Очень быстрые (секунды): гиперполяризация мембраны и изменения транспорта глюкозы и ионов.
2. Быстрые (минуты): активация и ингибирование активности ферментов – преобладание анаболизма и торможение катаболизма.
3. Медленные (до часов): ускорение потребления субстратов и индукция или репрессия синтеза ферментов.
4. Самые медленные: митогенез и размножение клеток.
Очень быстрые эффекты инсулина на функцию плазматической мембраны.
1. Гиперполяризация мембраны.
2. Выход Н+, поступление Na+, повышение рН клетки.
3. Ингибирование Са2+ насоса и задержка в клетке Са2+.
4. Активация Na/К насоса (АТФ-аза) с увеличением поступления в клетку калия и удаления натрия.
5. Увеличение транспорта глюкозы. Увеличение транспорта глюкозы обусловлено мобилизацией имеющихся в клетке ее переносчиком. Под влиянием инсулина увеличивается число молекул глюкокиназы, ацетил КоА – карбоксилазы, синтазы жирных кислот, пируваткиназы и многих других.
Митотический эффект инсулина обусловлен через его опосредованное влияние на соматомедины и реализуется путем усиления синтеза ДНК и через неизвестный механизм переводом клетки в в фазу S митотического цикла.
Непосредственным стимулом для синтеза инсулина является поступление в бета-клетки ионов Са2+ независимо от инициирующего фактора. Отмечается две фазы секреции: а) в первые 2-5 мин после стимуляции отличается быстрое повышение, б) в дальнейшем секреция нарастает медленно и зависит от интенсивности синтеза белка.
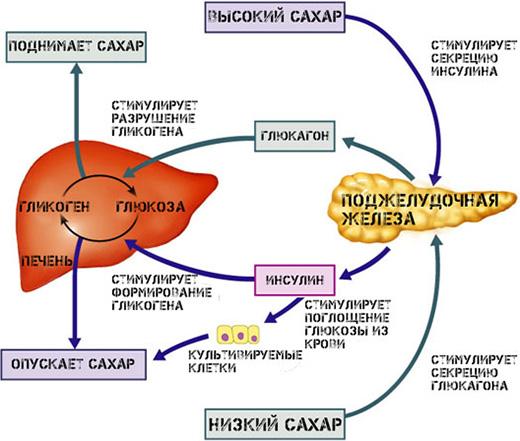
Суммарный результат различных метаболических эффектов инсулина сводится к понижению концентрации глюкозы в крови. Под влиянием инсулина активируется переносчик глюкозы мембран клеток и возрастает потребление глюкозы всеми клетками организма. В клетки печени глюкоза свободно проникает и свободно выходит при понижении ее концентрации в крови. Под влиянием инсулина в гепатоцитах активируются ферменты - глюкокиназа, фосфофруктокиназа, гликогенсинтетаза, что обеспечивает фосфорилирование глюкозы и ее полимеризацию в гликоген. Инсулин ингибирует также фосфорилазу - фермент, расщепляющий гликоген. При низкой концентрации глюкозы в крови и, следовательно, низкой секреции инсулина, фосфорилаза находится в активном состоянии, превращает гликоген в глюкозофосфат, который дефосфорилируется глюкозофосфатазой. Образовавшаяся глюкоза выходит в кровь. При нормальном питании 60% глюкозы, поступающей в организм с пищей, временно сохраняется в печени в виде гликогена. Мембрана мышечных клеток при низкой концентрации инсулина в крови непроницаема для глюкозы, клетка использует в качестве энергетического субстрата жирные кислоты. Инсулин активирует белок-переносчик глюкозы в мембране мышечной клетки и обеспечивает поступление глюкозы в миоцит. При отсутствии мышечной активности глюкоза в мышечной клетке превращается в гликоген, который в дальнейшем используется в качестве энергетического субстрата. Повышение функциональной активности мышц сопровождается увеличением проницаемости мембран миоцитов для глюкозы и при низком содержании в крови инсулина. Клетки центральной нервной системы высокие энергетические потребности почти целиком покрывают за счет глюкозы, причем ее потребление не зависит от инсулина. Поэтому снижение концентрации глюкозы в крови сопровождается гипогликемической комой с потерей сознания. Большинство других клеток организма отвечает на действие инсулина подобно мышечным клеткам. Под влиянием инсулина глюкоза в печени превращается не только в гликоген, но и в жирные кислоты, которые могут сохранятся в печени или транспортироваться кровью в жировую ткань. В жировой ткани, наряду с образованием жирных кислот, протекает процесс образования триглицеридов благодаря повышению под влиянием инсулина проницаемости мембран жировых клеток для глицерола. При низкой концентрации инсулина триглицериды расщепляются вновь до жирных кислот и глицерола. Это связано с тем, что инсулин ингибирует чувствительную к гормонам липазу и тем самым тормозит липолиз. При недостатке инсулина избыточные жирные кислоты накапливаются в печени, поэтому при сахарном диабете возможно, наряду с общим исхуданием, ожирение печени. Избыток жирных кислот приводит к образованию ацетилкоэнзима - А, который превращается в ацетоуксусную кислоту. Ацетоуксусная кислота превращается в -гидроксималяную кислоту, ацетон, вместе с которыми вызывает ацидоз при диабетической коме. Инсулин стимулирует синтез белка благодаря способности активировать транспорт в клетку аминокислот и повышать скорость транскрипции ДНК. Отсутствие инсулина приводит к истощению белковых ресурсов организма, аминокислоты в этом случае используются в качестве энергетического субстрата или в процессе глюконеогенеза. Инсулин для растущего организма имеет такое же значение, как и гормон роста. Избыток инсулина активирует липопротеин липазу (ЛПЛ), возрастает поглощение СЖК из ЛПОНП, содержащихся в крови. Стимулируется транспорт глюкозы и ускоряется глюконеогенез. Возрастает превращение глюкозо-6-фосфата по всем метаболическим путям: окисление в СО2 , синтез жирных кислот и окисление по пентозофосфатному пути, поставляющему восстановленные эквиваленты для липогенеза в форме НАДФН. Избыток инсулина стимулирует анаболические процессы: синтез глюкогона, жирных кислот, белка, триацил глицеролов. Повышенное количество антагонистов усиливают катаболические процессы: гидролиз триацилглицеролов, окисление жирных кислот, кетогенез, протеониз, гликогенолиз. Метаболические процессы в жировой ткани, в мышцах и печени контролируются инсулином и его антагонистами: глюкогоном, катехоламинами, СТГ, глюкокортикоидами.
Диабет (инсулиновая недостаточность). Главные симптомы - повышение концентрации глюкозы в крови (гипергликемия), выделение глюкозы с мочой (глюкозурия), полиурия (увеличенный диурез), физическая и психическая астения (слабость). Выделяют два типа: I инсулинзависимый, ювенильный, склонный к кетозу и II типа – инсулиннезависимый. При II типе концентрация инсулина в крови близка к нормальной и возрастает при нагрузке глюкозой.
Этиология – комбинация генетической предрасположенности с многочисленными факторами: инфекция, вирусы, химические вещества, аутоиммунные процессы и т.д.
Дефицит инсулина нарушает все виды пластические, энергетического, водно-солевого обмена, страдают практически все функциональные системы.
Первичным фактором патогенеза является относительная недостаточность инсулина, приводящая к ацидозу, снижению утилизации глюкозы мышечной и жировой тканью на сроке гипергликемии, полиурии, полидипсии. Снижение МЦК, гиповолемия. Аноксия тканей стимулирует анаэробный гликолиз – молочная кислота – ацидоз Шок, кома, смерть.
Влияние дефицита инсулина на углеводный обмен
|
Дефицит инсулина |
|
|
Недостаточность периферического кровообращения |
Снижение утилизации глюкозы тканями |
|
Гипотензия |
Гликогенолиз в печени и мышцах |
|
Снижение почечного кровотока |
Гипергликемия |
|
Анурия |
Глюкозурия и осмотический диурез |
|
Кома и смерть |
Потеря воды и солей |
|
|
Дегидратация |
|
|
Гемоконцентрация |
Обмен жиров при сахарном диабете.
Относительная недостаточность инсулина приводит к снижению утилизации глюкозы жировой тканью и к значительному опустошению жировых депо. Развивается вторичная гиперглицеридемия, т.к. в печени из СЖК синтезируются гликопротеины ЛОНП. Липиды окисляются до стадии ацетил-Ко А. Затем двухуглеродные фрагменты образуют ацетоуксусную и ß-окисмасляную кислоты, концентрация которых в крови возрастает.
Обмен веществ при диабете. Вследствие инсулиновой недостаточности в обмене веществ преобладают процессы катаболизма, быстрое нарастание которых ведет к кетоацидозу (закислению внутренней среды организма в связи с накоплением кетоновых тел). Синдром инсулиновой недостаточности сопровождается нарушением обмена углеводов, белков и жиров. Поглощение глюкозы (мышцами, жировой тканью) снижается, что сопровождается гипергликемией и глюкозурией. Глюконеогенез усиливается из глицерола, аминокислот и лактата. Поглощение аминокислот и синтез белка снижаются, наблюдается отрицательный азотистый баланс, возрастает протеолиз. В результате увеличения липолиза в плазме увеличивается концентрация свободных жирных кислот, кетоновых тел, развивается ацидоз, происходит потеря сознания.
Образуется большое количество альфа-глицерол-фосфата, необходимого для синтеза триацил глицеролов, в котором используются жирные кислоты, как поступающие из ЛПОНП, так и новообразующиеся в клетке. Одновременно с запасами триацил глицеролов их гидролиз гормон-чувствительной липазой ингибируется инсулином. Происходит их накопление в клетке.
Под влиянием антагонистов инсулина гормон-чувствительная липаза переходит в активную, фосфорилируемую форму, запасание триацил глицеролов тормозится, а гидролиз ускоряется. Синтез инсулина стимулируется глюкоза, манноза, лейцин, гормон роста и глюкагон, тормозит адреналин. Синтез снижается при голодании, низком содержании углеводов в пище, высоком содержании жиров. Увеличивается при беременности (плацентарный соматомаммотропин) и избытке продукции соматотропного гормона.
Глюкагон. Повышает концентрацию глюкозы в крови путем мобилизации гликогена печени. Вырабатывается А-клетками поджелудочной железы, из кишечника выделяют вещества с глюкагоноподобным действием (энтероглюкагон). Полипептид с ОММ 3485 Да, натощак уровень его в крови равняется 30-430 пМ/л. Разрушается в печени, стимулом для секреции является гипогликемия (гормон голода).
Биологическое действие:
-
Активирует глюкогенолиз и глюконеогенез;
-
Активирует липолиз и освобождение триглицеридов из депо;
-
Стимулирует секрецию СТГ, адреналина и кальцитонина;
-
Тормозит перистальтику ЖКТ, базовую и стимулированную секрецию кислоты и пепсина в желудке;
-
Тормозит секрецию поджелудочной железы;
-
Оказывает положительное инотропное действие на миокард.
