
- •1.Предмет оптика. Основные законы. Явление полного внутреннего отражения
- •2.Развитие взглядов на природу света. Корпускулярно-волновой дуализм света.
- •3.Интерференция световых волн. Когерентность. Усл. Max и min при интерференции света.
- •5.Способы получения когерентных источников
- •18.2.1. Опыт Юнга
- •18.2.2. Зеркала Френеля
- •18.2.3. Бипризма Френеля
- •6.Интерференция в тонких пленках. Полосы равного наклона и равной толщины.
- •7. Применение интерференции света. Интерферометры Просветление оптики.
- •8. Принцип Гюйгенса — Френеля. Дифракция Френеля и Фраунгофера Если λ - длина волны, b - размеры препятствия, l - расстояние от препятствия до точки наблюдения, то различают следующие ситуации:
- •9.Метод зон Френеля. Прямолинейноe распространение света
- •1 0. Дифракция Френеля на отверстии и диске
- •11. Дифракция Фраунгофера на одной щели
- •12. Дифракционная решетка
- •13. Поляризация света. Естественный и поляризованный свет. Закон Малюса.
- •14. Двойное лучепреломление
- •15 Призма Николя
- •17.Вращение плоскости поляризации
- •18 Тепловое излучение. Равновесность ти
- •19 Характеристики теплового излучения
- •20.Закон Кирхгофа. Абсолютно черное тело
- •21.Распределение энергии в спектре а.Ч.Т. Законы излучения а.Ч.Т.
- •22.Объяснение распределения излучательной способности по длинам волн (частот)
- •23.Квантовая гипотеза. Формула Планка для теплового излучения
- •26. Масса и импульс фотона. Эффект Комптона
- •27. Давление света. Опыт Лебедева
- •28 Корпускулярно-волновой дуализм
- •29.Открытие электрона. Модель атома томсона
- •30.Опыты резерфорда. Ядерная модель атома и ее недостатки
- •31.Закономерности в атомных спектрах. Спектральные серии излучения атома н. Эмпирическая формула Бальмера
- •32.Постулаты Бора. Опыты Франка и Герца
- •34.Полная энергия электрона в атоме. Вывод формулы Бальмера-Ридберга
- •35,Успехи и недостатки теории Бора. Корпускулярно-волновой дуализм вещества. Формула Де-Бройля
- •37.Волновая функция и ее физический смысл.
- •39.Квантовая механика. Уравнение Шредингера
- •40.Движение свободной частицы
- •41.Частица в одномерной прямоугольной «потенциальной яме» с бесконечно высокими «стенками»
- •42.Прохождение частицы сквозь потенциальный барьер.
- •43.Линейный гармонический осциллятор в квантовой механике.
- •44.Атом водорода по теории шредингера. Квантовые числа.
- •45. Основное(1s-) состояние электрона в атоме водорода
- •46. Опыт Штерна и Герлаха. Спин электрона.
- •47. Принцип Паули. Распределение электронов в атоме по состояниям
- •48.Периодическая система элементов Менделеева
- •49. Общие сведения о ядрах. Ядерные силы. Модели ядра
- •50.Дефект массы и энергия связи ядра
- •51.Естественная радиоактивность.Закон радиоактивного распада. Правила смещения.
- •52.Методы наблюдения и регистрации радиоактивных излучений и частиц
- •53. Ядерные реакции. Законы сохранения в ядерных реакциях
- •54. Цепная Ядерная Реакция. Ядерный реактор
- •55.Реакция синтеза атомных ядер.
45. Основное(1s-) состояние электрона в атоме водорода
1s-Состояние электрона в атоме водорода является сферически-симметричным, т. е. не зависит от углов и . Волновая функция ф электрона в этом состоянии определяется только расстоянием r электрона от ядра, т. е.
=
Y100(r),
где цифры в индексе соответственно
указывают, что n
= 1, l
= 0
и ml
= 0.
Уравнению Шредингера для 1s-состояния
электрона в атоме водорода удовлетворяет
функция вида![]() (224.1)
(224.1)
где, как можно показать, а = h240/(me2) — величина, совпадающая с первым боровским радиусом а (см. (212.2)) для атома водорода, С — некоторая постоянная, определяемая из условия нормировки вероятностей (216.3).
Благодаря сферической симметрии Y-функции вероятность обнаружения электрона на расстоянии r одинакова по всем направлениям. Поэтому элемент объема dV, отвечающий одинаковой плотности вероятности, обычно представляют в виде объема сферического слоя радиусом r и толщиной dr. dV = 4r2dr. Тогда, согласно условию нормировки вероятностей (216.3) с учетом (224.1),

После
интегрирования получим
![]() (224.2)
(224.2)
Подставив выражение (224.2) в формулу (224.1), определим нормированную волновую функцию, отвечающую 1s-состоянию электрона в атоме водорода:
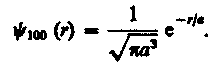 (224.3)
(224.3)
Вероятность обнаружить электрон в элементе объема (см. (216.2)) равна
![]()
Подставив
в эту формулу волновую функцию (224.3),
получим

Вычислим
те расстояния rmax
от ядра, на
которых электрон может быть обнаружен
с наибольшей вероятностью. Исследуя
выражение dW/dr
на максимум,
получим, что rmax
= а. Следовательно, электрон может быть
обнаружен с наибольшей вероятностью
на расстояниях, равных боровскому
радиусу, т. е. имеется равная и наибольшая
вероятность обнаружения электрона во
всех точках, расположенных на сферах
радиуса а с
центром в
ядре атома. Казалось бы, квантово-механический
расчет дает полное согласие с теорией
Бора. Однако, согласно к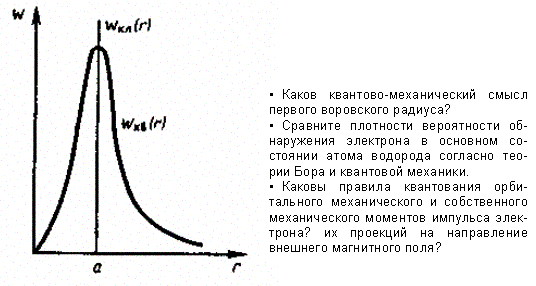 вантовой
механике, плотность вероятности лишь
при r
= а достигает
максимума, оставаясь отличной от нуля
во всем пространстве (рис. 305).
вантовой
механике, плотность вероятности лишь
при r
= а достигает
максимума, оставаясь отличной от нуля
во всем пространстве (рис. 305).
Рис. 305
Таким образом, в основном состоянии атома водорода наиболее вероятным расстоянием от электрона до ядра является расстояние, равное боровскому радиусу. В этом заключается квантово-механический смысл боровского радиуса.
46. Опыт Штерна и Герлаха. Спин электрона.
О. Штерн и В. Герлах, проводя прямые измерения магнитных моментов, обнаружили в 1922 г., что узкий пучок атомов водорода, заведомо находящихся в s-состоянии, в неоднородном магнитном поле расщепляется на два пучка. В этом состоянии момент импульса электрона равен нулю (см. (223.4)). Магнитный момент атома, связанный с орбитальным движением электрона, пропорционален механическому моменту (см. (131.3)), поэтому он равен нулю и магнитное поле не должно оказывать влияния на движение атомов водорода в основном состоянии, т. е. расщепления быть не должно. Однако в дальнейшем при применении спектральных приборов с большой разрешающей способностью было доказано, что спектральные линии атома водорода обнаруживают тонкую структуру (являются дублетами) даже в отсутствие магнитного поля.
Для объяснения тонкой структуры спектральных линий, а также ряда других трудностей в атомной физике американские физики Д. Уленбек (1900—1974) и С. Гаудсмит (1902—1979) предположили, что электрон обладает собственным неуничтожимым механическим моментом импульса, не связанным с движением электрона в пространстве, спином (см. §131).
Спин электрона (и всех других микрочастиц) — квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) Ls, то ему соответствует собственный магнитный момент рms. Согласно общим выводам квантовой механики, спин квантуется по закону
![]() где s — спиновое
квантовое число.
где s — спиновое
квантовое число.
По аналогии с орбитальным моментом импульса, проекция Lsz спина квантуется так, что вектор Ls может принимать 2s+1 ориентации. Так как в опытах Штерна и Герлаха наблюдались только две ориентации, то 2s+1=2, откуда s= ½ . Проекция спина на направление внешнего магнитного поля, являясь квантованной величиной, определяется выражением, аналогичным (223.6):
![]() где тs — магнитное
спиновое квантовое число;
оно может иметь только два значения: ms =
± ½ .
где тs — магнитное
спиновое квантовое число;
оно может иметь только два значения: ms =
± ½ .
Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
