- •1.Предмет оптика. Основные законы. Явление полного внутреннего отражения
- •2.Развитие взглядов на природу света. Корпускулярно-волновой дуализм света.
- •3.Интерференция световых волн. Когерентность. Усл. Max и min при интерференции света.
- •5.Способы получения когерентных источников
- •18.2.1. Опыт Юнга
- •18.2.2. Зеркала Френеля
- •18.2.3. Бипризма Френеля
- •6.Интерференция в тонких пленках. Полосы равного наклона и равной толщины.
- •7. Применение интерференции света. Интерферометры Просветление оптики.
- •8. Принцип Гюйгенса — Френеля. Дифракция Френеля и Фраунгофера Если λ - длина волны, b - размеры препятствия, l - расстояние от препятствия до точки наблюдения, то различают следующие ситуации:
- •9.Метод зон Френеля. Прямолинейноe распространение света
- •1 0. Дифракция Френеля на отверстии и диске
- •11. Дифракция Фраунгофера на одной щели
- •12. Дифракционная решетка
- •13. Поляризация света. Естественный и поляризованный свет. Закон Малюса.
- •14. Двойное лучепреломление
- •15 Призма Николя
- •17.Вращение плоскости поляризации
- •18 Тепловое излучение. Равновесность ти
- •19 Характеристики теплового излучения
- •20.Закон Кирхгофа. Абсолютно черное тело
- •21.Распределение энергии в спектре а.Ч.Т. Законы излучения а.Ч.Т.
- •22.Объяснение распределения излучательной способности по длинам волн (частот)
- •23.Квантовая гипотеза. Формула Планка для теплового излучения
- •26. Масса и импульс фотона. Эффект Комптона
- •27. Давление света. Опыт Лебедева
- •28 Корпускулярно-волновой дуализм
- •29.Открытие электрона. Модель атома томсона
- •30.Опыты резерфорда. Ядерная модель атома и ее недостатки
- •31.Закономерности в атомных спектрах. Спектральные серии излучения атома н. Эмпирическая формула Бальмера
- •32.Постулаты Бора. Опыты Франка и Герца
- •34.Полная энергия электрона в атоме. Вывод формулы Бальмера-Ридберга
- •35,Успехи и недостатки теории Бора. Корпускулярно-волновой дуализм вещества. Формула Де-Бройля
- •37.Волновая функция и ее физический смысл.
- •39.Квантовая механика. Уравнение Шредингера
- •40.Движение свободной частицы
- •41.Частица в одномерной прямоугольной «потенциальной яме» с бесконечно высокими «стенками»
- •42.Прохождение частицы сквозь потенциальный барьер.
- •43.Линейный гармонический осциллятор в квантовой механике.
- •44.Атом водорода по теории шредингера. Квантовые числа.
- •45. Основное(1s-) состояние электрона в атоме водорода
- •46. Опыт Штерна и Герлаха. Спин электрона.
- •47. Принцип Паули. Распределение электронов в атоме по состояниям
- •48.Периодическая система элементов Менделеева
- •49. Общие сведения о ядрах. Ядерные силы. Модели ядра
- •50.Дефект массы и энергия связи ядра
- •51.Естественная радиоактивность.Закон радиоактивного распада. Правила смещения.
- •52.Методы наблюдения и регистрации радиоактивных излучений и частиц
- •53. Ядерные реакции. Законы сохранения в ядерных реакциях
- •54. Цепная Ядерная Реакция. Ядерный реактор
- •55.Реакция синтеза атомных ядер.
29.Открытие электрона. Модель атома томсона
Первые экспериментальные результаты, из которых можно было сделать вывод о сложной структуре атомов электрических зарядов, были получены м. Фарадеем в 1833г. при изучении законов электролиза.
В 1897г. Дж. Дж. Томсон в результате экспериментов по изучению электрического заряда в разреженных газах, фотоэффекта и термоэлектронной эмиссии установил, что при соударениях атомов в плазме электрического заряда, при нагревании вещества или освещении его ультрафиолетовым светом из атомов любого химического элемента вырываются одинаковые отрицательно заряженные частицы. Эти частицы были названы электронами. Электрический заряд e отдельных электронов впервые был измерен в опытах Р. Милликена в 1909г. Он оказался действительно одинаковым у всех электронов.
Масса электрона примерно в 2000 раз меньше массы самого легкого из атомов – атома водорода. Открытие электрона и обнаружение электронов в составе атомов любого химического элемента было первым доказательством сложности атомов.
Условное обозначение электрона:
![]() -
отрицательно заряженная элементарная
частица
- обладает наименьшим в
природе зарядом = 1э.э.з. = 1,6 х 10-19 Кл
-
масса электрона по сравнению с протоном
ничтожнао мала и составляет 9,1 х 10-28 г
-
электрон стабилен
-
отрицательно заряженная элементарная
частица
- обладает наименьшим в
природе зарядом = 1э.э.з. = 1,6 х 10-19 Кл
-
масса электрона по сравнению с протоном
ничтожнао мала и составляет 9,1 х 10-28 г
-
электрон стабилен
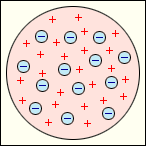
модель Томсона. (Образное название модели Томсона: «Булка с изюмом»)
Первая попытка создания модели атома на основе накопленных экспериментальных данных принадлежит Дж. Дж.Томсону (1903 г.).
Первое, на что он обратил внимание: масса электронов составляется незначительную часть, приблизительно 10-4 массы атома. Следовательно, практически вся масса атома принадлежит положительному заряду. Томсон
считал, что атом представляет собой
электронейтральную систему шарообразной
формы радиусом примерно равным |
|
Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.
30.Опыты резерфорда. Ядерная модель атома и ее недостатки
Резерфорд и его сотрудники наблюдали прохождение α-частиц через тонкую золотую фольгу. Скорость α-частиц 107 м/с.
Экспериментальная установка позволяла наблюдать α-частицы, отклоненные золотой фольгой под разными углами.
В то время было известно, что α-частица имеет положительный заряд, равный +2е.
Опыт осуществлялся по схеме, изображенной на рис. 6.3.
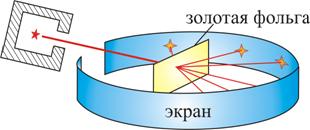
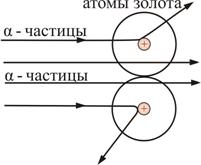
Рис. 6.3
Узкий пучок α-частиц испускался радиоактивным веществом и попадал на фольгу. Проходя через фольгу α-частицы отклонялись на различные углы. Рассеянные частицы ударялись об экран, покрытый ZnS, и вызываемые им вспышки света, сцинцилляции, наблюдались в микроскопе. Микроскоп и связанный с ним экран можно было вращать вокруг оси, проходящей через центр фольги. Т.е. можно было всегда измерить угол отклонения. Весь прибор помещался в вакуум, чтобы α-частицы не рассеивались при столкновении с молекулами воздуха.
В опыте обнаружилось, что некоторые α-частицы отклонялись на большие углы, до 180º. Резерфорд понял, что такое отклонение возможно лишь при встрече с положительно заряженной частицей большей массы. А малая вероятность отклонения на большие углы говорила, что эта положительная частица имеет малые размеры, порядка 10–14 м. Электроны, по мнению Резерфорда, движутся вокруг ядра.
Для простоты предположим, что электрон движется вокруг ядра по круговой орбите радиуса r. При этом кулоновская сила взаимодействия между ядром и электроном сообщает электрону центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид
![]() (208.1)
(208.1)
где т, и v — масса и скорость электрона на орбите радиуса r, 0 — электрическая постоянная.
Однако такая модель была в явном противоречии с классической электродинамикой, т.к. электрон, двигаясь по окружности, т.е. с нормальным ускорением, должен был излучать энергию, следовательно, замедлять скорость и падать на ядро. Таким образом, применение классической электродинамики к ядерной модели атома привело к полному противоречию с экспериментальными фактами.
Согласно классической теории, должны иметь место:
· непрерывная потеря электроном энергии в виде излучения электромагнитных волн и неустойчивость атома;
· существование только непрерывного спектра спектральных линий не должно быть.
В действительности оказывается, что:
· атом является устойчивой системой;
· атом излучает энергию лишь при определенных условиях;
· излучение атома имеет линейчатый спектр, связанный со строением и свойствами его электронной оболочки.
Размеры ядер можно определить, используя дифракционное рассеяние при высоких энергиях, а также упругое рассеяние электронов или поглощение нейтронов.
Оказалось, что радиус ядра R » (10-14 – 10-15) м и зависит от числа нуклонов в ядре рис. 6.4
Если
электрон, ускоренный разностью
потенциалов U «нацелен»
в край ядра, имеющего заряд Zeи
радиус R,то,
согласно классической механике, его
угол отклонения определяется соотношением
![]()
 .
.
 рис.6.6
рис.6.6
Рис. 6.4 Рис. 6.5
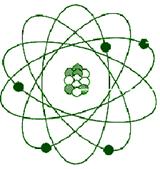
На рис. 6.5 изображена компьютерная модель процесса рассеяния электронов на ядре
рис.6,6 Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов
. Таким образом, атом Резерфорда оказывается неустойчивой системой, что опять-таки противоречит действительности