
- •Модуль 2. Загальні закономірності метаболізму. Метаболізм вуглеводів, ліпідів, амінокислот та його регуляція. Перелік питань та відповіді для підсумкового модульного контролю.
- •1. Біохімічні компоненти клітини, їх біохімічні функції. Класи біомолекул. Ієрархія біомолекул, їх походження.
- •2. Ферменти: визначення; властивості ферментів як біологічних каталізаторів.
- •3. Класифікація та номенклатура ферментів, характеристика окремих класів ферментів.
- •4. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центри.
- •5. Кофактори та коферменти. Будова та властивості коферментів; вітаміни як попередники в біосинтезі коферментів.
- •6. Коферменти: типи реакцій, які каталізують окремі класи коферментів.
- •7. Вітамін в1 (тіамін): будова, біологічні властивості, механізм дії.
- •8. Вітамін в2 (рибофлавін): будова, біологічні властивості, механізм дії.
- •9. Вітамін рр (нікотинова кислота, нікотинамід): будова, біологічні властивості, механізм дії.
- •10. Вітамін в6 (піридоксин): будова, біологічні властивості, механізм дії.
- •11. Вітамін в12 (кобаламін): біологічні властивості, механізм дії.
- •12. Вітамін Вс (фолієва кислота): біологічні властивості, механізм дії.
- •13. Вітамін н (біотин): біологічні властивості, механізм дії.
- •14. Вітамін в3 (пантотенова кислота): біологічні властивості, механізм дії.
- •15. Вітамін с (аскорбінова кислота): будова, біологічні властивості, механізм дії.
- •16. Вітамін р (флавоноїди): будова, біологічні властивості, механізм дії.
- •17. Ізоферменти, особливості будови та функціонування, значення в діагностиці захворювань.
- •18. Механізми дії та кінетика ферментативних реакцій: залежність швидкості реакції від концентрації субстрату, рН та температури.
- •19. Активатори та інгібітори ферментів: приклади та механізми дії.
- •20. Типи інгібування ферментів: зворотнє (конкурентне, неконкурентне) та незворотнє інгібування.
- •21. Регуляція ферментативних процесів. Шляхи та механізми регуляції: алостеричні ферменти; ковалентна модифікація ферментів.
- •22. Циклічні нуклеотиди (цАмф, цГмф) як регулятори ферментативних реакцій та біологічних функцій клітини.
- •23. Ензимопатії – уроджені (спадкові) вади метаболізму вуглеводів, амінокислот, порфіринів, пуринів.
- •3. Глікогенози:
- •4. Непереносність дисахаридів
- •1. Еритропоетичні порфірїі:
- •24. Ензимодіагностика патологічних процесів та захворювань.
- •25. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в медицині.
- •26. Принципи та методи виявлення ферментів у біооб'єктах. Одиниці виміру активності та кількості ферментів.
- •27. Обмін речовин (метаболізм) - загальні закономірності протікання катаболічних та анаболічних процесів.
- •28. Спільні стадії внутрішньоклітинного катаболізму біомолекул: білків, вуглеводів, ліпідів.
- •29. Цикл трикарбонових кислот. Локалізація, послідовність ферментативних реакцій, значення в обміні речовин.
- •30. Енергетичний баланс циклу трикарбонових кислот. Фізіологічне значення реакцій цтк. Значение о6щих путей катаболизма в энерrетическом обмене.
- •31. Реакції біологічного окислення; типи реакцій (дегідрогеназні, оксидазні, оксигеназні) та їх біологічне значення. Тканинне дихання.
- •32. Ферменти біологічного окислення в мітохондріях: піридин-, флавін-залежні дегідрогенази, цитохроми.
- •33. Послідовність компонентів дихального ланцюга мітохондрій. Молекулярні комплекси внутрішніх мембран мітохондрій.
- •34. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання.
- •35. Хеміосмотична теорія окисного фосфорилювання, атф-синтетаза мітохондрій.
- •36. Інгібітори транспорту електронів та роз’єднувачі окисного фосфорилювання.
- •37. Мікросомальне окислення: цитохром р-450; молекулярна організація ланцюга переносу електронів.
- •38. Анаеробне окислення глюкози. Послідовність реакцій та ферменти гліколізу.
- •39. Аеробне окислення глюкози. Етапи перетворення глюкози до со2 і н2о.
- •40. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі.
- •4*. Гліколітична оксидоредукція: субстратне фосфорилювання та човникові механізми окислення гліколітичного надн.
- •41. Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера.
- •42. Фосфоролітичний шлях розщеплення глікогену в печінці та м'язах. Регуляція активності глікогенфосфорилази.
- •43. Біосинтез глікогену: ферментативні реакції, фізіологічне значення. Регуляція активності глікогенсинтази.
- •44. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок каскадного цАмф-залежного фосфорилювання ферментних білків.
- •45. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну глікогену в м'язах та печінці.
- •46. Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози).
- •47. Глюконеогенез: субстрати, ферменти та фізіологічне значення процесу.
- •48. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикли.
- •49. Глюкоза крові (глюкоземія): нормоглікемія, гіпо- та гіперглікемії, глюкозурія. Цукровий діабет - патологія обміну глюкози.
- •50. Гормональна регуляція концентрації та обміну глюкози крові.
- •51. Пентозофосфатний шлях окислення глюкози: схема процесу та біологічне значення.
- •52. Метаболічні шляхи перетворення фруктози та галактози; спадкові ензимопатії їх обміну.
- •53. Катаболізм триацилгліцеролів в адипоцитах жирової тканини: послідовність реакцій, механізми регуляції активності тригліцеридліпази.
- •54. Нейрогуморальна регуляція ліполізу за участю адреналіну, норадреналіну, глюкагону та інсуліну).
- •59. Біосинтез вищих жирних кислот: реакції біосинтезу насичених жирних кислот (пальмітату) та регуляція процесу.
- •60. Біосинтез моно- та поліненасичених жирних кислот в організмі людини.
- •61. Біосинтез триацилгліцеролів та фосфогліцеридів.
- •62. Метаболізм сфінголіпідів. Генетичні аномалії обміну сфінголіпідів-сфінголіпідози.
- •63. Біосинтез холестеролу: схема реакцій, регуляція синтезу холестеролу.
- •64. Шляхи біотрансформації холестерину: етерифікація; утворення жовчних кислот, стероїдних гормонів, вітаміну d3.
- •65. Циркуляторний транспорт та депонування ліпідів у жировій тканині. Ліпопротеїнліпаза ендотелію.
- •66. Ліпопротеїни плазми крові: ліпідний та білковий (апопротеїни) склад. Гіпер-
- •67. Патології ліпідного обміну: атеросклероз, ожиріння, цукровий діабет.
- •68. Пул вільних амінокислот в організмі: шляхи надходження та використання вільних амінокислот в тканинах.
- •69. Трансамінування амінокислот: реакції та їх біохімічне значення, механізми дії амінотрансфераз.
- •70. Пряме та непряме дезамінування вільних l-амінокислот в тканинах.
- •71. Декарбоксилювання l -амінокислот в організмі людини. Фізіологічне значення утворених продуктів. Окислення біогенних амінів.
- •72. Шляхи утворення та знешкодження аміаку в організмі.
- •73. Біосинтез сечовини: послідовність ферментних реакцій біосинтезу, генетичні
- •74. Загальні шляхи метаболізму вуглецевих скелетів амінокислот в організмі людини. Глюкогенні та кетогенні амінокислоти.
- •75. Біосинтез та біологічна роль креатину і креатинфосфату.
- •76. Глутатіон: будова, біосинтез та біологічні функції глутатіону
- •77. Спеціалізовані шляхи метаболізму циклічних амінокислот - фенілаланіну, та тирозину.
- •78. Спадкові ензимопатії обміну циклічних амінокислот - фенілаланіну та тирозину.
- •79. Метаболізм порфіринів: будова гему; схема реакцій біосинтезу протопорфірину IX та гему.
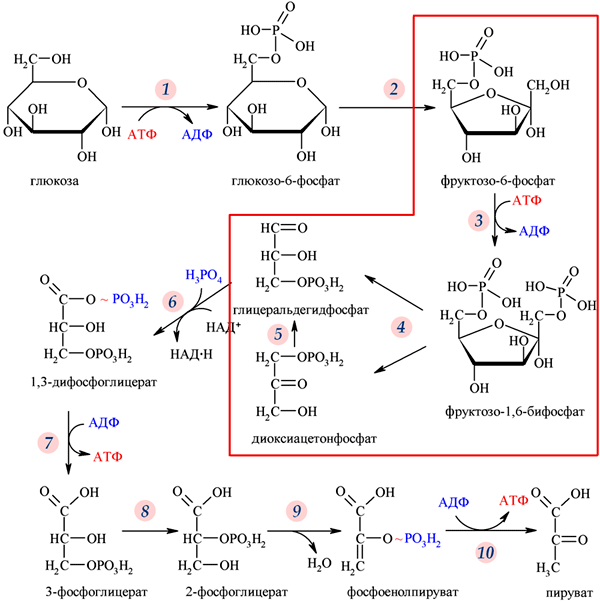
39. Аеробне окислення глюкози. Етапи перетворення глюкози до со2 і н2о.
Для більшості тканин людини та вищих тварин в умовах нормальної життєдіяльності характерний аеробний гліколіз, тобто утворення з глюкози пірувату, який у подальшому окислюється до вуглекислого газу й води. Анаеробний гліколіз має місце переважно в м`язах при інтенсивній фізичній діяльності, тобто при відносній кисневій недостатності, та в деяких високоспеціалізованих клітинах (зокрема, в еритроцитах, в яких відсутні мітохондрії) або за певних патологічних умов (клітини злоякісних пухлин). Реакції гліколізу перебігаютьу цитозолі клітини і каталізуються ферментами, що локалізовані в цьому компартменті. Виділяють дві стадії гліколізу: 1. Розщеплення молекули глюкози до двох молекул фосфотріоз (гліцеральдегід-3-фосфату та діоксіацетонфосфату). Ця стадія включає в себе послідовність реакцій, які потребують витрати двох молекул АТФ на кожну молекулу глюкози, що розщеплюється. 2. Перетворення двох молекул фосфотріоз на дві молекули пірувату (або лактату). Ця стадія включає в себе окислювально-відновлювальні реакції ("гліколі-тична оксидоредукція"), які супроводжуються генерацією чотирьох молекул АТР. Таким чином, у результаті розщеплення однієї молекули глюкози в реакціях аеробного або анаеробного гліколізу сумарний вихід АТР складає дві молекули, що можна подати таким рівнянням: D-глюкоза + 2 АДФ + 2 Фн ? 2 піруват (лактат) + 2 АТФ
40. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі.
Окислювальне декарбоксилювання пірувату каталізується піруватдегідрогеназним комплексом — мультиферментною системою, яка в клітинах еукаріотів міститься в мембранах мітохондрій, а у прокаріотів — у цитоплазмі. До складу цього комплексу входять три ферменти, що каталізують три послідовні стадії перетворення пірувату на ацетил-КоА: • піруватдегідрогеназу [КФ 1.2.4.1]; • дигідроліпоїлацетилтрансферазу [КФ 2.3.1.12]; • дигідроліпоїлдегідрогеназу [КФ 1.8.1.4] і п'ять коферментів і простетичних груп: • тіаміндифосфат (ТДФ, або ТПФ); • ліпоєву кислоту(ЛК); • КоА; • ФАД; • НАД+ У результаті цього процесу утворюється ацетилкоензим А — основний субстрат окислення в циклі трикарбонових кислот — та відновлена форма НАД+. Сумарне рівняння окислювального декарбоксилювання пірувату: CH-CO-COOH + НАД+ + КоА-SH -> CH-CO-КоА + НАДН + Н+ + С02 Ферментативні стадії утворення ацетил-КоА з пірувату: Стадія I (декарбоксилювання)— каталізується піруватдегідрогеназою (Е1), коферментом якої є ТДФ. На цій стадії відбувається взаємодія пірувату з С-2 тіазольного кільця молекули тіаміну; в результаті реакції утворюється зв’язаний із ферментом гідроксиетильний похідний тіаміндифосфату: Стадія II— каталізується центральним ферментом комплексу дигідроліпоїлацетилтрансферазою (E2), яка переносить гідроксиетильну групу від ТДФ(Е1) на простетичну групу ферменту E2, що є окисленою формою ліпоєвої кислоти (ЛК); в результаті реакції утворюється ацетилтіоефір відновлених ліпоїльних груп ферменту E2, що містить макроергічний зв’язок: Стадія ІІІ— дигідроліпоїлацетилтрансфераза переносить ацетильну групу від відновленої ліпоєвої кислоти на коензим А: Стадія IV — окислення відновленої форми ферменту Е2 ФАД-залежною дигідроліпоїлдегідрогеназою (E3): Стадія V — перенесення атомів водню від відновленої ФАД-групи дигідроліпоїлдегідрогенази на НАД+ з утворенням НАДН: Відновлений НАДН, що утворюється в результаті окислювального декарбоксилювання пірувату, в аеробних умовах окислюється в мітохондріальному електронотранспортному ланцюзі з генерацією шести (2x3) молекул АТФ. Біологічна роль окиснювального декарбоксилювання пірувату полягає: 1) в катаболізмі пірувату до одного з кінцевих продуктів - С02 (виводиться з організму або використовується для синтезу), 2) в утворенні макроергічної сполуки - ацетил-Ко А (піддається подальшому окисненню в циклі трикарбонових кислот або використовується в реакціях анаболізму); 3) в синтезі відновленого еквіваленту - НАДН, який окиснюється в дихальному ланцюгу мітохондрій. Реакції окиснювального декарбоксилювання пірувату регулюються в організмі на рівні піруватдегідрогенази: 1) алостерично (надлишок продуктів реакції ацетил-КоА НАДН інгібує фермент, а проміжний продукт гліколізу фруктозо-1,6-дифосфат, НАД+, КоА - є активаторами піруватдегідрогенази); 2) шляхом хімічної модифікації - фосфорилування. Фосфорильована форма піруватдегідрогенази є неактивною, а дефосфорильована — активна. Тому інсулін підвищує активність комплексу, а глюкагон, адреналін (діють за аденілатциклазним каскадом) гальмують активність ферменту. Окислювальне декарбоксилювання пірувату – єдиний шлях його катаболізму, тому недостатність вітамінів (у перше чергу вітаміну В1) призводить до порушення процесу, зниження утворення АТФ і проявляється порушенням діяльності ЦНС. Піруватдегідрогеназна недостатність в організмі призводить до підвищення концентрації лактату, пірувату, аланіну, що супроводжується ацидозом.
