- •Типы систем:
- •Химическое равновесие. Обратимые и необратимые по направлению реакции. Термодинамические условия равновесия. Константы химического равновесия. Прогнозирование смещения химического равновесия:
- •Зависимость скорости химической реакции от концентрации реагентов. Кинетические уравнения реакция первого, второго и нулевого порядков:
- •Катализ. Гомогенный и гетерогенный катализ. Осбенности каталитич.Активности ферментов:
- •Условия растворения и образования осадков
- •Колигативные свойства разбавленных растворов неэлектролитов и электролитов.
- •Основные положения протолитической теории кислот и оснований Бренстеда-Лоури, сопряженная протолитическая пара, амфолиты. Теория Льюиса:
- •Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
- •Типы протолитических реакций. Понятие о гидролизе. Роль гидролиза в биохимических процессах. Ацидиметрия и алкалиметрия.
- •Буферные системы, их классификация и механизм действия. Буферные системы крови: бионеорганические биоорганические. Буферная емкость. Кислотно-основной баланс организма.
- •Буферные системы крови: 1) Фосфатная б.С. Крови- ; 2) Карбонатная б.С. Крови; 3)Ацетатная б.С. Крови; 4)Гемоглобиновая б.С. Крови; 5) Белковая б.С. Крови.
- •Лигандообменные реакции. Основные положения координационной теории Вернера. Комплексообразователь, лиганды, координационное число, дентатность.
- •Пространственное строение комплексных соединений. Классы комплексных соединений.
- •Квантово-механическая модель атома. Применение системы квантовых чисел для характеристики энергетического состояния электрона, основное и возбужденное состояние атома.
- •Химия элементов d блока.
- •Химия элементов p блока.
- •Оптические свойства: рассеивание света. Электрокинетические свойства: электрофорез и электроосмос. Строение двойного электрического слоя.
- •Коллоидные пав. Биологически важные коллоидные пав (мыла, детергенты, желчные кислоты). Мицеллообразование в растворах пав. Липосомы.
- •Окислительно-востановительное титрирование. Пермангонатометрия и иодометрия: титранты и индикаторы.
- •Электронные потенциалы и механизмы их возникновения. Уравнения Нериста для вычисления электродных потенциалов.
- •Окислительно-востановительные системы. Окислитено-востановительные потенциалы, механизм их воздействия, биологическое значение. Потенциометрия.
Зависимость скорости химической реакции от концентрации реагентов. Кинетические уравнения реакция первого, второго и нулевого порядков:
Скорость химической реакции пропорционально произведению концентраций реагирующих веществ. Чем больше концентрация реагентов.
Кинетические уравнения реакции первого порядка (c=c(cнизу 0)е(сверху –R1t))
Второго порядка
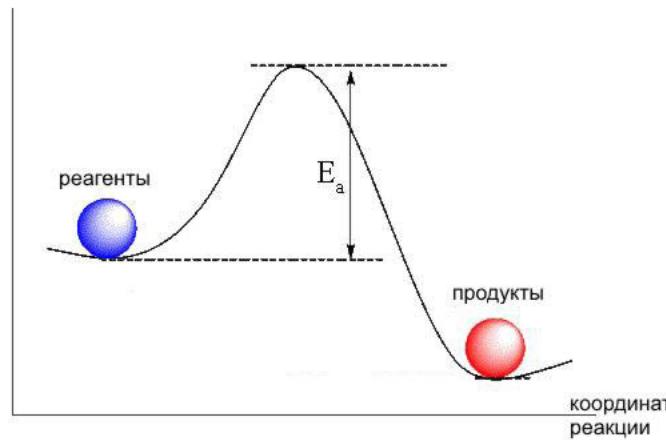
Зависимость скорости реакции от температуры. Температурный коэффициент реакции и его особенности для биохимических процессов. Понятие о теории активных соударений. Энергетический профиль реакции, энергия активации, уравнение Аррениуса:
Правило Вант-Гофа: При повыщении температуры реакционной системы на каждые 10 С скорость реакции увеличивается в 2-4 раза.
![]() где
где
![]() -
температурный коэффициент,
V2 — скорость реакции при температуре
Т2, V1— скорость реакции при температуре
Т1
-
температурный коэффициент,
V2 — скорость реакции при температуре
Т2, V1— скорость реакции при температуре
Т1
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
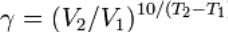
Теория активных соударений: 1.Реагировать могут не все молекулы, а только находящиеся в особом активном состоянии. 2.Активация молекулы происходит в результате биомолекулярного столкновения.3.При столкновении частиц с примерно одинаковым запасом энергии происходит её перераспределение, в результате чего энергия одной из молекул достигает значения, соответствующего энергии активации. 4.Влияние температуры на скорость реакции: смещение равновесия между обычными и активными молекулами в сторону увеличения концентрации первых.
Энергетический профиль реакции (график зависимости потенциальной энергии от координаты реакции)