
- •31. Коллигативные св-ва разб.Р-ров неэлектролитов.
- •Закон Рауля:
- •Следствия из 1 закона Рауля:
- •Закон Вант-Гоффа:
- •Закон разбавления Оствальда
- •33. Сильные электролиты
- •34. Особенности коллигативных свойств растворов электролитов
- •Роль осмоса в биологических системах
- •Основные положения протолит.Теории кислот и оснований (Лоури-Брёнстеда)
- •Механизм буферного действия
- •37 Реакции гидролиза
- •РН водных растворов солей различных типов
- •Роль гидролиза в био системах
- •Условие образования и растворения осадка
31. Коллигативные св-ва разб.Р-ров неэлектролитов.
-понижение давления насыщенного пара над –ром нелетуч.в-ва
-пониж. температуры замерзания р-ра (по сравн. с растворителем)
-повышение температуры кипения р-ра
-осмотическое давление
Закон Рауля:
Давление
насыщенного пара растворителя над
раствором пропорционально мольной доле
растворителя.

где Р – давления насыщенного пара растворителя над раствором, Па;
Р0 – давления насыщенного пара над растворителем, Па;
c(р-ля) – мольная доля растворителя;
n(раств. в-ва) – количество растворенного вещества, моль;
n(р-ля) – количество вещества растворителя, моль.
(выполн. Для идеальных растворов - компоненты которых близки по физическим и химическим свойствам (оптические изомеры, гомологи и т.п.) и образование которых не сопровождается объёмными и тепловыми эффектами)
Иногда закон Рауля определяют следующим образом. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
![]()
Или
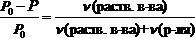
где c(раств. в-ва) – мольная доля растворенного вещества
Следствия из 1 закона Рауля:
Понижение температуры замерзания и повышение температуры кипения не зависит от природы растворённого вещества и прямо пропорциональны моляльной концентрации растворенного вещества.
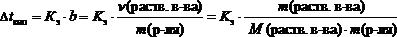
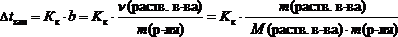
где Dtкип – повышение температуры кипения раствора, °С;
Dtзам – понижение температуры замерзания раствора, °С;
Кэ – эбуллиоскопическая константы растворителя, (кг×°С)/моль;
Кк – криоскопическая константы растворителя, (кг×°С)/моль;
b – моляльная концентрация, моль/кг;
n(раств. в-ва) – количество растворенного вещества, моль;
m(р-ля) – масса растворителя, кг;
m(раств. в-ва) – масса растворенного вещества, г;
М(раств. в-ва) – молярная масса растворенного вещества, г/моль.
Зная температуры кипения и замерзания чистых растворителей и Dt можно рассчитать температуры кипения и замерзания растворов:
tкип.(р-ра) = tкип.(р-ля) + Dtкип. tзам.(р-ра) = tзам.(р-ля) – Dtзам.
Осмос- Явление перехода растворителя в раствор через полупрониц. Мембрану
(из р-ра с меньшей конц-ей в р-р с большей конц-ей)
Осмот.давление – давление, которое заставляет переходить растворитель.(по лекции)
- Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель (из инета)
Осмотическое давление идеальных растворов линейно зависит от температуры и молярной концентрации раствора С
Росм=ρgh
Закон Вант-Гоффа:
Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора.
![]()
где Росм – осмотическое давление, кПа;
с – молярная концентрация растворенного вещества, моль/л;
R – универсальная газовя постоянная, 8,314 Дж/(моль×К);
Т – абсолютная температура, К;
V(р-ра) – объем раствора, л.
www.sev-chem.narod.ru/spravochnik/teoriya/kolligat.htm
и лекции
32. основные положения теории электролит.диссоиации:
С.Аррениус 1887 г. -теория электролитической диссоциации.
Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы - положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома - это простые ионы (Na+, Mg2+, Аl3+ и т.д.) - или из нескольких атомов - это сложные ионы (NО3-, SO2-4, РОЗ-4и т.д.).
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами.
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К+ и анион А- в общем виде записывается так:
КА ←→ K+ + A-
Сильные и слабые электролиты:
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
константа и степень ионизации слабого электролита
Степень диссоциации электролита-это частное от деления числа продиссоциированных молекул к общему числу молекул электролита, введённого в раствор. α=Nдисс/N
Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:
АaВb <––> aАx- + bВy+
константа диссоциации выразится следующим соотношением:
![]()
Для бинарного (распадающегося на два иона) электролита:
![]()
Поскольку концентрация каждого иона для бинарного электролита равна произведению степени диссоциации α на общую концентрацию электролита С, второе выражение в этом случае можно переписать следующим образом:
![]()
Для разбавленных растворов можно считать, что (1 – α) = 1. Тогда получаем:
![]()
![]()
