
- •6.2 Уравнение Ван-дер-Ваальса
- •Уравнение Ван-дер-Ваальса неплохо качественно описывает поведение газа при сжижении, но непригодно к процессу затвердевания.
- •6.3 Изотермы Ван-дер-Ваальса
- •6.5 Внутренняя энергия и теплоёмкость реального газа
- •6.6 Эффект Джоуля-Томсона. Сжижение газов и получение низких температур
6.2 Уравнение Ван-дер-Ваальса
Состояние
реального газа нельзя описать с помощью
уравнения Менделеева – Клапейрона,
справедливого только для идеальных
газов. Однако, если ввести в это уравнение
поправки на силы взаимодействия между
молекулами и собственный объём молекул,
то можно получить уравнение, описывающее
состояние реального газа. Такое уравнение
было предложено Ван-дер-Ваальсом в 1873
году. Рассмотрим схему получения
уравнения Ван-дер-Ваальса из уравнения
Менделеева - Клапейрона для одного моля
молекул газа
![]() .
Для перехода к уравнению состояния
реального газа нужно учесть силы
отталкивания, а, следовательно, собственный
объём молекул. Для этого вводится
поправка
на молярный объём (или
силы отталкивания) b.
В СИ b
измеряется в
.
Для перехода к уравнению состояния
реального газа нужно учесть силы
отталкивания, а, следовательно, собственный
объём молекул. Для этого вводится
поправка
на молярный объём (или
силы отталкивания) b.
В СИ b
измеряется в
![]() .
Тогда получим уравнение состояния
одного моля газа, учитывающее силы
отталкивания между молекулами в виде:
.
Тогда получим уравнение состояния
одного моля газа, учитывающее силы
отталкивания между молекулами в виде:
![]() .
Отсюда
.
Отсюда
![]() .
Если увеличивать давление, то при
.
Если увеличивать давление, то при
![]() ,
следовательно, V=b
. Отсюда виден физический
смысл поправки b
, заключающийся
в том, что поправка
на объём численно равна предельному
объёму, который бы занял 1 моль реального
газа при бесконечно большом давлении.
Детальное рассмотрение даёт
,
следовательно, V=b
. Отсюда виден физический
смысл поправки b
, заключающийся
в том, что поправка
на объём численно равна предельному
объёму, который бы занял 1 моль реального
газа при бесконечно большом давлении.
Детальное рассмотрение даёт
![]() ,
то есть поправка на объём равна
учетверённому объёму 1 моля молекул
газа. Объём одной молекулы, считая её
сферической, равен:
,
то есть поправка на объём равна
учетверённому объёму 1 моля молекул
газа. Объём одной молекулы, считая её
сферической, равен:
![]() .
Молярный объём
.
Молярный объём
![]() .
Тогда поправка на объём выражена
формулой:
.
Тогда поправка на объём выражена
формулой:
![]() (6.1)
(6.1)
Учтём силы притяжения между молекулами газа, которые вызывают уменьшение давления на стенки сосуда на величину Pi , которую называют внутренним давлением газа. Молекулы, находящиеся в поверхностном слое газа (их число обратно пропорционально объёму), притягиваются ближайшими молекулами внутри газа (их число тоже обратно пропорционально объёму), следовательно, P i ~ n2 , а значит, P i ~ V – 2 . Можно записать равенство:
![]() (6.2)
(6.2)
Здесь
a
– поправка на давление или силы
притяжения, она различна для разных
газов и в СИ измеряется в
![]() .
Поправки a
и b
различны для разных газов. Учитывая обе
поправки, получим:
.
Поправки a
и b
различны для разных газов. Учитывая обе
поправки, получим:
![]() или
или
![]() .
Это уравнение описывает состояние
реального газа. Однако, чаще всего его
записывают аналогично уравнению
состояния идеальных газов, тогда
уравнение состояние реальных газов для
одного моля молекул имеет вид:
.
Это уравнение описывает состояние
реального газа. Однако, чаще всего его
записывают аналогично уравнению
состояния идеальных газов, тогда
уравнение состояние реальных газов для
одного моля молекул имеет вид:
![]() (6.3)
(6.3)
Уравнение состояния реального газа – уравнение Ван-дер-Ваальса- для любого количества вещества будет иметь вид:
![]() (6.4)
(6.4)
Уравнение Ван-дер-Ваальса неплохо качественно описывает поведение газа при сжижении, но непригодно к процессу затвердевания.
Уравнение Ван-дер-Ваальса – кубическое уравнение относительно объёма и имеет три корня. С практической точки зрения интересны случаи, когда три корня действительны и одинаковы (соответствует критическому состоянию вещества), и когда три корня действительны и различны. В последнем случае со значениями и смыслом корней поможет разобраться изотерма Ван-дер-Ваальса.
6.3 Изотермы Ван-дер-Ваальса
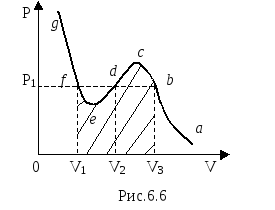 Изотерма
Ван-дер-Ваальса
приведена на рис.6.6. На изотерме отмечены
корни уравнения V
1,
V
2,
V
3,
соответствующие отмеченному давлению
Р 1 .
Участок ab
на изотерме соответствует однофазному
газообразному состоянию, участок fg
– однофазному жидкому состоянию.
Состояния вещества, соответствующие
участку cde
, на практике не наблюдаются, так как
невозможен одновременный рост давления
и объёма, поэтому этот участок называют
нестабильным
[1,2].
Состояния, соответствующие участкам
bc
и ef
на практике
можно наблюдать, они называются
метастабильными,
поскольку очень неустойчивы и для их
получения требуется специальная очистка
вещества от примесей, наличие которых
приводит к нарушению стабильности.
Изотерма
Ван-дер-Ваальса
приведена на рис.6.6. На изотерме отмечены
корни уравнения V
1,
V
2,
V
3,
соответствующие отмеченному давлению
Р 1 .
Участок ab
на изотерме соответствует однофазному
газообразному состоянию, участок fg
– однофазному жидкому состоянию.
Состояния вещества, соответствующие
участку cde
, на практике не наблюдаются, так как
невозможен одновременный рост давления
и объёма, поэтому этот участок называют
нестабильным
[1,2].
Состояния, соответствующие участкам
bc
и ef
на практике
можно наблюдать, они называются
метастабильными,
поскольку очень неустойчивы и для их
получения требуется специальная очистка
вещества от примесей, наличие которых
приводит к нарушению стабильности.
Участок bc соответствует пересыщенному или переохлаждённому пару. Его можно получить, если тщательно очистить пар от центров конденсации.
Участок ef - перегретая жидкость. Её можно получить, тщательно очистив жидкость от центров парообразования.
Работа при изотермическом сжатии по изотерме Ван-дер-Ваальса от объёма V3 до объёма V1 численно равна площади заштрихованной криволинейной трапеции на рис.6.6.
Эта площадь должна быть равна площади прямоугольника V1 fb V3 на том же рисунке, соответствующей экспериментальной изотерме.
Если газ находится при температуре выше критической, то при изотермическом сжатии его нельзя перевести в жидкое состояние. Для сжижения его нужно сначала охладить до температуры ниже критической, а затем наиболее выгодно, то есть изотермически, сжать. В критическом состоянии V1 = V2 = V3 , то есть все три корня действительны и одинаковы. Следует отметить, что для лёгких газов уравнение Ван-дер-Ваальса лучше описывает их состояние.
6.4 Критическое состояние вещества
Как было отмечено выше, в критическом состоянии нет различия между жидкостью и газом, нет границы раздела между этими фазами. На диаграмме Ван-дер-Ваальса критическое состояние вещества изображается точкой перегиба К. Критическое состояние можно описать при помощи критических параметров состояния: критической температуры Тк, критического объёма Vк и критического давления Рк . Критические параметры можно выразить через поправки на давление и объём. Поскольку критическая точка – точка перегиба изотермы Ван-дер-Ваальса, то в этой точке первая и вторая производные от давления по объёму должны быть равны нулю. Поскольку состояние реального газа описывается уравнением Ван-дер-Ваальса, то первая производная определяется формулой:
![]() (6.5)
(6.5)
Вторая производная :
![]() .
.
Приведём к общему
знаменателю обе формулы и их числители
приравняем нулю, получим:
 .
.
Преобразуем эту систему
к уравнению:
![]() .
Поделим обе части этого уравнения на
.
Поделим обе части этого уравнения на
![]() и получим :
и получим :
![]() (6.6)
(6.6)
На практике обычно
![]() .
Для выражения критической температуры
через поправки на объём и давление,
воспользуемся формулой (6.5)и получим
.
Для выражения критической температуры
через поправки на объём и давление,
воспользуемся формулой (6.5)и получим
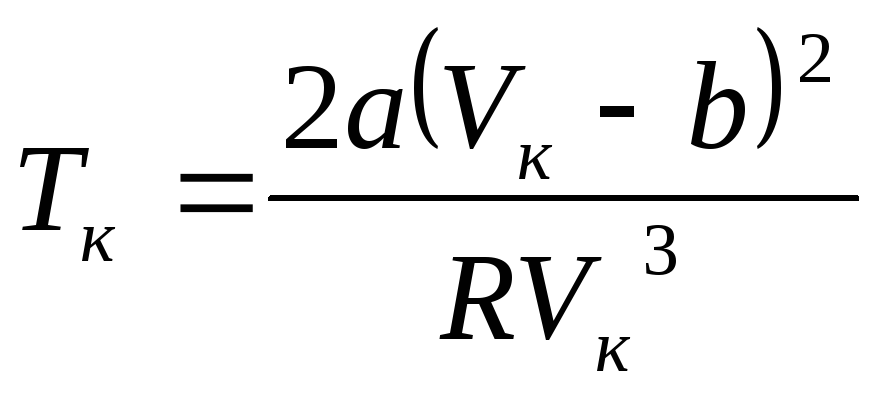 .
Подставим в эту формулу вместо
критического объёма правую часть
равенства (6.6) и получим:
.
Подставим в эту формулу вместо
критического объёма правую часть
равенства (6.6) и получим:
![]() (6.7)
(6.7)
Следует обратить внимание на то, что критическая температура вещества не равна температуре кипения. Так температура кипения воды 373,15 К, а критическая температура 647,25 К. Ниже приведены критические температуры некоторых веществ.
|
Вещество |
Критическая температура, К |
|
Вода (водяной пар) |
647,25 |
|
Кислород |
154,3 |
|
Азот |
126 |
Критическое давление
найдём, подставив в уравнение
![]() критический объём и критическую
температуру, выраженные через поправки
Ван-дер-Ваальса, получим:
критический объём и критическую
температуру, выраженные через поправки
Ван-дер-Ваальса, получим:
![]() (6.8)
(6.8)
Следует отметить, что
для одного моля идеального газа
справедливо равенство
![]() .
Поскольку в критическом состоянии газ
нельзя считать идеальным, то приведённое
выше равенство не выполняется, а
справедливо следующее равенство:
.
Поскольку в критическом состоянии газ
нельзя считать идеальным, то приведённое
выше равенство не выполняется, а
справедливо следующее равенство:
![]() (6.9)
(6.9)
При критических
параметрах парообразное и жидкое
состояния неразличимы. Однако, если при
критической температуре
![]() ,
вещество находится в газообразном
состоянии, а при
,
вещество находится в газообразном
состоянии, а при
![]() -
в жидком. Критические параметры обычно
определяют экспериментально и по ним
рассчитывают поправки Ван-дер-Ваальса.
Для многих веществ трудно экспериментально
измерить критические параметры. В этом
случае критические параметры рассчитывают,
используя экспериментально полученные
критические параметры другого вещества,
и уравнение Ван-дер-Ваальса в приведённых
или относительных параметрах :
-
в жидком. Критические параметры обычно
определяют экспериментально и по ним
рассчитывают поправки Ван-дер-Ваальса.
Для многих веществ трудно экспериментально
измерить критические параметры. В этом
случае критические параметры рассчитывают,
используя экспериментально полученные
критические параметры другого вещества,
и уравнение Ван-дер-Ваальса в приведённых
или относительных параметрах :
![]() ,
где
,
где
![]() ,
,
![]() и
и
![]() .
Уравнение Ван-дер-Ваальса в приведённых
или относительных параметрах имеет вид
для одного моля:
.
Уравнение Ван-дер-Ваальса в приведённых
или относительных параметрах имеет вид
для одного моля:
![]() (6.10)
(6.10)
Таким образом, изучение поведения уравнения (6.10) позволяет предсказать поведение любого реального газа.
