
Лекции по молекулярной физике / Лекция 2
.doc2.3. Температура.
Из основного
уравнения МКТ идеальных газов
![]() следует, что давление пропорционально
средней кинетической энергии
поступательного движения молекул.
Поскольку концентрация молекул связана
с плотностью газа соотношением:
следует, что давление пропорционально
средней кинетической энергии
поступательного движения молекул.
Поскольку концентрация молекул связана
с плотностью газа соотношением:
![]() , то давление связано с плотностью прямой
пропорциональной зависимостью. При
неизменном n
(n=const),
а значит и ,
давление прямо пропорционально
, то давление связано с плотностью прямой
пропорциональной зависимостью. При
неизменном n
(n=const),
а значит и ,
давление прямо пропорционально
![]() .
При нагревании газа его давление растет,
при охлаждении падает.
.
При нагревании газа его давление растет,
при охлаждении падает.
Нагретый или охлажденный газ характеризуют температурой.
Температура - величина, характеризующая степень нагретости тел. Тела могут быть нагреты неравномерно (например, одна часть тела нагрета сильнее другой). Для определения температуры тела в этом случае необходимо подождать, пока тело в результате теплообмена не перейдёт в равновесное состояние, при котором оно будет равномерно нагрето. Температура - величина, характеризующая состояние теплового равновесия тел. Два тела, имеющие одинаковые температуры, находятся в тепловом равновесии. Если два тела находятся в тепловом равновесии с третьим, то и меду собой они тоже находятся в тепловом равновесии. Температура тела - величина, которая определяет направление теплообмена, то есть, будет ли данное тело отдавать (или принимать) другому телу с иной температурой теплоту. Своеобразие температуры в том, что её нельзя измерить методом сравнения с эталоном. Для измерения температуры необходимо, чтобы термометрическое вещество (тело) пришло в тепловое равновесие со средой, температуру которой нужно измерить. Своеобразие температуры и в том, что она не аддитивна. Это значит, что температура всего тела не равна сумме температур его частей. Для измерения температуры пользуются тем, что при изменении температуры тела изменяются его свойства, а, следовательно, и величины, характеризующие свойства.
Тело, выбираемое для измерения температуры, называется термометрическим. Нужно выбирать такие тела, у которых величина, изменяющаяся при изменении температуры - термометрическая величина - изменялась бы: 1) значительно; 2) монотонно. Прибор для измерения температуры называют термометром. Термометры бывают разные: ртутные, спиртовые, электрические, оптические и др. Они имеют разные термометрические вещества , термометрические величины и свойства.
Пример: ртутный термометр - термометрическое вещество - ртуть; термометрическое свойство - изменение объема с изменением температуры; термометрическая величина - длина ртутного столба.
Для того, чтобы величине температуры можно было сопоставить определенные числовые значения, нужно воспользоваться температурной зависимостью термометрической величины. Обычно используют линейную зависимость.
Единица измерения температуры - градус. Размер градуса устанавливают так. Произвольно выбирают две температуры (их называют реперными точками) - обычно это температура таяния льда и кипения воды при атмосферном давлении - и делят температурный интервал между реперными точками на некоторое число равных частей - градусов. Так получают температурную шкалу. Можно получить множество таких шкал. Их называют относительными шкалами. Примерами относительных шкал являются шкалы Цельсия, Фаренгейта, Реомюра.
Современная термометрия основана на шкале идеального газа, устанавливаемой с помощью газового термометра. В газовом термометре термометрической величиной является давление.
Пусть кипению
соответствует РК,
а таянию льда Р0
, тогда
![]() .
Из опыта
.
Из опыта
![]() ,
следовательно, и
,
следовательно, и
![]() .
Размер градуса выбирают делением
разности ТК
- Т0
на 100 частей,
следовательно:
.
Размер градуса выбирают делением
разности ТК
- Т0
на 100 частей,
следовательно:
![]() .
.
По газовому термометру градуируют многие используемые на практике термометры.
Температурная шкала называется абсолютной, если при температуре, равной нулю, термометрическая величина обращается в нуль. Температура, определённая по такой шкале, называется абсолютной термодинамической температурой.
В СИ температура измеряется в кельвинах: [T] =1К .
1 К равен
![]() части температурного интервала от
абсолютного нуля температуры до
температуры тройной точки воды (см.гл.6).
Шкала Кельвина
- абсолютная
шкала, так
как при Т=0 К, термометрическая величина
- давление Р = 0 Па.
части температурного интервала от
абсолютного нуля температуры до
температуры тройной точки воды (см.гл.6).
Шкала Кельвина
- абсолютная
шкала, так
как при Т=0 К, термометрическая величина
- давление Р = 0 Па.
Связь между температурой в градусах Цельсия и Кельвина выражена следующей формулой:
t(0C)=T(K) - 273,15
Величина градуса Цельсия равна величине градуса Кельвина.
Если два тела с разными температурами привести в контакт, то со временем температуры этих тел станут одинаковыми. Изменение температуры контактирующих тел в процессе установления теплового равновесия означает передачу энергии от одного (более нагретого) тела к другому (менее нагретому) телу. Энергия будет передаваться до тех пор, пока температуры тел не станут одинаковыми. Процесс передачи энергии от более нагретого тела к менее нагретому обусловлен энергетическим обменом его структурных элементов (молекул). Следовательно, внутренняя энергия тела (как суммарная энергия его структурных элементов) пропорциональна температуре.
Для идеальных
газов внутренняя энергия определяется
только кинетической энергией его
молекул. Средняя кинетическая энергия
поступательного движения молекул
идеального газа прямо пропорциональна
температуре
![]() ~
Т. Введём коэффициент пропорциональности,
равный
~
Т. Введём коэффициент пропорциональности,
равный
![]() для одноатомных газов (почему именно
3/2 см. п.3.6), где k=1,3810
–23 Дж/К
- постоянная Больцмана. Тогда
для одноатомных газов (почему именно
3/2 см. п.3.6), где k=1,3810
–23 Дж/К
- постоянная Больцмана. Тогда
![]() (2.4)
(2.4)
Отсюда видно, что и температура как макроскопический параметр состояния, с точки зрения МКТ, тоже является среднестатистическим параметром, как и давление.
2.4. Уравнение состояния идеального газа - уравнение Менделеева- Клапейрона
Уравнение состояния идеального газа или уравнение Менделеева - Клапейрона является обобщением законов идеального газа, открытых экспериментально до создания МКТ. Однако, из основного уравнения МКТ (2.3), можно получить уравнение состояния идеального газа. Для этого подставим вместо средней кинетической энергии поступательного движения молекулы в основное уравнение МКТ идеальных газов правую часть равенства (2.4), получим уравнение, в которое не входят микропараметры газа
![]() (2.5)
(2.5)
Так как
![]() ,
следовательно,
,
следовательно,
![]() или
или![]() .
Учитывая, что
.
Учитывая, что
![]() ,
получим N=NA
,
получим N=NA![]() , а так
как
NAk
= R
= 8,3
, а так
как
NAk
= R
= 8,3![]() - молярная
газовая постоянная [2,3,5,15]
или универсальная
газовая постоянная
[1,6,7,] , то получим уравнение
Менделеева
- молярная
газовая постоянная [2,3,5,15]
или универсальная
газовая постоянная
[1,6,7,] , то получим уравнение
Менделеева
![]() (2.6)
(2.6)
Уравнение состояния
газа часто удобно использовать в записи,
предложенной Клапейроном, если
количество вещества не изменяется
![]() или
или
![]() (2.7)
(2.7)
Уравнение (2.7) часто называют обобщённым газовым законом. Тот факт, что из основного уравнения молекулярно-кинетической теории идеального газа можно вывести уравнение состояния идеального газа, подтверждает верность молекулярно-кинетической теории вещества.
2.5. Газовые законы.
Газовые законы установлены в 17 веке экспериментально. Однако, их можно получить, используя уравнение Менделеева - Клапейрона.
Закон Бойля-Мариотта.
Для данного
количества
вещества
![]() рассмотрим изотермический
процесс,
то есть процесс, протекающий без изменения
температуры (Т= const).
Используя уравнение (2.6) или (2.7), получим
уравнение изотермы, выраженное через
давление и объём газа:
рассмотрим изотермический
процесс,
то есть процесс, протекающий без изменения
температуры (Т= const).
Используя уравнение (2.6) или (2.7), получим
уравнение изотермы, выраженное через
давление и объём газа:
![]() (2.7)
(2.7)
или
![]() (2.7’)
(2.7’)
Для данного количества вещества при изотермическом процессе произведение давления на объём есть величина постоянная.
Д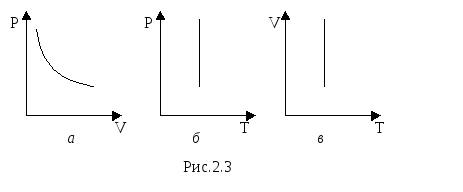 ля
построения диаграммы Р(V)
выразим давление через объем
ля
построения диаграммы Р(V)
выразим давление через объем
![]() .
.
Зависимость между давлением и объёмом – обратно пропорциональная, графически представлена гиперболой на рис.2.3 а. Температурные зависимости давления и объёма представлены на рис.2.3 б и в, соответственно.
З акон
Гей-Люссака. Для
данного количества вещества
акон
Гей-Люссака. Для
данного количества вещества
 рассмотрим изобарический
процесс,
то есть процесс, протекающий без изменения
давления
рассмотрим изобарический
процесс,
то есть процесс, протекающий без изменения
давления
(Р = const). Используя уравнение (2.6) или (2.7), получим уравнение изобары, выраженное через температуру и объём:
![]() , (2.8)
, (2.8)
через параметры
начального и конечного состояния
![]() или
или
![]() .
.
Для данного количества вещества при изобарическом процессе отношение объёма к температуре (или наоборот) есть постоянная величина.
Изобарический
закон можно записать и в виде:
![]() .
Здесь V0
- объём газа при t=00C,
t-
температура в 0С,
- термический коэффициент объемного
расширения;
.
Здесь V0
- объём газа при t=00C,
t-
температура в 0С,
- термический коэффициент объемного
расширения;
![]() .
Для идеального газа
.
Для идеального газа
![]() ,
,![]() ,
но
,
но
![]() ,
тогда
,
тогда
![]() - термический коэффициент объёмного
расширения идеального газа равен
величине, обратной температуры.
Изображение этого процесса приведено
на рис. 2.4.
- термический коэффициент объёмного
расширения идеального газа равен
величине, обратной температуры.
Изображение этого процесса приведено
на рис. 2.4.
Закон
Шарля.
Для данного количества вещества
 рассмотрим изохорический
процесс,
то есть процесс, протекающий без изменения
объёма (V
= const).
Используя уравнение (2.6) или (2.7), получим
уравнение изохоры,
выраженное через температуру и давление
газа:
рассмотрим изохорический
процесс,
то есть процесс, протекающий без изменения
объёма (V
= const).
Используя уравнение (2.6) или (2.7), получим
уравнение изохоры,
выраженное через температуру и давление
газа:
![]() ,
(2.9)
,
(2.9)
ч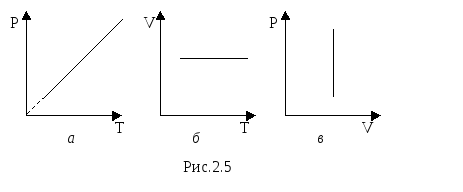 ерез
параметры начального и конечного
состояния
ерез
параметры начального и конечного
состояния
![]() или
или
![]() .
.
Для данного количества вещества при изохорическом процессе отношение давления к температуре (или наоборот) есть величина постоянная.
Изображение этого процесса приведено на рис. 2.5.
Закон Авогадро
При одинаковых давлениях (Р) и температурах (Т) в равных объемах (V) любого газа содержится одинаковое число молекул.
![]()
![]() ,
следовательно, N1
= N2
,
следовательно, N1
= N2
Закон Дальтона (для смеси газов)
Давление смеси газов равно сумме парциальных давлений
Рсм=Р1+Р2+... +РК (2.10)
Этот закон можно
также получить, используя уравнение
состояния идеального газа.
![]() ,
,
![]()
![]() - парциальное
давление
- давление, которое оказывал бы данный
компонент газа, если бы он один занимал
весь объем, предоставленный смеси.
- парциальное
давление
- давление, которое оказывал бы данный
компонент газа, если бы он один занимал
весь объем, предоставленный смеси.
Изложенный материал представлен в таблице 2.1.
