
Методические указания по подготовке к вступительному испытанию по физике [PDF] [22]
.pdf
|
|
|
|
p2 |
= |
m1 - Dm |
RT ; |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
MV |
|
|
|
||
p |
- p |
2 |
= |
m1RT - m1RT + D mRT |
|
= |
(P1 - P2 )RT |
. |
|||
|
|
||||||||||
1 |
|
|
|
MV |
|
MVg |
|||||
|
|
|
|
|
|
||||||
Таким образом, давление в баллоне уменьшится на |
|
|
|
||||||||
D p = 0,25×8,31× 300 » 445Па.
0,028 ×5 ×10
Пример 2.5.
При нагреве газа на Т = 5 К при постоянном давлении его объем уве-
личился на 25 % первоначального. При какой температуре находится газ?
Поскольку в условии нет указаний на изменение массы газа, считаем
m = const и применяем закон Гей-Люссака:
|
|
|
|
|
V1 |
= |
V2 |
. |
|
|
|
|
|
||||||||
|
|
|
|
|
T1 |
|
T2 |
|
||
Так как T2 = T1 + DT и V2 = 1,25V 1, |
|
|
|
|
||||||
получим |
V1 |
= |
1,25 ×V1 |
или |
1,25 ×T |
= T + DT |
||||
|
|
|||||||||
|
T1 T1 + DT |
1 |
1 |
|||||||
|
|
|
|
|
||||||
|
|
|
|
0,25T1 = 5K , |
|
T1 = 20 K, |
||||
|
|
|
|
T1 + DT = 25K . |
|
|||||
Ответ: газ находился при температуре 25 K/ |
||||||||||
Пример 2.6.
Каково давление воздуха(М = 0,029 кг/моль) в камере сгорания ди-
зельного двигателя при температуре t = 503 ° С, если плотность воздуха
ρ = 1,8 кг/м3?
Для подобных задач удобно применить уравнение Менделеева– Кла-
пейрона, потому что в нем«спрятана» плотность r = m . Действительно,
V
41

pV = m RT можно записать в виде p = r RT . Применительно к имеющим-
V M
ся условиям p = 1,8 8,31× 776 » 4 ×105 Па = 400кПа 0,029
(не забудем перевести температуру в абсолютную T = t + 273 = 776 K)
Решите самостоятельно.
1) Во сколько раз изменится давление одноатомного идеального газа в результате уменьшения его объема в3 раза и увеличения средней кинетиче-
ской энергии его молекул в 2 раза?
(Ответ: в 6 раз)
2) В результате утечки из баллона половины массы газа и двукратного
понижения его температуры давление газа в баллоне
1) уменьшилось в 2 раза; |
2) |
увеличилось в 2 раза; |
3) не изменилось; |
4) |
уменьшилось в 4 раза; |
5)уменьшилось в 1.5 раза.
3)Воздух при температуре t1 = 0°С и давлении р1 = 0,1 МПа занимает объем V1 = 40 л. При какой температуре его объем будет равенV1 = 2 л при давлении р2 = 0,1 МПа.
(Ответ: 1092 K)
4) Газ при температуре t1 = 27°С и давлении р1 = 1,5 МПа занимает объем V1 = 40 л. Какой объем займет этот газ при нормальных условиях?
(Ответ: 546 л)
5) В баллоне объемом V1 = 0,2 м3 находится гелий при давлениир1 = 0,1 МПа и температуре t1 = 17°С. Массу гелия в баллоне увеличили, при этом давление повысилось дор2 = 0,3 МПа, а температура – до t2 = 47°С. На сколько увеличилась масса гелия? (МНе = 4·10-3 кг/моль).
(Ответ: 57 г)
42

Изотермический процесс– процесс, при котором температура Т и мас-
са m газа остаются постоянными.
Будем считать, что масса газа и род газа не меняются. Тогда в случае процесса, протекающего при постоянной температуре, уравнение Менделее-
ва – Клапейрона примет вид:
pV = m RT = const
M
или pV = const .
Мы видим, что при изотермическом процессе давление идеального газа обратно пропорционально его объему. Это так называемый закон Бойля– Мариотта.
Закон Бойля – Мариотта: для данной массы идеального газа при изотер-
мическом процессе произведение давления р газа на его объем V постоянно.
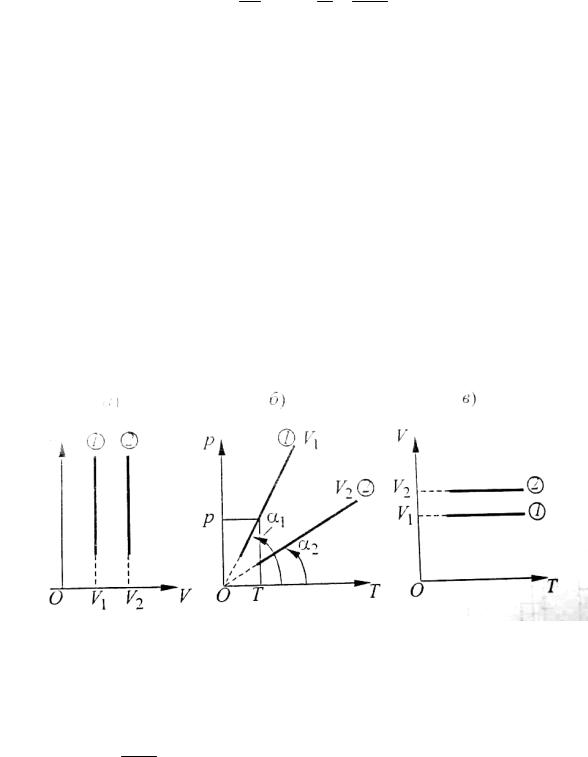
Графиком этого закона является парабола, называемая изотерПой. при-
чем, чем больше температура газа, тем дальше парабола отстоит от осей ко-
ординат. На графике (рис. ) приведены две изотермы, соответствующие двум состояниям газа при различных температурах: Т 2 > Т1.
Рис. 10. Графики изотермического процесса
Изохорный процесс – процесс, при котором объем V и масса m газа не
изменяются.
43
Будем считать, что масса газа и род газа не меняются. Тогда в случае процесса, протекающего при постоянной температуре, уравнение Менделее-
ва – Клапейрона примет вид:
pV = m RT Þ p = mR = const ;
M |
|
T |
MV |
|
p |
= const . |
|
|
|
||
|
T |
|
|
Следовательно, при изохорном |
процессе давление идеального газа |
||
прямо пропорционально его абсолютной температуре. Последнее утвержде-
ние представляет собой закон Шарля.
Зависимость р от Т представляет собой прямую линию, называемую изохорой, проходящую через начало координат. То есть при Т = 0 К предпо-
лагается, что р = 0. однако при низких температурах возможны более слож-
ные физические процессы, которые еще не установлены наукой. Поэтому экстраполяционный участок графика зависимостир от Т следует чертить пунктиром.
Рис. 11. Графики изохорного процесса
Тангенс угла наклона изохоры к положительному направлению оси
абсцисс tga = mR . На графике приведены две изохоры, соответствующие
MV
двум состояниям газа при разных объемах. Из уравнения Менделеева – Кла-
пейрона объем равен
44

V = uR = uR ; p tga
V2 = tga1 ñ1 Þ V2 ñ V1 .
V1 tga2
Изобарный процесс – процесс, при котором давление р и масса m газа не изменяются.
Будем считать, что масса газа и род газа не меняются. Тогда в случае процесса, протекающего при постоянной температуре, уравнение Менделее-
ва – Клапейрона примет вид:
pV = m RT Þ V = mR = const ;
M |
|
T Mp |
|
V |
= const . |
|
|
|
|
T |
|
При изобарном процессе объем, занимаемый идеальным газом, прямо пропорционален его абсолютной температуре. Это утверждение носит назва-
ние закона Гей – Люссака. Графиком этого процесса является прямая линия
(рис.), называемая изобарой. Тангенс угла наклона изобары к положительно-
му направлению оси абсцисс tga = mR . На графике приведены две изобары,
Mp
соответствующие двум состояниям газа при разных объемах. Из уравнения Менделеева – Клапейрона давление равено
p = uRT = uR . V tga
V = tga , где α – угол наклона графика к оси абсцисс. Чем меньше α,
T
тем меньше tg α, тем больше р. |
tga2 átga1 Þ p2 ñ p1 . |
45

Рис. 12. Графики изобарного процесса
2.3.Первый закон термодинамики
Это закон сохранения и превращения энергии применительно к тепло-
вым процессам. Его формулировка: теплота Q, подведенная к закрытой
системе, затрачивается на изменение U ее внутренней энергии и на совершение системы работы А над внешними телами:
Q = DU + A
Работа и теплопередача – характеристики процесса изменения внутрен-
ней энергии системы; они функции процесса, но не состояния системы. В
каждом состоянии система обладает вполне определенной внутренней энергией. Однако нельзя говорить, что в ней содержится опреде-
ленное количество теплоты или работы.
2.3.1. Задачи на применение I закона термодинамики
При решении задач, связанных с расчетом внутренней энергии U и
работы А, совершаемой газом за счет сообщения системе некоторого коли-
чества теплоты Q, полезно сначала записать I закон термодинамики в общем виде: Q = A + DU и разобраться, какой вид процесса имеет место.
Если из условия следует, что процесс адиабатический и теплообмена не происходит, то A + DU = 0 : при совершении положительной работы (расши-
46

рении) уменьшается внутренняя энергия и снижается температура, а при от-
рицательной работе (сжатия) внутренняя энергия и температура увеличива-
ются.
Если происходит изобарный процесс (р = const), то изменится внутрен-
няя энергия
DU = i × m RDT ,
2 M
где i – число степеней свободы: для одноатомных газов i = 3, для двухатом-
ных газов (например, О2 и N2) i = 5, для трех- и более атомных (например,
СО2) i = 6; Т – изменение температуры.
При этом совершается работаA = p(V2 -V1 )= pDV . Из уравнения
Менделеева – Клапейрона следует, что если pDV = m RDT , то можно запи-
M
сать Q = 5 p(V2 -V1 ).
2
При изохорном процессе объем не изменяется и работы не совершает-
ся; вся теплота, подведенная к системе, преобразуется в изменение внутрен-
ней энергии (происходит изменение температуры газа).
Пример 2.7.
Каким является процесс, если газ совершил работу, равную 5 кДж, а
его внутренняя энергия, уменьшалась на 5 кДж?
Конечно, адиабатическим: A + DU = 0 .
Если все подведенная к системе теплота расходуется на совершение работы, то температура газа не изменяется( U= 0) – это изотермический процесс, при котором pV = const.
Пример 2.8.
Какую работу совершает газ при изотермическом расширении, если ему передано 5 кДж теплоты?
47

Дано: |
Решение: |
Q = 5 кДж |
Q = A + DU |
m = const |
U= 0 |
T = const |
A = Q = const |
|
|
A -? |
|
|
|
Ответ: газ совершил работу, равную 5 кДж.
Во многих задачах требуется определить работу, совершаемую идеаль-
ным газом при круговом цикле, или оценить величины, входящие в выраже-
ние для коэффициента полезного действия теплового действия:
h = Qнагр - Q хол ×100 % = Tнагр - Tхол ×100 %
Qнагр Tнагр
где индексы «нагр» относятся к нагревателю, а «холл» к холодильнику. Если задача представлена графически, то работу можно оценить как площадь, за-
ключенная внутри цикла в координатах p – V.если условия даны в других координатах (p – Т или V–Т), то графически следует перестроить в p – V. Во всех задачах, содержащих η полезно записать выражения для КПД и посмот-
реть, какими величинами вы располагаете для решения.
Пример 2.9.
Преобразуйте графики (1) и (2) на рис. в координаты p – V.
V |
|
p |
|
2 |
3 |
3 |
2 |
1 |
|
1 |
|
0 |
T |
0 |
T |
(1) |
|
(2) |
|
|
Рис. 13. Исходные графики процессов. |
|
|
48

На участке 1-2 графика (1) происходит изотермический процесс: объем увеличивается, а давление уменьшается. На участке 2-3 объем остается по-
стоянным с ростом температуры– процесс изохорный, т.е. давление растет.
На участке 3-1 происходит изобарный процесс: температура снижается, объ-
ем уменьшается до исходного. В результате получим график (1) на рис. 14.
р |
|
р |
|
1 |
3 |
3 |
2 |
|
2 |
|
1 |
0 |
V |
0 |
V |
|
(1) |
|
(2) |
|
Рис.14. Графики после преобразования в координаты p – V. |
||
На |
участке 1-2 графика (2) происходит |
изохорный процесс: давление |
|
растет, температура увеличивается; на участке 2-3 – изобарный с уменьше-
нием температуры и объема; на участке 3-1 – изотермический с падением давления и роста объема. результат преобразования показан на графике(2)
рис.14.
Пример 2.10.
Если V1 = 2 л, V2 = 2,5 л, р1 = 4·105 Па, р2 = 2·106 Па, то чему равна ра-
бота в замкнутом процессе, представленном на рис. 15 ?
Найдем площадь замкнутого контура:
A = (p2 - p1 )× (V2 -V1 ) = 800 Дж
49

Рис. 15. График процесса
Пример 2.11.
При адиабатическом расширении m = 2 г гелия (М = 0,004 кг) газ со-
вершил работу А = 300 Дж. На сколько изменилась температура газа?
Так как Q = 0 и A = -DU , то температура газа снизилась:
DU = - |
3 |
|
M |
DT . Отсюда DT = - |
2 AM |
= -48 К. |
|
m |
|
||||
2 |
|
|
3mR |
|||
Пример 2.12.
Какую работу совершает за один цикл идеальный тепловой двигатель,
если температура нагревателя Тнагр= 800 K, а холодильника Тхол= 200 K? За один цикл от холодильника отводится Q = 300 Дж.
По формуле для расчета КПД (η) двигателя можно найти:
h = Tнагр - Tхол ×100 = 75 %.
Tнагр
Работа является мерой изменения энергии:
A = Qнагр - Qхол .
КПД описывается также в виде h = Qнагр - Q хол ×100 %.
|
|
|
|
Qнагр |
|
Отсюда Qнагр - Qхол |
= |
hQхол |
или A = |
75 × 300 |
= 225 Дж. |
|
|
||||
|
100 |
100 |
|
||
Отдельную группу образуют задачи по расчету количества теплоты,
установившейся температуры или необходимой мощности нагревателя. При
50
