Жировая эмболия Патогенез жировой эмболии при эндопротезировании тазобедренного сустава. Жировая эмболия (ЖЭ) известна как распространенное осложнение вследствие повреждений организма человека различными факторами внешней среды и вследствие заболеваний, обусловленное изменением физико-химических свойств транспортных форм жиров плазмы с последующей эмболизацией сосудов малого и большого кругов кровообращения. Продолжающаяся дискуссия об источнике эмболического жира касается в основном факторов, нарушающих эмульсионную стабильность жиров плазмы и ведущих к появлению в венозном кровотоке капель, размер которых допускает обтурацию легочных артериол и капилляров, а количество превышает способность легких очищать кровь путем липодиереза. Эмульсионная стабильность жира плазмы зависит от состояния ее белков (фосфатидов), нарушение обмена которых, изменяя поверхностное натяжение капель жира, приводит к слиянию и укрупнению последних. Отличительным признаком дезэмульгирования является закономерно обнаруживаемая жировая гиперглобулемия - повышенное содержание увеличенных в размерах жировых капель (глобул), что имеет место как при переломах крупных костей, так и при ортопедических вмешательствах на суставах конечностей. После появления таких глобул в течение более или менее продолжительного времени происходит эмболизация микрососудов бассейна легочной артерии. На начальном этапе она может быть обнаружена только при гистологическом исследовании с использованием специальных способов выявления жира и носит характер патологоанатомического феномена. При продолжающемся поступлении глобул и увеличении количества выключенных из кровообращения сосудов становится возможным с помощью чувствительных методов установить расстройство газообмена и увеличение внутрилегочного шунта без клинической симптоматики, что трактуется как патофизиологический феномен жировой эмболии, отличающийся от патологоанатомического наличием выявляемых изменений гомеостаза. При субклинических формах жировой эмболии имеются нечеткие симптомы нарушения функционирования сердечно-сосудистой системы и легких, наличие и выраженность которых могут трактоваться и как проявления самого повреждения (заболевания). Только при выключении из газообмена значительного объема легочной ткани или при повышении сопротивления кровотоку, сказывающемся на нагнетательной функции правого желудочка сердца, появляется клиническая симптоматика. Иногда клинические проявления наступают сразу вслед за эмболизацией жиром, высвобожденным из мест повреждения жировых депо. Этот компонент образования эмболического жира явно присутствует при абсолютном большинстве механических, барометрических, термических травмирующих воздействий, ведущих к жировой эмболии, а также при заболеваниях, связанных с накоплением жира в клетках отдельных органов или плазме крови. По всей вероятности, свободный жир, присутствующий в кровотоке в виде капель, лишенных белковой оболочки, вызывает активизацию ферментных систем, что, в свою очередь, нарушает эмульсионную стабильность транспортных форм жира плазмы и, возможно, наряду с этим усиленный липолиз депонированного жира. Все перечисленные факторы в совокупности ведут к жировой гиперглобулемии и жировой эмболии сосудов малого и большого кругов кровообращения. При благоприятном стечении обстоятельств, эффективной профилактике и результативной превентивной терапии происходит разрешение жировой гиперглобулемии путем ферментативного расщепления эмболического жира, восстановления обычного эмульсионного состояния жиров плазмы, откладывания жира в депо, трансформации и выделения. Таким образом завершается большинство субклинических случаев жировой эмболии, в частности при переломах длинных трубчатых костей. Появление при нарастающей или сохраняющейся гипоксемии со значительным альвеоло-артериальном различием по кислороду явных симптомов жировой эмболии соответствует клиническим её формам. Необходимо по возможности четко разграничивать симптомы жировой эмболии малого и большого кругов, выделяя те из них, которые характеризуют поражение артериального сосудистого русла. Ограничение представления о клинической жировой эмболии только наблюдениями, при которых имеются типичная петехиальная сыпь или мозговые проявления, вносит определенные искажения в цифры, характеризующие её распространенность, занижая их. С другой стороны, если устойчивую артериальную гипоксемию использовать в качестве единственного или основного признака тканевой (жировой) эмболии, возможна неоправданная гипердиагностика. Диагноз жировой эмболии предполагается по клиническим признакам, подтверждается лабораторными данными, специальными исследованиями и динамикой процесса, доказывается морфологическими приемами. Развернутый диагноз включает причину развития жировой эмболии, преимущественную локализацию поражения, фазу или стадию процесса. Классификация по этиологическому принципу позволяет из тканевой эмболии вычленить жировую. При явной связи последней с механическими или термическими повреждениями допустимо добавление определения «посттравматическая». В зависимости от преимущественной локализации жировых эмболов, которая иногда меняется по мере развития осложнения, выделяют легочную или генерализованную формы. Начинаясь с обтурации артериол и капилляров, жировая эмболия проходит механическую фазу, на которой может и завершиться. Однако при ферментативном гидролизе эмболического жира образуются токсичные свободные жирные кислоты, а в процессе разрушения форменных элементов крови и паренхимы высвобождаются биологически активные вещества, что обусловливает развитие химической фазы и возникновение воспалительной реакции. Практически на любой стадии процесса возможно спонтанное или обусловленное терапией обратное его развитие, либо при исчерпании компенсаторных возможностей сердечной или дыхательной систем резкое критическое ухудшение состояния пациента с фатальным исходом. Ступенчатая (каскадная) теория патогенеза (рис. 1), допускающая участие на разных этапах различных патофизиологических механизмов повреждающего воздействия, позволяет использовать в определенный момент при лечении конкретного больного наиболее действенное сочетание терапевтических воздействий, лекарственных средств и препаратов.
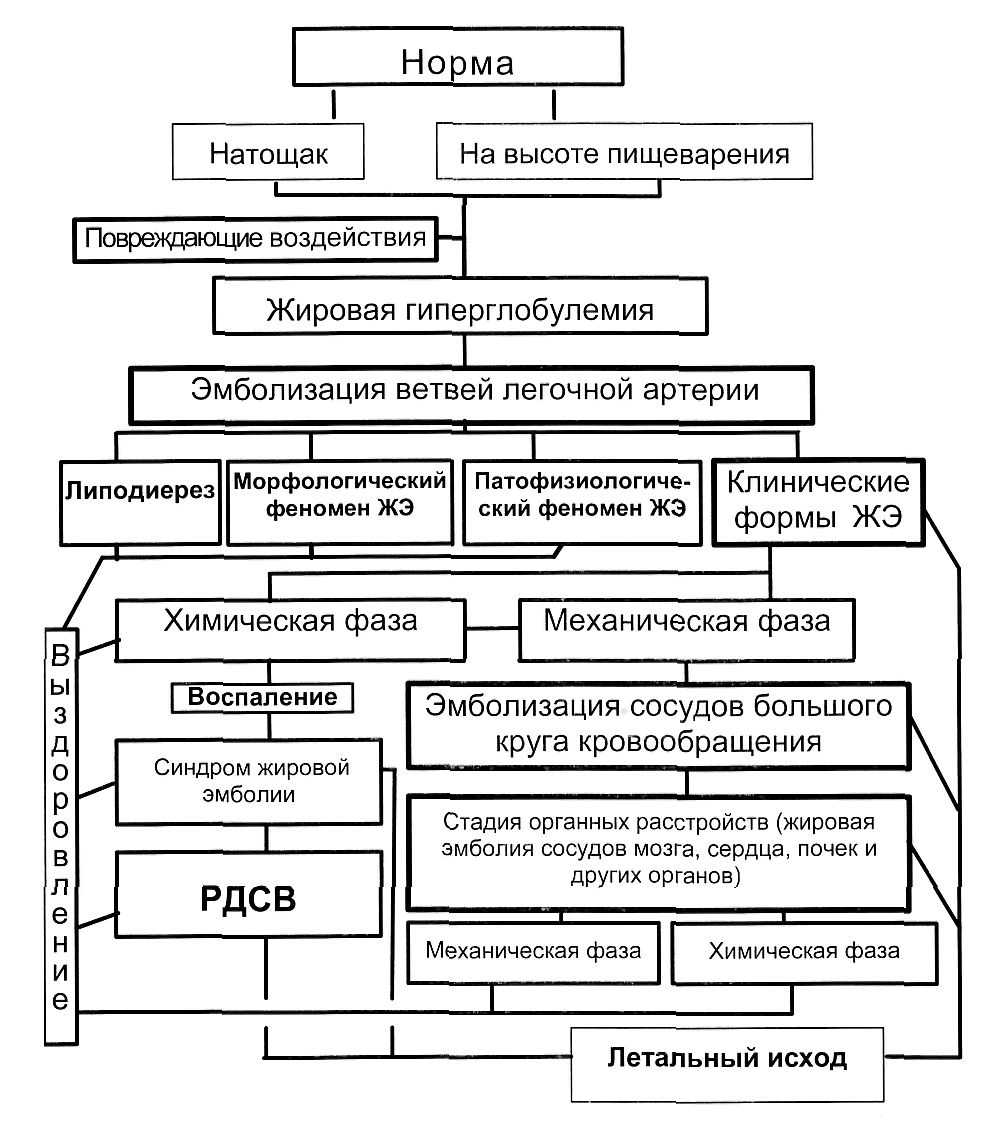
Рис. 1. Структурная схема патогенеза жировой эмболии
При ортопедических операциях постоянно присутствуют факторы, способствующие проявлению как патофизиологического феномена, так и клинических проявлений жировой эмболии. К ним следует отнести: нарушение целости кости и разрушение на большом протяжении содержимого костномозгового канала; отсутствие способности к спадению и зияние сосудов кости, широкий просвет её вен; жировое перерождение костного мозга с возрастом и изменение консистенции внутрикостного жира; нежность жировых клеток костного мозга. Сразу же после разреза подкожной жировой клетчатки хорошо видимые капли жира появляются в ране. После рассечения кости значительно большее количество крупных жировых капель стекает в рану, и показывается тающий при прикосновении к нему жировой костный мозг. Во время обработки костномозговой полости резкое повышение костномозгового давления в ходе рассверливания сопровождается интравазацией поврежденной ткани костного мозга. Повышение внутрикостного давления при имплантации бедренного компонента эндопротеза на цементе доказано экспериментальными и клиническими исследованиями. Биологически это давление уравнивается посредством венозной дренажной системы, расположенной в linea aspera и дистальном метафизе. Интравазация костного мозга, жира и «дебриса» ведет к характерным клиническим признакам более или менее заметной эмболии легкого, которая проявляется интраоперационно падением кровяного давления и рСО2 конца выдоха. Чтобы избежать биологического самодренажа, логично обеспечить достаточное дополнительное дренирование костномозговой полости бедренной кости через транскортикальное вентильное отверстие дистальнее предполагаемого нахождения кончика ножки протеза, наряду с помещением в канал костной пробки в тех случаях, когда цемент подается под высоким давлением. Если создать вакуум в костномозговой полости, чтобы цемент втягивался в губчатую кость, можно ожидать оптимального результата цементирования в сочетании с минимальным риском для пациента. В эксперименте установлено, что основная часть жировых эмболов формировалась именно при работе сверлом-разверткой, а не вследствие повышения интрамедуллярного давления, роль которого второстепенна. При эндопротезировании тазобедренного или коленного суставов увеличение внутрикостного давления стимулирует выход костного мозга в кровяное русло более чем у 90% пациентов. При этом 3 - 4% из них демонстрируют синдром жировой эмболии с вовлечением легких, мозга и петехиальными высыпаниями; приблизительно у каждого пятого возможно его молниеносное и фатальное течение. Жировые капли из места операции достигают правого предсердия в течение тотального эндопротезирования тазобедренного сустава. AW. Elmaraghy с соавторами установили, что присутствие мономера метилметакрилата не оказывало никакого влияния на распространенность или гемодинамические проявления легочной жировой эмболии, обусловленной рассверливанием и обработкой костномозгового канала бедренной кости. Результаты их направленного исследования не подтвердили гипотезу, согласно которой костный цемент на основе ПММА вызывает агглютинацию хиломикронов плазмы, способствующую легочной жировой эмболии. Для повышения качества цементной мантии костный цемент подают под высоким давлением с использованием цементного пистолета и обтуратора, помещенного в верхний отдел костномозговой полости бедренной кости. Однако, как показал приведенный P.D. Marshall с соавторами случай фатальной жировой эмболии, такие приемы не свободны от осложнений. В статье P.W. Pinto проанализированы некоторые вероятные причины побочных эффектов костного цемента при ортопедических операциях. Они включают эмболию жиром, воздухом, тканью костного мозга, периферическую вазодилятацию, активацию каскада свертывания в пределах легких, прямое сердечно-сосудистое депрессивное влияние костного цемента или мономера метилметакрилата. J.S. Arroyo с соавторами сообщили о случае жировой эмболии при бесцементной имплантации биполярного эндопротеза, закончившейся смертью больного. D. Galdermans с соавторами представили пациентку с прогрессивной дыхательной недостаточностью, вызванной легочной жировой эмболией, что было засвидетельствовано при открытой биопсии легкого. За четыре с половиной года до этого ей было выполнено внутрисуставное эндопротезирование тазобедренного сустава на костном цементе. Авторы предположили, что эмболизация костным мозгом была обусловлена асептическим расшатыванием имплантата. Риск жировой эмболии возрастал при использовании внутрикостной фиксации компонентов тотального эндопротеза. Для его снижения должны использоваться рифленые ножки и вентильные отверстия. В начальном периоде освоения эндопротезирования тазобедреного сустава была выявлена следующая закономерность. При нарушении целостности кости (и мягких тканей) в ходе оперативного вмешательства, и особенно при введении в костномозговой канал бедренного компонента эндопротеза и цемента под давлением, отмечено развитие «синдрома имплантации». Косвенными признаками этого служили изменения гемодинамики и газообмена, выявленные при интраоперационном мониторном наблюдении. Иногда гипотония после рассверливания костномозгового канала бедренной кости возникала и без последующего внедрения цемента. При этом не было отмечено нарушений ритма сердечных сокращений и признаков гипоксии миокарда, что побудило исследовать причины гемодинамической нестабильности. Анализ результатов наблюдений показал, что продуктам неполной полимеризации костного цемента не принадлежит основная роль в возникновении описанных проявлений. Вероятной их причиной послужила микроэмболия ветвей легочной артерии. Попадание в кровоток жира костного мозга с последующим слиянием мельчайших капель жира, присутствующих в плазме в виде эмульсии, совместно вызывало появление крупных капель, способных закупорить сосуды. Частота клинически выраженной жировой эмболии составила, по нашим данным, 17 случаев на 339 операций экстренного однополюсного эндопротезирования, 2 случая на 412 операций тотального эндопротезирования тазобедренного сустава в плановом порядке и 3 - на 110 ревизий ранее установленного эндопротеза. На 977 операций эндопротезирования тазобедренного и коленного суставов пришлось 12 смертельных исходов, связанных с жировой гиперглобулемией и эмболией, что свидетельствует о реальной опасности развития тяжелых, иногда жизнеопасных осложнений, обусловленных нарушениями жирового обмена и эмульсионной способности жиров плазмы при этих вмешательствах. В трех случаях этого осложнения, приведшего к смерти в первые 30 часов после тотального и однополюсного эндопротезирования тазобедренного сустава, обнаружены выраженная гипоксемия, гиперкапния, элементы массивной жировой эмболии (секционный материал) сосудов легких, почек и миокарда (рис. 2, 3, 4).
|
|
|
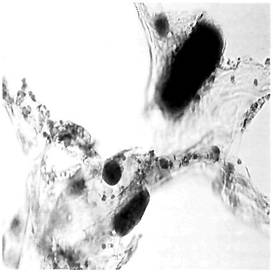
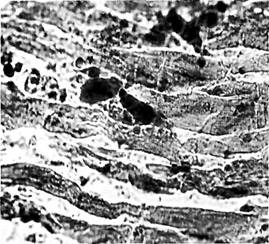
Рис. 2. Жировая эмболия сосудов легких (судан III, ув. х 90) |
Рис. 3. Жировая эмболия сосудов клубочка почек (судан III, ув. х 90) |
Рис. 4. Жировая эмболия сосудов миокарда (судан III, ув. х 90) |
Эффективным способом обнаружения феномена гиперглобулемии служат методики, основанные на определении размеров и числа жировых глобул в сыворотке и плазме крови путем микроскопирования после предварительной их окраски. Для выявления жира исследовали цитратную плазму крови на различных этапах эндопротезирования, используя краситель судан III и микроскопию в проходящем свете. Количество жировых капель диаметром более 8 микрон подсчитывали при увеличении в 280 раз. Через три минуты после внедрения бедренного компонента эндопротеза тазобедренного сустава в 12 из 16 случаев выявлена выраженная жировая гиперглобулемия, интенсивность которой в 2 - 3 раза превышала результаты определения жировых глобул в плазме тех же пациентов, взятой до операции. Анализ полученных данных позволил установить следующее:
у абсолютного большинства больных после обработки костномозговой полости в крови обнаруживается значительное количество жировых капель;
после внедрения бедренного компонента эндопротеза число их возрастает;
после установки обоих компонентов увеличивается количество жировых капель с повышенной адгезией к стеклу;
в отдельных случаях существенная жировая гиперглобулемия имеется при отсутствии клинических проявлений ЖЭ;
удается выявить в плазме крови суданофильные включения плотной консистенции, на поверхности которых имеются мелкие капли жира.
Профилактика жировой эмболии. На стадии предшествующих жировой эмболии патологических изменений профилактические меры должны быть направлены на устранение факторов, способствующих проникновению жира в кровоток, укрупнению жировых капель, и на снижение рефлекторного ответа на начинающуюся эмболизацию микрососудистого русла малого круга кровообращения. К хирургическим мерам профилактики жировой эмболии при эндопротезировании крупных суставов конечностей относится применение современных технологий установки имплантатов и конструкций, требующих минимального нарушения целостности содержимого костномозговой полости. В случаях эндопротезирования тазобедренного сустава в порядке экстренной помощи при переломах проксимального отдела бедренной кости лицам преклонного возраста в связи с выраженным остеопорозом и изменением консистенции жира костного мозга опасность его интравазации особенно велика, что требует использования всех возможных приемов предотвращения избыточного давления в костномозговой полости. Как при тотальном, так и при однополюсном замещении тазобедренного сустава наибольшую опасность в отношении интравазации жира представляют этапы обработки костномозгового канала бедренной кости, внедрения бедренного компонента эндопротеза, особенно при цементной его фиксации. В последнем варианте обязательно выполнение приемов, препятствующих резкому повышению давления в обработанной полости. Простейшими из них являются: помещение пробки из губчатого вещества удаленной головки бедренной кости ниже кончика внедряемой ножки эндопротеза; введение дренажной трубки до дистальных отделов полости на время подачи цемента. Особо опасным с точки зрения массивной интравазации жировых капель является промежуток времени от остеотомии до завершения имплантации компонентов эндопротеза. Сильные удары по остеотому при ненарушенной целостности кости могут вызвать поступление жира в вены костного мозга. Вскрытие костномозговой полости бедренной или большеберцовой кости вызывает истечение его наружу, а последующее рассверливание обнажает просветы сосудов как кости, так и костного мозга, открывая доступ в них жидкого жира. Каждое внедрение рашпиля, тест-протеза, костного цемента (особенно шприцем или цементным пистолетом) обусловливает поступление жира, тканевого детрита, воздуха в кровоток. К хирургическим мерам профилактики жировой эмболии относятся техника оперирования без сильных ударов по неповрежденной бедренной кости, включающая постепенное вскрытие костномозговой полости, удаление жировоперерожденного костного мозга, дренирование её дистальных отделов перед введением костного цемента, а также исключение грубых повторных внедрений сверла, бедренного компонента эндопротеза, особенно при цементном его креплении. При обработке костномозговой полости и внедрении инструментов (сверла, развертки, рашпили), тест-протезов и компонентов искусственного сустава следует избирать щадящие приемы. Перед внедрением цемента необходимо путем дренирования дистального отдела костномозговой полости предотвратить пиковое повышение внутрикостного давления. Все погружные конструкции следует вводить медленно. При ревизионном эндопротезировании, насколько можно судить по данным литературы, опасность эмболизации жиром меньше в связи с облитерацией сосудов костномозговой полости. Однако наш опыт свидетельствует о высокой вероятности развития тяжелой интраоперационной жировой эмболии при замене нестабильного эндопротеза как тазобедренного, так и коленного сустава. Для профилактики интравазации костных, костномозговых фрагментов и жира большое значение имеет исключение гемодинамической нестабильности и резкого снижения центрального и местного венозного давления, особенно в момент внедрения компонентов эндопротеза, что часто совпадает с пиком интраоперационной кровопотери, гиповолемии, сокращением венозного притока со снижением уровня центрального венозного давления или без этого. Все перечисленные изменения гемодинамики могут способствовать попаданию в кровоток тканевых фрагментов и жира. Поддержание достаточного уровня волемии, обеспечение стабильности гемодинамических показателей и адекватное обезболивание являются важными факторами профилактики жировой эмболизации. Свойства инфузионных сред, применяемых для борьбы с гиповолемией, в известной мере определяют эффективность превентивной терапии. Гипертонические растворы глюкозы, особенно в смеси с раствором новокаина, препараты белка (альбумин), в определенной степени декстраны оказывают разнонаправленное защитное действие, снижая выраженность липолиза, препятствуя проявлению токсического влияния свободных жирных кислот и улучшая условия центрального и периферического кровотока. Непосредственно перед подачей костного цемента следует максимально адекватно восполнить кровопотерю кровезаменителями, внутривенно вводят 30 - 90 мг преднизолона; на момент внедрения цемента и бедренного компонента рекомендуется исключить из газонаркотической смеси закись азота. При признаках массивного поступления микроэмболов в систему легочной артерии стабилизацию артериального давления в отдельных случаях обеспечивает медленная инфузия 120 - 240 мг эуфиллина. Поскольку очевидно, что при жировой эмболии первичное поражение сосудов легких является основным фактором патологии, а гипоксемия - прямым следствием обтурации значительной части капилляров и внутрилегочного шунтирования, дополнительная оксигенация выступает в качестве первоочередной симптоматической и заместительной терапии. Особенное внимание в плане поддержания дыхательной функции легких должно быть обращено на пациентов, у которых выявлено значительное снижение парциального давления кислорода в артериальной крови (рO2а ниже 65 мм рт. ст.) или установлена явная гиперглобулемия прямым определением количества и характеристик жировых капель цитратной плазмы венозной крови. О высокой выраженности гиперглобулемии при восполненной кровопотере можно судить по значительной тахикардии. В диагностическом отношении выраженная тахикардия при эндопротезировании крупных суставов не является постоянным симптомом эмболизации мелких ветвей легочной артерии, особенно у больных пожилого и преклонного возраста. Чаще наблюдаются преходящая артериальная гипотония, нарастающая гипоксемия без явной гиперкапнии. При отсутствии гиперкапнии возможно увеличение содержания кислорода во вдыхаемой смеси до 70 - 80%, однако предпочтительнее использовать концентрацию O2 до 40%, сочетая её при невозможности обеспечить достаточный уровень оксемии с дыханием в режиме положительного давления в конце выдоха. Из лекарственных средств специфической профилактики на стадии предшествующих патологических изменений и в механической фазе жировой эмболии назначают эмульгаторы в профилактических дозах: липостабил (первоначальная доза 40 мл, поддерживающая - 20 мл 4 раза в сутки), эссенциале. Н.П. Миронов с соавторами с целью восстановления физиологического растворения дезэмульгированного жира в крови, профилактики дезэмульгирования применяли липостабил (50-120 мл/сут). Указывали, что и другой, весьма сходный с липостабилом препарат - эссенциале, также способствует переходу дезэмульгированных капель жира в состояние тонкой дисперсии. Большинство исследователей подтвердили высокую профилактическую эффективность стероидных гормонов и их фармакологических аналогов -гидрокортизона, преднизолона, метилпреднизолона, триамцинолона. Для преднизолона рекомендуется начальная доза 60 - 90 мг, метилпреднизолона - до 40 мг и повторное введение их в течение первых трех суток. М.Б. Борисов и С,В. Гаврилин при тяжелых сочетанных травмах применяют базисное введение преднизолона в дозе 15 мг/кг массы тела и сразу же после установления диагноза жировой эмболии одномоментно вводят 30 мг/кг с последующим введением по 15 мг/кг каждые 12 часов. Для снятия рефлекторного спазма артериол в бассейне легочных артерий возможно введение ганглиолитиков внутривенно капельно или фракционно методом тахифилаксии (пентамин 50 мг). Сердечные гликозиды в обычных терапевтических дозах обеспечивают инотропный эффект без увеличения потребности миокарда в кислороде и в механической фазе преимущественно легочной формы жировой эмболии могут предупредить развитие сердечной недостаточности и способствовать переживанию больным критического периода. При лечении начальных признаков острой сердечной недостаточности прибегают к допамину и добутрексу в дозе от 3 до 15 мкг/кг/мин. С профилактической целью и в составе превентивной терапии рекомендованы ингибиторы протеолитических ферментов: контрикал или трасилол от 300 тысяч до 1 - 2 млн ед/сут; гордокс по 10 - 20 тысяч ед/сут. Использование этилового спирта и гепарина в раннем периоде после травмы для профилактики жировой эмболии нецелесообразно. В результате улучшения анестезиологического обеспечения клинические проявления жировой эмболии нередко отодвигаются на послеоперационный период. Это вызывает необходимость сердечно-дыхательного мониторинга (показатели артериального давления, ЧСС, SO2a) до 24 часов после операции. В начальном периоде механической фазы жировой эмболии, то есть в то время, когда количество жировых капель в системе микрососудов легочной артерии начинает превышать способность легочной паренхимы осуществлять липодиерез, дыхательная недостаточность является паренхиматозной. Участие в ней вентиляционного компонента возможно только при наличии сопутствующих заболеваний или побочного действия лекарственных препаратов. Постепенно нарастает число обтурированных жиром артериол и капилляров. Нарушение легочного кровотока при эмболии мелких ветвей легочной артерии жиром служит лишь начальным, пусковым механизмом, но не главным фактором в сокращении перфузии легких. Лечение механической фазы жировой эмболии. При лечении механической фазы жировой эмболии легких необходимо продолжать меры, предотвращающие циркуляцию крупных жировых глобул в кровотоке и соответственно поступление их в легочное сосудистое русло, обеспечить достаточную перфузию легочной ткани и трансмембранный газообмен, снять рефлекторный спазм необтурированных микрососудов легких. Последний фактор представляет самый значительный резерв компенсации состояния сердечно-легочной системы пострадавшего. Рассчитывать на намеренное растворение жировых капель, внедрившихся в легочные артериолы и капилляры, лекарственными препаратами не приходится. Камнем преткновения в системном использовании факторов, которыми предполагается воздействовать на эмболы нейтрального жира или продукты их гидролиза, является тот факт, что сосуды, по которым лекарственное средство должно достичь эмболов, сами закупорены жировыми каплями. Кроме того, к инфузии лекарств и/или растворов направленного действия всегда имеются определенные противопоказания. Начатая в ходе профилактики жировой эмболии ингаляция кислорода должна быть продолжена. В случае неэффективности превентивной интенсивной терапии или постепенного нарастания гипоксемии на фоне вдыхания воздушно-кислородной смеси может потребоваться использование специальных приемов. К ним относится самостоятельное дыхание с положительным давлением в конце выдоха. Лечебное действие этого режима спонтанного дыхания при жировой эмболии малого круга обусловлено тем, что положительное давление в дыхательных путях увеличивает размеры функционирующих альвеол, раскрывает коллабированные альвеолы, благодаря чему снижается альвеолярный шунт, улучшаются вентиляционно-перфузионное соотношение и газообмен. Величину давления подбирают опытным путем так, чтобы обеспечить наивысший уровень рO2 а при концентрации вдыхаемого кислорода менее 30%. ПДКВ до 10 см вод ст (1 кПа) не нарушает гемодинамику, при 15 - 25 см вод ст (1,5 - 2,5 кПа) для предотвращения снижения сердечного выброса может понадобиться увеличение ОЦК. А. П. Зильбер рекомендовал применение ПДКВ на уровне 6 - 8 см вод. ст. (0,6 - 0,8 кПа). Газовый состав артериальной крови характеризует эффективность газообменной функции легких, в то время как альвеолярно-артериальное различие по кислороду может служить критерием неэффективности газообмена через легочную мембрану. Желательно контролировать газовый состав крови не реже двух раз в сутки, а также через час после изменения режима дыхания. Функциональные критерии тяжести острой дыхательной недостаточности, требующей проведения искусственной вентиляции легких, включают возрастание частоты дыхания свыше 35 в минуту, величину альвеолярного шунта, превышающую 20% минутного объема кровообращения, рO2 а ниже 60 мм рт ст и повышение рСO2а сверх 55 мм рт ст при ингаляции чистого кислорода, декомпенсированный ацидоз при дыхании воздухом. Не утратило своего значения внутривенное введение альбумина, эмульгаторов, диспергентов. Альбумин позволяет сохранить внутрисосудистый объем, достаточный уровень перфузии тканей и уменьшает опасность синдрома жировой эмболии связыванием жирных кислот. Способность перфторана устранять клинические признаки жировой эмболии выявлена в процессе клинической апробации и подтверждена экспериментально. Вероятно, это обусловлено несколькими факторами. Во-первых, он представляет собой жидкий сорбент с площадью активной поверхности равной 600 м2 на каждые 100 мл эмульсии. Таким образом, если каждый миллилитр перфторана связывает 10 мг липидов, то 400 - 3000 мл могут изъять из циркуляции путем сорбции 4-30 г липидов - основы жировых эмболов. Кроме того, незначительная вязкость (вдвое меньше вязкости крови), гиперосмолярность эмульсии перфторана, наличие в её составе избыточного количества поверхностно-активного вещества проксанола способствуют спадению отека, диуретическому эффекту, доставке кислорода тканям, удалению углекислого газа. Перфторан повышает секреторную активность слизистой оболочки трахеобронхиального дерева, чем улучшает дренаж легких. Его введение больным с респираторным дистресс-синдромом, пневмонией, застойными явлениями в легких облегчает отхождение мокроты, уменьшает рентгенологические признаки уплотнения паренхимы легких, интерстициального и альвеолярного отека, улучшает параметры внешнего дыхания, снижает выраженность гипоксии, восстанавливает эффективность спонтанного дыхания. Представляется патогенетически обоснованным назначение перфторана при синдроме жировой эмболии в ранние сроки. Помимо своей кислородотранспортной функции перфторан способствует исчезновению патологических форм эритроцитов; снижает уровень субстратов перекисного окисления липидов, является хорошим сорбентом, связывающим липидную основу эмболов. Нельзя исключить прямого положительного действия проксанола на характеристики жировых капель в кровотоке. Вполне вероятно, что остаточный проксанол перфторана, введенного в вену при наличии жировой гиперглобулемии, способствует сокращению размеров жировых капель и обеспечивает эмульсионную стабильность вновь образовавшихся капель. Имеются достаточные основания считать, что эуфиллин расширяет сосудистое русло малого круга у больных с легочной гипертензией различного происхождения. В основе этого эффекта лежит главным образом понижение тонуса легочных сосудов в результате непосредственного действия препарата на мускулатуру их стенки. Он расслабляет мускулатуру бронхов, понижает сопротивление кровеносных сосудов и давление в системе легочной артерии, расширяет венечные сосуды сердца, увеличивает почечный кровоток. При жировой эмболии немаловажной представляется способность эуфиллина улучшать мозговое кровообращение, уменьшая отек мозга, а также свойство отчетливо тормозить агрегацию тромбоцитов. При отсутствии противопоказаний, к которым следует отнести нарушения ритма сердечных сокращений по типу тахиаритмии, эуфиллин следует вводить по 10 мл 2,4% раствора вместе с инфузионными средами, не меняющими его свойств, 2-3 раза в сутки. Кортикостероиды являются лекарствами, которые устойчиво демонстрируют положительное действие по предотвращению и лечению легочных нарушений. Пик их популярности пришелся на 70-е и ранние 80-е годы, однако ряд исследований последних лет не подтвердил благоприятного влияния этих препаратов на клиническое течение синдрома жировой эмболии. Некоторые клиницисты рекомендовали их из-за общего противовоспалительного эффекта, несмотря на осложнения, сопутствующие применению стероидов. Для устранения вызванных местным действием свободных жирных кислот повышенной проницаемости капиллярного ложа, деструкции альвеол и повреждения легочного сурфактанта использование гидрокортизона следует считать вполне оправданным. Противопоказания к назначению кортикостероидов в массивных дозах при множественных повреждениях включают повышенный риск септических осложнений и нарушения иммунореактивности. По всей вероятности, лучше назначать средние дозы гидрокортизона гемисукцината (50 - 200 мг/ сут), преднизолона гемисукцината (30 - 60 мг/сут), или метилпреднизолона (24 - 48 мг/сут) каждые 6 часов в течение первых трех суток. Последний из препаратов почти лишен ульцерогенного эффекта. Включение гепарина в комплекс лечения жировой эмболии связано с широко распространенными представлениями о его липолитической способности. Давно известно, что помутнение сыворотки крови, взятой после принятия жирной пищи, которое связано с хиломикронемией и повышением содержания липопротеидов очень низкой плотности, устраняется в течение нескольких минут после внутривенного введения гепарина. Это свойство сыворотки крови обозначили как постгепариновую липолитическую активность. Многие авторы считают применение гепарина для диспергирования травматической липемии противопоказанным, потому что одним из окончательных продуктов реакции липопротеинлипазы с жиром являются свободные жирные кислоты. Гепарин, по их мнению, не дает значительной выгоды и должен быть исключен из перечня лекарственных средств терапии жировой эмболии. Если в первые часы после травмы к назначению прямого антикоагулянта, каковым является гепарин, имеются определенные противопоказания, то при лечении жировой эмболии в более поздние сроки имеет смысл прибегать к нему не столько из-за липолитической активности,сколько в связи с воздействием на агрегацию тромбоцитов, проявления диссеминированного свертывания в системе микроциркуляции и противовоспалительным эффектом. Ценность внутривенного использования алкоголя при лечении жировой эмболии, если она существует, вероятно, определена ингибированием им фермента липазы, снижением липолиза эмболов нейтрального жира и образования свободных жирных кислот. Мы разделяем мнение D. Levy о том, что этиловый спирт, также как и гепарин не дает значительной выгоды и не должен использоваться внутривенно при лечении жировой эмболии. В отдельных случаях острого отека легких возможно проводить ингаляцию кислорода через спирт с целью пеногашения. Как для патогенетического лечения в начальный период жировой эмболии, так и для дезинтоксикации Н.П. Миронов с соавторами применяли с обнадеживающими результатами гипохлорит натрия. Раствор, являющийся донатором атомарного кислорода, вводили в центральную вену в концентрации 600 мг/л в дозе 10-15 мг/кг со скоростью 2- 3 мл/мин; его применяли через день курсами продолжительностью до одной недели. Интенсивная терапия химической фазы жировой эмболии. Сущность второй, химической фазы легочной эмболии сводится к вредоносному действию образовавшихся неэстерифицированных жирных кислот на эндотелий легочных капилляров и легочную паренхиму. По мнению L.F. Peltier, P. Rokkanen с соавторами, G.N. Weisz и A. Brazilai, повреждение легких с последующим развитием дыхательной недостаточности относится к наиболее важным клиническим проявлениям ЖЭ. Легкие отвечают на наличие эмболов нейтрального жира секрецией липазы, что является нормальной реакцией, ведущей к гидролизу жира до свободных жирных кислот и глицерола. Жирные кислоты, как указывалось выше, оказывают прямое токсическое влияние на клетки эндотелия, если они присутствуют в высоких локальных концентрациях и не связаны с альбумином. Свободные жирные кислоты, действуя местно, повышают проницаемость капиллярного ложа, вызывают деструкцию альвеол и неблагоприятно сказываются на легочном сурфактанте. Лечение химической фазы нужно осуществлять с момента начала ферментативного расщепления эмболического жира, а именно еще в механической фазе. Первоочередными задачами терапии на этом этапе становятся, наряду с преодолением последствий эмболизации микрососудистого русла преимущественно малого круга кровообращения, уменьшение образования токсичных неэстерифицированных жирных кислот, то есть, с одной стороны, выраженности липолиза. С другой стороны, свободные жирные кислоты, связанные с белками плазмы крови, не обладают токсичностью. Кроме того, их отрицательное воздействие на эндотелий капилляров и подлежащие ткани, прежде всего, проявляется там, где высокая их концентрация сочетается с резким замедлением кровотока, что увеличивает продолжительность контакта. Значительная роль, вне сомнения, принадлежит другим биологически активным веществам, высвобождающимся при разрушении форменных элементов крови (тучные клетки, тромбоциты). Повреждение паренхимы легких с нарушением свойств альвеоло-капиллярной мембраны и транскапиллярного газообмена, нарастанием интерстициального отека усугубляет гипоксемию. Симптоматика химической фазы жировой эмболии соответствует в большинстве случаев ранней или поздней прогрессирующей стадии синдрома дыхательных расстройств по Moore. При тяжелой степени гипоксемии, явной зависимости больного от кислорода, выраженных признаках отека легких легочный шунт достигает 20 - 30% минутного объема сердца. Признавая выживание больного в таком состоянии возможным, Г.А. Рябов считает при этом благоприятный исход скорее исключением, чем правилом. Мероприятия, описанные в предыдущем разделе, продолжают при необходимости и тогда, когда можно заподозрить наступление химической фазы жировой эмболии. В частности, полноценная аналгезия (использование регионарной и проводниковой анестезии) в сочетании с препаратами б-симпатолитического действия (дроперидол по 0,05-0,1 мл/кг) ограничит высвобождение свободных жирных кислот. J.A. Moylan с соавторами обнаружили у больных с симптомами жировой эмболии более резкое уменьшение содержания альбумина сыворотки крови, чем при отсутствии этого осложнения: 2,8 г/ 100 мл и 3,6 г/100 мл соответственно. Они высказали предположение, что при выраженном снижении уровня альбуминов создаются условия для появления в крови не связанных с белками свободных жирных кислот, обладающих токсическим действием. Это делает необходимым назначение белковых препаратов (альбумин) для связывания их избытка. Обычная доза составляет 200 - 300 мл 5 - 10% раствора в сутки. Один из механизмов повреждения легких - рефлекторная вазоконстрикция и бронхоспазм вследствие освобождения серотонина, простагландинов и других гуморальных факторов осажденными в легких жировыми глобулами и тромбоцитами. Следовательно, лечебным действием будут обладать инфузии глюкозо-новокаиновой смеси, введение эуфиллина. Факторы, подавляющие секрецию липазы в продолжение латентного периода, могут быть использованы с целью профилактики химической фазы, предупреждая быстрый гидролиз нейтрального жира до жирных кислот. А.Ю. Пащук, А.В. Иванова, А.И. Трещинский, Г.А. Васильев, Ю.Н. Шанин, В.Ю. Шанин, Н.П. Миронов рекомендовали, помимо специфической профилактики и лечения, применение ингибиторов протеаз (трасилол, контрикал) по 1 - 2 млн КИЕ, гордокс по 100 тыс ед. Другой возможностью ингибирования является введение ионов кальция в плане иммобилизации свободных жирных кислот как кальциевых мыл. Вопрос о проведении искусственной вентиляции легких в химической фазе жировой эмболии возникает при невозможности поддерживать достаточный уровень оксигенации артериальной крови при спонтанном дыхании кислородовоздушной смесью даже в режиме положительного давления в конце выдоха. Показанием к ней служит рО2а < 60 мм рт ст при дыхании кислородом. Режим вентиляции подбирается таким образом, чтобы не создавать дополнительное препятствие внутрилегочному кровотоку и, постепенно урежая частоту дыхательных циклов и снижая концентрацию O2 во вдыхаемой смеси, обеспечить необходимое насыщение артериальной крови кислородом. При преобладании гипоксемии и нормокапнии А.И. Трещинский, Г.А. Васильев считали перспективным применение длительной экстракорпоральной оксигенации с помощью мембранного оксигенатора. Никотиновая кислота снижает уровень холестерина и триглицеридов в плазме. Этот эффект, возможно, обусловлен антилиполитическим действием её в жировой ткани, в результате чего уменьшается концентрация неэстерифицированных жирных кислот. Для лечения больных с гиперлипидемией используют до 1 - 2 г никотиновой кислоты 3 раза в день при потребности организма в нормальных условиях менее 30 мг/сут. Влияние костного цемента Появление моделей эндопротезов, имплантируемых на цементе, внесло подлинную революцию в эндопротезирование и определило его дальнейшее развитие на многие годы вперёд. Первой на эту тему и основополагающей является работа J. Charnley. Её публикации предшествовали всесторонние исследования механических свойств костного цемента in vitro и in vivo, а также переносимости этого материала организмом. Эта работа считается поворотной в истории эндопротезирования. Автор пришёл к убеждению, что малого количества полиметилметакрилата (ПММА) не хватает для надёжного закрепления эндопротеза, предложил удалять губчатую кость из костномозгового канала и вводить туда вместе с ножкой эндопротеза быстро-твердеющий цемент под давлением. Заполняя всё свободное пространство между имплантатом и костным ложем, полиметилметакрилат должен был обеспечить не только его высокую первичную стабильность, но и распределение механической нагрузки на значительную поверхность кости. Несмотря на известные преимущества цементного крепления эндопротеза, всегда остаётся вероятность возникновения связанных с ним осложнений. Первоначально использование полиметилметакрилата нередко сопровождалось тяжелыми реакциями. Описаны случаи остановки сердца, инфаркта миокарда, эмболии лёгочной артерии жиром и воздухом после тотального замещения тазобедренного сустава. Гемодинамические нарушения и в настоящее время представляются непременной частью клиники осложнений, связанных с применением полиметилметакрилата. J.E. Tetzlaff считает их первичной причиной вазодилятацию гемодинамически активными составляющими цемента, к которым относятся мономер и в меньшей мере - фрагменты полимера. Если содержание мономера в плазме крови достигает значительного уровня, вероятным результатом этого станет гипотензия со вторичной тахикардией. Если вазодилятация комбинируется с высвобождением из тучных клеток гистамина, других сильных вазодилятаторов и депрессантов миокарда, возможна значительная гемодинамическая нестабильность. Выраженность её может усилиться, если она совпадает по времени с гиповолемией вследствие продолжающегося кровотечения, предшествовавшего использованию цемента. Избыточная реакция на введение полиметилметакрилата может наблюдаться на фоне гиповолемии после предшествующей терапии диуретиками, а также у пациентов, не способных ответить тахикардией на уменьшение внутрисосудистого объема в результате воздействия бета-блокаторов, спинальной или эпидуральной анестезии. Начали прибегать к внедрению цемента в поздних фазах полимеризации, когда количество мономера значительно снижается. Очистка коммерческих образцов цемента улучшила его качество, сделала более однородным; свойственная современным цементам ранняя полимеризация способствует снижению количества избыточного мономера. Однако исследование природы гемодинамических нарушений при внедрении костного цемента, выполненное Н. Rinecker, показало, что они не могут рассматриваться как изолированное токсическое влияние введенного полиметилметакрилата, а наиболее вероятно обусловлены микроэмболизацией и могут рассматриваться как ятрогенная модель острой легочной недостаточности. В связи с этим внедрение пластилинообразного костного цемента в качестве профилактической меры бесполезно и даже опасно из-за создания более высокого давления в костномозговой полости. Одним из свойств костных цементов на основе полиметилметакрилата, способных вызвать нежелательные последствия, является повышение температуры при их полимеризации. Косвенно об этом свидетельствует описание ожога седалищного нерва акриловым цементом при эндопротезировании тазобедренного сустава. При температуре цементной мантии в 72°С некроз кости возникает практически немедленно. Температура в 60°С приводит к некрозу уже через 5 секунд воздействия, при 55°С - через 30 секунд, и при 47°С - через 1 минуту. Считается, что первая фаза реакции костной ткани на цемент длится 20 суток. За это время в месте контакта кости с полиметилметакрилатом происходит её некротизация из-за гипертермии при полимеризации цемента и токсичности мономера. Улучшенные образцы костного цемента создают меньшую температуру при полимеризации, что нивелирует этот механизм повреждения.
Жировая эмболия очень опасна
Как давно известно медицине, 90% жировых эмболий является осложнением переломов костей, обычно крупных – таза, бедренной и берцовой кости. Как ни странно, но они часто возникают у молодых мужчин. По мнению экспертов в хирургии, это расстройство очень опасно и может быть смертельным.

У любого человека вне зависимости от возраста или состояния здоровья при переломах трубчатых костей или костей таза, множественных переломах или после операции на костном мозге может развиться жировая эмболия. Помимо костных переломов, ее причиной может быть сахарный диабет, острый панкреатит, ожоги, длительное лечение кортикостероидами, остеомиелиет и даже липосакция.
Большинство случаев жировой эмболии связано с повреждением костей таза, трубчатых костей и находящегося в них костного мозга. Высок риск возникновения жировой эмболии при хирургии на сердце, артропластике коленного или бедренного сустава или при пересадке костного мозга. Оказалось, что наиболее подвержены риску эмболии молодые мужчины, при этом у 10 % из них она приводит к смертельному исходу. Другими группами риска являются молодые люди в возрасте 20−40 лет с множественными переломами или же пожилые пациенты с переломами таза.
В настоящее
время в хирургии существуют две
теории возникновения жировой эмболии.
настоящее
время в хирургии существуют две
теории возникновения жировой эмболии.
Первая, механическая, считает причиной ее развития увеличение давления в костном мозге, вследствие манипуляций с ним или травматического повреждения, что приводит к попаданию жировых клеток мозга в кровь. Там они немедленно оказываются окруженными тромбоцитами и формируют микротромб, который двигается с кровотоком и попадает в различные органы, в том числе легкие и мозг, что чрезвычайно опасно.
Другая теория – биохимическая. Согласно ей, травма сопровождается гормональными изменениями и кроме того, может сочетаться развитием сепсиса – генерализованной инфекции. Это провоцирует выделение в кровь жиров в форме липопротеидов, которые прилипают в стенкам сосудов легких, вызывая их повреждение, уменьшение оксигенации крови и нарушения работы сердца и головного мозга.
Чтобы защитить больного от такого серьезного осложнения в хирургии, как жировая эмболия, для предупреждения попадания жира в кровеносные сосуды используют техники иммобилизации и стабилизации зоны перелома, а также методы контроля за функцией легких и улучшения дыхания. Несмотря на то, что в большинстве случаев хирургам удается справиться с этим грозным осложнением, нередко она протекает очень тяжело — с повреждением функций всех органов.
В первые
24−72 часа жировая эмболия может никак
себя не проявлять, оставаясь практически
бессимптомной. Признаками жировой
эмболии являются частое сердцебиение,
частое дыхание, петехии (маленькие
бордовые пятна на коже из за кровотечения
из мелких кожных капилляров и нарушения
свертываемости крови), высокая температура
и спутанность сознания.
первые
24−72 часа жировая эмболия может никак
себя не проявлять, оставаясь практически
бессимптомной. Признаками жировой
эмболии являются частое сердцебиение,
частое дыхание, петехии (маленькие
бордовые пятна на коже из за кровотечения
из мелких кожных капилляров и нарушения
свертываемости крови), высокая температура
и спутанность сознания.
Если жировой тромб, перемещающийся в кровотоке, останавливается в каком либо органе, это приводит к нарушению его функции, например, почечной недостаточности, инсульту или тяжелому нарушению дыхания. По данным хирургии, жировая эмболия характеризуется следующей триадой симптомов: появлением дыхательной недостаточности – в 96%, нарушениями работы головного мозга — в 59% и кожными высыпаниями( петехиями) — в 33%. Дорогие читатели, если Вы читаете эту статью не на сайте Посольства медицины, то она заимствована там неправомочно. В 1% случаев жировая эмболия приводит к молниеносной смерти больного, вызванной остановкой сердца.
Лечение жировой эмболии должно быть очень энергичным, и оно проводится в условиях отделения интенсивной терапии.
Жировая эмболия
В. К. Ожегов, Н. А. Духовник, Г. В. Юневич, А. И. Силич Новогрудское ТМО, ОАРИТ - травматологическое отделение
Технократические и социальные процессы в обществе (техническое вооружение труда, локальные военные конфликты, относительный рост криминализации и т.д.) неизбежно детерминируют рост травматизма.
Летальность от осложнений травматической болезни составляет 15-20% (Дерябин И.И., Насонкин О.С., 1987 г.). Жировая эмболия – одно из грозных осложнений травматической болезни.
Жировая эмболия - это множественная окклюзия кровеносных сосудов каплями жира. Впервые жировая эмболия упоминается в 1862 г., а сам термин предложен Ценкером, обнаружившим капли жира в капиллярах лёгких пациента, скончавшегося в результате скелетной травмы. Жировая эмболия сопровождает 60 - 90% скелетных травм (Блажко А.З.,1973, Shier M.R.,1980, Levy D.,1990), но синдром жировой эмболии (FES - fat embolism syndrome), когда появляется выраженная клиническая симптоматика, встречается лишь у 5 - 10% пострадавших (Зильбер А.П., 1984, Hiss J., 1996), а смерть развивается в 1 - 15% случаев (Сальников Д.И., 1989, Шапошников Ю.Г., 1977). Жировая эмболия встречается и при анафилактическом и кардиогенном шоке, панкреатите, клинической смерти с успешной реанимацией (Зильбер А.П., 1984).
Жировая эмболия нередко протекает под маской пневмонии, респираторного дистресс-синдрома взрослых, черепно-мозговой травмы и другой патологии, способствуя значительному увеличению летальности (Fabian Т.е., Hoots A.V.,Stanford D.S.1990).
Патогенез жировой эмболии многогранен. Существует несколько теорий патогенеза:
классическая: капли жира из мест повреждения попадают в просвет вен, далее с током крови - в сосуды легких, вызывая их закупорку. Это положение подтверждено патоморфологическими и патофизическими исследованиями (Szabo G.,1971,);
энзимная: источником гиперглобулемии являются липиды крови переходящие при травме под действием липазы из тонкодисперсной эмульсии в грубые капли (дезэмульгация), изменяя при этом поверхностное натяжение. Жировые эмболы из костного мозга активируют сывороточную липазу, а ее чрезмерная продукция приводит к мобилизации жира из жировых депо с дальнейшей дезэмульгацией;
коллоидно-химическая: под воздействием травмы липиды крови, находясь в состоянии тончайшей эмульсии, разрушаются, превращаясь в грубодисперсную систему (Lehman E., 1929.);
гиперкоагуляционная: все варианты посттравматических нарушений свертывания крови и все варианты нарушений липидного обмена находятся в патогенетическом единстве и представляют собой компоненты патологического состояния, названного посттравматической дислипидемической коагулопатией.
Начальным звеном в патогенезе жировой эмболии является расстройство микроциркуляции с изменениями реологических свойств крови. Замедление кровотока из-за гиповолемии, гипоксия — характерные черты любого критического состояния. Именно поэтому жировая эмболия может осложнять большинство из них. Системное нарушение жирового обмена приводит к заполнению микроциркуляторного русла тканей и органов каплями нейтрального жира диаметром свыше 6-8 мкм с последующим микротромбообразованием вплоть до ДВС, эндоинтоксикацией ферментами и продуктами метаболизма липидов (эндоперекиси, кетоны, лейкотриены, простагландины, тромбоксаны), системными повреждениями клеточных мембран в микроциркуляторном русле (системная капилляропатия), и, прежде всего в легких, которые задерживают до 80% жировых капель (Дерябин И.И., Насонкин О.С., 1987 г).
Катехоламины, концентрация которых значительно повышается при критических состояниях, являются основными липолитическими агентами (Рябов Г.А.,1994).
Расстройства микроциркуляции и повреждение клеточных мембран ведут к массивному отеку мозга, развитию респираторного дистресс-синдрома взрослых (РДСВ), сердечной недостаточности, почечной недостаточности, токсическому распаду эритроцитов и гипопластической анемии.
Патогенетическую роль в инициации синдрома жировой эмболии играет изменение морфологии эритроцитов, характерное для критических состояний. Помимо нормальных форм, способных к деформации и газообмену в капиллярах, значительно увеличивается количество патологических балластных форм (сфероцитов, микроцитов, серповидных, шиповидных), которые являются, по сути, скрытой формой дефицита глобулярного объема. Их количество значимо коррелирует с тяжестью и исходом травматического шока и травматической болезни (Миронов Н.П., Аржакова Н.И., Рябцев К.Л.,1996).
Классификация жировой эмболии включает следующие формы:
молниеносную, которая приводит к смерти больного в течение нескольких минут;
острую, развивающуюся в первые часы после травмы;
подострую — с латентным периодом от 12 до 72 часов.
Клинически же весьма условно выделяют легочную, церебральную и, наиболее часто встречающуюся, смешанную формы (Пащук А.Ю., Фадеев П.А.,1991)
Клиническая картина жировой эмболии проявляется следующей тетрадой:
симптоматика нарушений ЦНС, имеющая сходство с постгипоксической энцефалопатией (расстройства сознания и психики, приступы невыносимой головной боли, бред, делирий, умеренно выраженные менингеальные симптомы, нистагм, “плавающие” глазные яблоки, пирамидная недостаточность, парезы и параличи, возможны тонические судороги, депримация ЦНС вплоть до комы).
нарушения кардио-респираторной функции - рано возникающая острая дыхательная недостаточность по механизму РДСВ (сжимающие и колющие боли за грудиной, одышка или патологическое дыхание вплоть до апноэ, возможен кашель с кровавой мокротой, иногда пенистой, выраженное снижение SpO2 , при аускультации сердца слышен акцент второго тона над легочной артерией, ослабление везикулярного дыхания с наличием множественных мелкопузырчатых хрипов, стойкая немотивированная тахикардия (свыше 90·мин-1) у травматического больного считается ранним признаком развития синдрома жировой эмболии; в более тяжелых случаях — тахиаритмии и синдром малого выброса, связанные как с непосредственным поражением миокарда гипоксического, дисциркуляторного и эндотоксического характера, так и с легочной гипертензией).
капилляропатия вследствие действия свободных жирных кислот (петехиальные высыпания, проявляющиеся на коже щек, шеи, груди, спины, плечевого пояса, полости рта и конъюнктивы).
гипертермия по типу постоянной лихорадки (до 39-40°С), не купирующаяся традиционной терапией, связанной с раздражением терморегулирующих структур мозга жирными кислотами.
Верификация диагноза жировой эмболии осуществляется комплексом клинических и инструментально-лабораторных критериев (наличие капель нейтрального жира размером около 6 мкм в биологических жидкостях; диффузная инфильтрация легких при рентгенологическом исследовании, совпадающая с картиной "снежной бури" при РДСВ; стойкая немотивированная анемия, причинами которой являются патологическое депонирование крови и токсический распад эритроцитов; характерная картина глазного дна, описанная Patcher еще в 1910 г. - на фоне отечной сетчатки вблизи сосудов видны округлые, нерезкие облаковидные белесовато-серебристые пятна, т.е. картина травматической ангиопатии сетчатки глаза; изменения в моче, характерные для гломерулонефрита с высокой азотемией; балльная оценка субклинической формы жировой эмболии по А. Ю. Пащуку - тахикардия свыше 90 ударов в минуту - 20 баллов. гипертермия свыше 38°С - 10 баллов, признаки синдрома шокового легкого - 20 баллов, изменение сознания - 20 баллов, гипер- или гипокоагуляция - 5 баллов, олигурия - 5 баллов, цилиндрурия - 1 балл, повышение СОЭ - 1 балл, при сумме баллов в 10-20 определялась латентная и при сумме баллов больше 20 манифестная клинические формы жировой эмболии).
Лечение жировой эмболии включает специфические и неспецифические моменты:
Специфическая терапия:
- обеспечение адекватной доставки кислорода к тканям. Показанием к началу ИВЛ при подозрении на жировую эмболию является нарушение сознания больного в виде психической неадекватности, возбуждения, делирия или сомноленции даже при отсутствии клинических признаков дыхательной недостаточности, сдвигов КЩС и газов крови. Больные с тяжелыми формами жировой эмболии требуют проведения длительной ИВЛ. Критериями для прекращения ИВЛ служит восстановление сознания и отсутствие ухудшения оксигенации артериальной крови при дыхании больного атмосферным воздухом в течение нескольких часов. Также представляется целесообразным ориентироваться при переводе на самостоятельное дыхание на данные мониторинга ЭЭГ (сохранение альфа-ритма при самостоятельном дыхании и отсутствие медленных форм волновой активности).
- дезэмульгаторы жира в крови: к этим лекарственным средствам относят липостабил, дехолин и эссенциале. Действие этих препаратов направлено на восстановление растворения дезэмульгированного жира в крови. Дезэмульгаторы способствуют переходу образовавшихся жировых глобул в состояние тонкой дисперсии; липостабил применяется по 50-120 мл·сут-1, эссенциале назначается до 40 мл·сут-1.
- с целью коррекции системы коагуляции и фибринолиза применяется гепарин в дозе 20-30 тыс.ед.·сут-1. Показанием для увеличения дозы введения гепарина является увеличение концентрации фибриногена плазмы. Довольно часто у больных с СЖЭ, несмотря на гепаринотерапию, все же проявлялся ДВС-синдром. Резкое угнетение фибринолиза, появление продуктов деградации фибрина, снижение тромбоцитов ниже 150 тыс. является показанием для переливания больших количеств (до 1 л·сут-1) свежезамороженной плазмы и фибринолизина (20-40 тыс. ед. 1-2 раза·сут-1).
- защита тканей от свободных кислородных радикалов и ферментов включает интенсивную терапию глюкокортикостероидами (до 20 мг•кг-1 преднизолона или 0,5-1 мг•кг-1 дексаметазона в первые сутки после манифестации СЖЭ с последующим снижением дозы). Считается, что кортикостероиды тормозят гуморальные ферментные каскады, стабилизируют мембраны, нормализуют функцию гематоэнцефалического барьера, улучшают диффузию, предупреждают развитие асептического воспаления в легких. Применяли также ингибиторы протеаз (контрикал — 300 тыс. ед.•кг-1 в свежезамороженной плазме), антиоксиданты (ацетат токоферола — до 800 мг•кг-1, аскорбиновая к-та — до 5 г•кг-1).
- ранняя оперативная стабилизация переломов является важнейшим аспектом в лечении пациентов с синдромом жировой эмболии после скелетной травмы
Неспецифическая терапия:
дезинтоксикационная и детоксикационная терапия включает форсированный диурез, плазмаферез; применяется с обнадеживающими результатами как для патогенетического лечения в начальный период жировой эмболии, так и для дезинтоксикации гипохлорит натрия. Раствор, являющийся донатором атомарного кислорода, вводится в центральную вену в концентрации 600 мг•л-1 в дозе 10-15 мг•кг-1 со скоростью 2-3 мл·мин-1; его применяя.n через день курсами продолжительностью до одной недели.
парентеральное и энтеральное питание. Для парентерального питания используется 40% раствор глюкозы с инсулином, калием, магнием, аминокислотные препараты. Энтеральное питание назначают со 2-х суток. Применяются энпиты и лег-коусвоимые высококалорийные многокомпонентные смеси, включающие необходимый спектр микроэлементов, витаминов и энзимов.
коррекция иммунного статуса, профилактика и борьба с инфекцией проводится под контролем данных иммунологических исследований с учетом чувствительности иммунной системы к стимуляторам. Применяются Т-активин или тималин, γ-глобулин, гипериммунные плазмы, интравенозная лазерная квантовая фотомодификация крови.
профилактика гнойно-септических осложнений у больных с жировой эмболией включает применение селективной деконтаминация кишечника (аминогликозиды, полимиксин и нистатин) в сочетании с эубиотиком (бифидум-бактерин), при необходимости используют комбинации антибиотиков широкого спектра действия.
Следует помнить, лечить необходимо конкретного больного, а не жировую эмболию.
Приводим клиническое наблюдение:
Больной Т., 1951 г.р., доставлен бригадой СМП в Новогрудскую ЦРБ 16.04.2003г. с диагнозом: огнестрельное ранение верхней трети левого бедра, открытый оскольчатый перелом левой бедренной кости в верхней трети. В анамнезе – простудные заболевания, аллергологический анамнез не отягощён. При поступлении состояние тяжёлое. В сознании. Бледен. ЧД 20·мин‾?. В лёгких везикулярное дыхание. Границы сердца не расширены, тоны ритмичны, приглушены. ЧСС= PS= 114·мин-1 ритмичный, удовлетворительного наполнения и напряжения, AD 90/60 mm Hg. Живот мягкий, безболезненный. Печень у края рёберной дуги. Поколачивание поясничной области безболезненно с обеих сторон. Status locales: на коже левого бедра в верхней трети три раны до 1см в диаметре по внутренней, наружной и задней поверхностям на уровне большого вертела, определяется патологическая подвижность в верхней трети бедра. На рентгенограмме определяется оскольчатый перелом бедренной кости в верхней трети со смещением отломков по ширине. В мягких тканях инородные металлические тела. В гемограмме: RBC 3,75•1012·l1-1; Hgb 122 g·l-1; Hct 0,45; WBC 14,5•109•1-1; формула: палочкоядерные 0,13 , сегментоядерные 0,80 , лимфоциты 0,07 ; СОЭ 12 mm•h‾?. Общий анализ мочи без особенностей. Биохимические показатели без отклонений от нормы. После предоперационной подготовки, включающей продолжение корректной аналгезии с использованием наркотических аналгетиков, антибактериальную и инфузионную терапию с использованием глюкозированных растворов, кристаллоидов и декстранов в соотношении 1:2:1, стандартной премедикации больной доставлен в операционную. Под GETA выполнена ПХО огнестрельных ран, удалены свободнолежащие кусочки костной ткани, инородные тела в виде кусочков мягкого металла до 15 mm в поперечнике неправильной формы, опорожнена гематома до 600-700 ml, полости промыты раствором фурациллина, дренирование ран. Спустя 22 минуты от начала операции у больного внезапно появилась неяркая петехиальная сыпь в подмышечных областях (момент появления совпадает с опорожнением гематомы в области перелома), SpO2 снизилась до 79, появилась анизокория (S>D, фотореакция не определяется), наступила остановка сердечной деятельности в виде асистолии. Проводившаяся СЛР (прекардиальный массаж на фоне продолжающейся IPPV с увеличением подачи кислорода до 100% , стандартное медикаментозное обеспечение) принесла эффект, через 6 минут восстановилась сердечная деятельность с синусовым ритмом, показатели гемодинамики стабилизировались, SpO2 возросла до 92. В постоперационном периоде в ОАРИТ была продолжена IPPV , проводилось скелетное вытяжение на шине Беллера с грузом 7 kg (в связи с наличием в ране множества мелких инородных металлических тел – осколков пуль – погружной металлоостеосинтез не производился), проводилась антибактериальная терапия, корректная аналгезия, инфузионная терапия с использованием поливалентных ингибиторов протеаз, липостабила, коррекция реологии крови низкомолекулярными гепаринами, глобулярный объём корригировался эритроцитарной массой, проводилась интравенозная лазерная квантовая фотомодификация крови. После стабилизации состояния больного осуществлено отлучение пациента от респиратора, гемодинамика стабильна, имевшая место ранее азотемия исчезла, биохимические показатели в пределах нормы, в общем анализе мочи капельки жира больше не обнаруживаются, дальнейшее лечение осуществлялось в травматологическом отделении. В удовлетворительном состоянии выписан домой. В данном случае имела место церебральная форма жировой эмболии, осложнившая течение огнестрельного перелома бедренной кости и благополучно купированная.
Вестник интенсивной терапии, 1996 г., № 2-3. ИТ при тяжелой травме.
СИНДРОМ ЖИРОВОЙ ЭМБОЛИИ КАК ОСЛОЖНЕНИЕ ТРАВМАТИЧЕСКОЙ БОЛЕЗНИ
Н.П.Миронов, Н.И.Аржакова, К.Л.Рябцев, С.В.Мальгинов, А.И.Бернакевич
Центральный НИИ травматологии и ортопедии им. Н.Н.Приорова МЗ РФ,
отделение анестезиологии и реанимации,
Москва
1. АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Технократический путь развития общества ведет к неуклонному росту травматизма и придает все большую актуальность всем аспектам проблемы травматической болезни.
От тяжелых осложнений травматической болезни погибает от 15 до 20% пострадавших с политравмой [2]. Одним из этих осложнений является синдром жировой эмболии (СЖЭ). Несмотря на то, что СЖЭ описан уже достаточно давно и включен в большинство классических монографий и руководств по травматологии и реаниматологии, представляется, что сейчас в практике интенсивной терапии на него несправедливо обращают весьма мало внимания.
Вместе с тем, жировая эмболия встречается гораздо чаще, чем диагностируется, и не только при тяжелой скелетной травме и травматическом шоке, но и при анафилактическом и кардиогенном шоке, панкреатите, клинической смерти с успешной реанимацией [3], т.е. практически при любом критическом состоянии.
СЖЭ может развиваться и при отсутствии костных повреждений и системных сдвигов гомеостаза. Так, в ЦИТО нами наблюдалась больная с легкой формой СЖЭ, развившейся после артроскопии коленного сустава без каких-либо манипуляций на костях и заметных сдвигов гомеостаза. В этом случае жировую эмболию можно связать с компрессией подкожной жировой клетчатки интраоперационно наложенным жгутом.
Жировая эмболия встречается также:
— при репозиции переломов длинных трубчатых костей;
— при манипуляциях на костномозговом канале;
— при эндопротезировании (особенно с использованием костного цемента), при выполнении остеосинтеза крупной кости интрамедуллярным штифтом, резко повышающим внутрикостное давление;
— при липосакции (во время косметических операций).
СЖЭ нередко протекает под маской пневмонии, черепно-мозговой травмы, респираторного дистресс-синдрома взрослых и другой патологии, способствуя значительному увеличению летальности [7].
За необъясненными ухудшениями состояния больных в ходе оперативных вмешательств достаточно широкого круга также может стоять одна из клинических форм синдрома жировой эмболии.
По причине отсутствия настороженности к этой патологии у практических врачей жировая эмболия вносит свой, по всей видимости, существенный вклад в статистику необъяснимых смертей при скелетной травме и в анестезиологической практике.
2. РАСПРОСТРАНЕННОСТЬ И ЛЕТАЛЬНОСТЬ
Наиболее часто жировая эмболия регистрируется, по наблюдениям Сальникова Д.И. [6] и по нашим данным, при переломах бедра, голени (особенно открытых), размозжении жировой клетчатки, обширных скальпированных ранах. Установлено, что жировая эмболия:
— в 58-85% случаев встречается при тяжелом травматическом шоке [3];
— в 90% случаев морфологически определяется у пациентов с переломами длинных трубчатых костей, но лишь у 3-4% развивается клиника синдрома жировой эмболии [11], что совпадает и с нашими наблюдениями.
Представленные данные показывают, что надо отличать феномен жировой эмболии, который, является морфологической находкой (обнаружение капель жира 6 мкм в биологических жидкостях) от синдрома жировой эмболии с клиническими проявлениями. В целом, существует значительное преобладание морфологических находок жировой эмболии над клиническими.
В последних работах приводятся данные о 3-13% летальных исходов при СЖЭ [9]. В прошлом летальность достигала 47-67% [10]. Большую разницу в данных можно объяснить как совершенствованием методов профилактики и интенсивной терапии, так и более частым выявлением легких и стертых форм СЖЭ.
3. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Патогенез травматической болезни многогранен. Непосредственная причина нарушения жирового обмена до сих пор не выяснена. По всей видимости, системные биохимические сдвиги в организме являются следствием нарушений нейрогуморальной и эндокринной регуляции всего метаболизма.
Начальным звеном в патогенезе жировой эмболии можно считать расстройство микроциркуляции с изменениями реологических свойств крови. Замедление кровотока из-за гиповолемии, гипоксия — характерные черты любого критического состояния. Именно поэтому жировая эмболия может осложнять большинство из них.
Одним из ведущих механизмов развития жировой эмболии является резкое системное нарушение жирового обмена, которое затем приводит к заполнению микроциркуляторного русла тканей и органов каплями нейтрального жира диаметром свыше 6-8 мкм с последующим микротромбообразованием вплоть до ДВС, эндоинтоксикацией ферментами и продуктами метаболизма липидов (эндоперекиси, кетоны, лейкотриены, простагландины, тромбоксаны), системными повреждениями клеточных мембран в микроциркуляторном русле (системная капилляропатия), и, прежде всего в легких, которые задерживают до 80% жировых капель [2].
Известно, что основными липолитическими агентами (увеличивающими уровень свободных жирных кислот) являются катехоламины, концентрация которых значительно повышается при критических состояниях и недостаточном обезболивании при оперативных вмешательствах [5].
Расстройства микроциркуляции и повреждение клеточных мембран ведут к массивному отеку мозга, развитию респираторного дистресс-синдрома взрослых (РДСВ), сердечной недостаточности, почечной недостаточности, токсическому распаду эритроцитов и гипопластической анемии.
Свою патогенетическую роль в инициации синдрома жировой эмболии играет изменение морфологии эритроцитов, характерное для критических состояний. Известно, что способность нормального эритроцита к деформации — необходимая основа капиллярного газообмена. По данным наших исследований, с применением сканирующей электронной микроскопии морфология эритроцитов при травматическом шоке существенно меняется. Помимо нормальных форм, способных к деформации и газообмену в капиллярах, значительно увеличивается количество патологических балластных форм (сфероцитов, микроцитов, серповидных, шиповидных), которые являются по сути, скрытой формой дефицита глобулярного объема. Их количество значимо коррелирует с тяжестью и исходом травматического шока и травматической болезни.
К факторам риска развития жировой эмболии следует отнести:
— травматический шок 2-3 ст.;
— гипотензию при систолическом артериальном давлении ниже 70 мм рт. ст. длительностью более 30 мин;
— тяжелую механическую травму костей таза, голени и бедра;
— размозжение конечностей и раздробление костей;
— отсутствие или недостаточность транспортной иммобилизации;
— транспортировку больного в острый период травматической болезни из одного лечебного учреждения в другое. Этот фактор, по нашим данным, вносит особенно большой вклад в эпидемиологию СЖЭ;
— частые попытки репозиции переломов, травматичную операцию.
При наличии у больного 2-х и более из перечисленных факторов, следует считать вероятность развития синдрома жировой эмболии высокой.
4. КЛАССИФИКАЦИЯ КЛИНИЧЕСКИХ ФОРМ
По классификации, предложенной А.Ю.Пащуком и А.В.Ивановой в 1982 году, различают три формы течения жировой эмболии [4]:
— молниеносную, которая приводит к смерти больного в течение нескольких минут;
— острую, развивающуюся в первые часы после травмы;
— подострую — с латентным периодом от 12 до 72 часов.
Клинически же весьма условно выделяют легочную, церебральную и, наиболее часто встречающуюся, смешанную формы.
5. КЛИНИКА И ДИАГНОСТИКА
Клиническая картина СЖЭ развивается, как правило, после "светлого промежутка" продолжительностью от 3-6 ч до 3-4 дней. При этом в 60% случаев клиника появляется в первые 24 ч | после травмы и лишь у 10% - после 3 сут [12]. Она часто наслаивается на картину травматического шока или черепно-мозговой травмы.
Диагностические критерии синдрома жировой эмболии можно разделить на клинические и инструментально-лабораторные.
Клинические критерии:
— раннее нарушение сознания, психические нарушения (эмоциональная неуравновешенность, возбуждение, бред, делирий, кома).
— преходящая грубая очаговая неврологическая симптоматика, умеренно выраженные менингеальные симптомы. В тяжелых случаях может появляться грубая очаговая патология — парезы и параличи.
Клиническая картина имеет сходство с постгипоксической энцефалопатией. Интересно, однако, что при адекватном лечении жировой эмболии регрессирует без существенных остаточных явлений < самая тяжелая неврологическая симптоматика;
— рано возникающая острая дыхательная недостаточность по механизму РДСВ;
— стойкая немотивированная тахикардия (выше 90 в мин) у травматического больного считается ранним признаком развития синдрома жировой эмболии. В более тяжелых случаях — тахиаритмии и синдром малого выброса, связанные как с непосредственным поражением миокарда гипоксического, дисциркуляторного и эндотоксического характера, так и с легочной гипертензией.
— петехиальные высыпания специфической локализации (на коже щек, шеи, груди, плечевого пояса и в конъюнктиве. Считается, что они являются проявлением капилляропатии вследствие действия свободных жирных кислот. Появляются на 2-3 сутки (или через 12-18 часов после ухудшения состояния больного) и подвергаются обратному развитию к концу 1 недели;
— гипертермия по типу постоянной лихорадки (до 39-40°С.);
Инструментально-лабораторные критерии:
— наличие капель нейтрального жира размером 6 мкм в биологических жидкостях. Обратим внимание, что для того чтобы иметь возможность получить порцию мочи для исследования на жир, надо устанавливать мочевой катетер, не пользуясь вазелином или другими гидрофобными веществами;
— диффузная инфильтрация легких при рентгенологическом исследовании, совпадающая с картиной "снежной бури" при РДСВ;
— стойкая немотивированная анемия, причинами которой являются патологическое депонирование крови и токсический распад эритроцитов;
— характерная картина глазного дна, описанная Patcher еще в 1910 году: на фоне отечной сетчатки вблизи сосудов видны округлые, нерезкие облаковидные белесовато-серебристые пятна. Они постепенно увеличиваются, не вызывая глубоких нарушений и подвергаются обратному развитию к концу первой недели;
— изменения в моче характерные для гломерулонефрита. Может развиться высокая азотемия;
— повышение процентного содержания жира в альвеолярных макрофагах, полученных в смывах бронхов в 1-е сутки после травмы, является новым ранним диагностическим признаком СЖЭ (Benzer, 1994).
Особую трудность представляет диагностика жировой эмболии при наличии черепно-мозговой травмы. В этом сочетании утяжеляется и течение жировой эмболии мозга за счет сопутствующего травматического отека, нарушений ликвородинамики и сосудистого тонуса.
Жировую эмболию сосудов головного мозга довольно часто приходится дифференцировать с эпидуральной гематомой, например, по схеме, предложенной Corn в 1964.
По данным скрининговых исследований встречаются в 72-100% случаев СЖЭ [8]
6. ПРОФИЛАКТИКА
Профилактика осложнений острого периода травматической болезни должна быть активной у пострадавших с факторами риска развития того или иного осложнения.
Профилактические меры должны включать:
— своевременное оказание квалифицированной помощи пострадавшим на месте происшествия;
— адекватная иммобилизация с применением вакуумного матраса или пневматических шин;
— щадящая транспортировка специализированным транспортом;
— ранняя адекватная, в том числе и специально ориентированная реологическая дезагрегантная инфузионная терапия;
— применение липотропных препаратов и веществ, препятствующих дезэмульгированию липи-дов (липостабила, спирта, являющегося чрезвычайно хорошим профилактическим и лечебным средством по отношению к СЖЭ);
— постоянный квалифицированный контроль за состоянием.
Длительность полноценной профилактики СЖЭ должна составлять не менее трех дней как после травмы, так и после отсроченного оперативного вмешательства или транспортировки.
Специализированная бригада травматологической реанимации, работающая на базе ЦИТО, основывает свою работу на указанных принципах,
проводя полный объем догоспитальной помощи на месте происшествия и по пути следования в стационар. Среди пострадавших, доставленных в ЦИТО нашей бригадой, случаев СЖЭ не было.
7. ЛЕЧЕНИЕ
Лечение этой категории тяжелобольных (как впрочем и любой другой) должно основываться на старой истине — лечить следует не жировую эмболию, а больного с травматической болезнью, осложненной жировой эмболией.
За последние 8 лет на длительном лечении в отделении реанимации ЦИТО находились 37 больных с жировой эмболией, развившейся после изолированной, множественной, сочетанной скелетной травмы, транспортировки или в послеоперационный период.
Основными направлениями лечения являлись:
1. Обеспечение адекватной доставки кислорода к тканям. Прямым показанием к началу ИВЛ при подозрении на жировую эмболию мы рассматривали нарушения сознания больного в виде психической неадекватности, возбуждения, делирия или сомноленции даже при отсутствии клинических признаков дыхательной недостаточности, сдвигов КЩС и газов крови. Больные с тяжелыми формами жировой эмболии требовали проведения длительной ИВЛ, поэтому нам представляется оптимальным как можно раньше (1-2 сут) производить им трахеостомию. Для улучшения оксигенации мы применяли с хорошим результатом широко известный режим с положительным давлением в конце выдоха (ПДКВ). Необходимым условием успешности длительной ИВЛ является применение фиброб-ронхоскопической техники для санации трахеоб-ронхиального дерева.
Критериями для прекращения ИВЛ служило восстановление сознания и отсутствие ухудшения оксигенации артериальной крови при дыхании больного атмосферным воздухом в течение нескольких часов. Также представляется целесообразным ориентироваться при переводе на самостоятельное дыхание на данные мониторинга ЭЭГ (сохранение альфа-ритма при самостоятельном дыхании и отсутствие медленных форм волновой активности) [1}. Способом выбора для перехода к самостоятельному дыханиию является высокочастотная ИВЛ (100 в мин).
В последнее время для терапии тканевой гипоксии мы применяли перфторан. По нашим очень немногочисленным наблюдениям, представляется, что этот препарат при СЖЭ ускоряет выход больных из комы. Из литературных данных известно также, что кроме своей кислородотранспортной функции перфторан способствует исчезновению патологических форм эритроцитов; снижает уровень субстратов перекисного окисления липидов, является хорошим сорбентом, связывающим ли-пидную основу эмболов. Таким образом, представляется патогенетически обоснованным назначение перфторана при синдроме жировой эмболии в ранние сроки. Однако, в целом, этот вопрос нуждается в дальнейшей клинической проверке.
2. Инфузнойная терапия системных расстройств микроциркуляции, трансфузионная терапия включала растворы низкомолекулярных декстранов — реополиглюкина или реомакродекса (400-500 мл) с курантилом (20-40 мг) и тренталом (100-200 мг/сутки). Ликвидации ангиоспазма на периферии сосудистого русла также способствовало введение глюкозо-новокаиновой смеси (до 800 мл/сутки). Курсами назначали также сермион и инстенон.
Для ликвидации анемии проводили гемотранс-фузии.
3. Дегидратационную терапию использовали при высоком внутричерепном давлении, выявленном по данным клиники и люмбальной пункции (с выполнением традиционных проб на проходимость субарахноидального пространства). Обязательным являлся контроль осмолярности плазмы крови, учитывая что при тяжелой скелетной травме часто развивается гиперосмолярный синдром, связанный с общей дегидратацией. Оптимальным осмотическим диуретиком (с наименьшим феноменом отдачи) был глицерин (10% - 0,5 г/кг).
4. Медикаментозная терапия гипоксии мозга, борьба с патологической импульсацией включала антигипоксанты (ГОМК), опиаты (промедол до 200 мг/ сутки), барбитураты и др.
5. Ноотропная и метаболическая терапия, биостимуляция основывались на тех же подходах, как и при лечении постгипоксической энцефалопатии. Включала курсовое введение ноотропила, церебро-лизина, энцефабола, накома, глютаминовой кислоты, актовегина.
6. С целью коррекции системы коагуляции и фибринолиза применяли гепарин в дозе 20-30 тыс.ед./сут. Показанием для увеличения дозы введения гёпарина являлось увеличение концентрации фибриногена плазмы. Довольно часто у больных с СЖЭ, несмотря на гепаринотерапию, все же проявлялся ДВС-синдром. Резкое угнетение фибринолиза, появление продуктов деградации фибрина, снижение тромбоцитов ниже 150 тыс. являлось показанием для переливания больших количеств (до 1 л/сут) свежезамороженной плазмы и фибринолизина (20-40 тыс. ед. 1-2 раза/сут).
7. Защита тканей от свободных кислородных радикалов и ферментов включала интенсивную гормонотерапию (до 20 мг/кг преднизолона или 0,5-1 мг/кг дексаметазона в первые сутки после манифестации СЖЭ с последующим снижением дозы). Считается, что кортикостероиды тормозят гуморальные ферментные каскады, стабилизируют мембраны, нормализуют функцию гематоэнцефа-лического барьера, улучшают диффузию, предупреждают развитие асептического воспаления в легких. Применяли также ингибиторы протеаз (контрикал — 300 тыс. ед/сут в свежезамороженной плазме), антиоксиданты (ацетат токоферола — до 800 мг/сут, аскорбиновая к-та — до 5 г /сут).
8. С целью восстановления физиологического растворения дезэмульгированного жира в крови, профилактики дезэмульгирования применяли ли-постабил (50-120 мл/сут). Принято считать, что и другой, весьма сходный с липостабилом препарат, эссенциале, также способствует переходу дез-эмульгированных капель жира в состояние тонкой дисперсии. Эссенциале мы назначали до 40 мл/сут. Хорошим эмульгатором и необходимым компонентом лечения являлся этиловый спирт (40 мл 96° спирта в 200 мл 5% глюкозы).
9. Дезинтоксикационная и детоксикационная терапия включала форсированный диурез, плазма-ферез. В течение нескольких лет мы применяли с обнадеживающими результатами как для патогенетического лечения в начальный период жировой эмболии, так и для дезинтоксикации гипохлорит натрия. Раствор, являющийся донатором атомарного кислорода, вводили в центральную вену в концентрации 600 мг/л в дозе 10-15 мг/кг со скоростью 2-3 мл/мин; его применяли через день курсами продолжительностью до одной недели.
10. Парентеральное и энтеральное питание. Для парентерального питания использовали 40% раствор глюкозы с инсулином, калием, магнием, аминокислотные препараты. Энтеральное питание назначали со 2-х суток. Применяли энпиты и лег-коусваемые высококалорийные многокомпонентные смеси, включающие необходимый спектр микроэлементов, витаминов и энзимов.
11. Коррекция иммунного статуса, профилактика и борьба с инфекцией. Коррекцию проводили под контролем данных иммунологических исследований с учетом чувствительности иммунной системы к стимуляторам. Применяли Т-активин, тимо-ген или тимоптин, Гамма-глобулин, гиперимунные плазмы. Для иммуностимуляции применяли также эндовазальное лазерное облучение крови.
Хорошей методикой профилактики гнойно-септических осложнений у больных с СЖЭ является широко применявшаяся нами селективная деконтаминация кишечника (аминогликозиды, пол-имиксин и нистатин) в сочетании с эубиотиком (бифидум-бактерин).
12. Ранняя оперативная стабилизация переломов является важнейшим аспектом в лечении пациентов с синдромом жировой эмболии после скелетной травмы. Известно, что скелетное вытяжение не обеспечивает должной стабильности переломов и возможности нормального ухода за больным. Кроме того, патологическая болевая и вегетативная импульсация из места нестабильного перелома препятствует выходу больных с СЖЭ из коматозного состояния. Поэтому необходимо как можно раньше производить остеосинтез компресси-онно-дистракционным аппаратом, например, особенно хорошо зарекомендовавшим себя стержневым аппаратом конструкции ЦИТО или накостной пластиной.
По нашему мнению, у пациентов с тяжелыми формами синдрома жировой необходимо производить внеочаговую фиксацию переломов еще при нахождении их в коматозном состоянии сразу после стабилизации показателей центральной ге-модинамики.
По нашим данным, комплексное лечение больных с СЖЭ практически во всех случаях имело хороший результат.
Пример тому — больной В., 32 лет с СЖЭ — ранняя стабилизация пластиной перелома левого бедра на 5 сут после травмы во время нахождения в коме на ИВЛ по поводу тяжелой мозговой и легочной форм жировой эмболии, выполненная сразу после стабилизации показателей системной гемодинамики, способствовала очень быстрому выходу больного из комы — на 2 сут после операции.
Приведем клинический пример длительного лечения больной с тяжелой сочетанной травмой, ушибом мозга, осложнившимися синдромом жировой эмболией.
Больная В., 20 лет переведена в ЦИТО на 17 сут после травмы с диагнозом: тяжелая черепно-мозговая травма, перелом основания черепа, ушиб головного мозга, перелом ключицы, ушиб грудной клетки, респираторный дистресс-синдром, закрытый перелом левого бедра, Больная в сопоре на ИВЛ. Через 6 ч после транспортировки появилась отрицательная динамика в неврологическом статусе. Состояние было расценено как мозговая кома III ст., среднемозговой синдром III ст. на фоне постгипоксической энцефалопатии, жировой эмболии сосудов головного мозга.
На 11 сут после развития СЖЭ был произведен остеосинтез левого бедра металлической пластинкой ЦИТО-СОАН. Комплексная терапия проводилась по представленным выше направлениям (кроме этого — и традицинным иглоукалыванием). ИВЛ продолжалась в течение 52 сут.
Коматозное состояние в течение 37 сут. Выход из комы через апаллический синдром, акинети-ческй мутизм и депрессивное состояние с психическим негативизмом. На 105 сут больная переведена для реабилитации в другое медицинское учреждение. При переводе — состояние удовлетворительное, в сознании, контактна, адекватна, выполняет задания, читает, пытается говорить без голоса, спокойна, улыбается. Элементы церебрастенического и астеновегетативного синдромов, легкий правосторонний гемипарез. Небольшие контрактуры в левом коленном и голеностопном суставах.
В настоящее время — выраженная положительная динамика в психоневрогическом и ортопедическом статусе. Больная самостоятельно ходит без дополнительной опоры. Сохраняются незначительные остаточные явления мозжечковой атаксии. Продолжается курсовая реабилитация.
Еще несколько клинических наблюдений:
Больная Ц., 55 лет, поступила в отделение реанимации ЦИТО из операционной после ревизии области правого тазобедренного сустава с фиксацией вертлужного компонента эндопротеза. Длительность анестезии 1 ч 20 мин, кровопотеря 700 мл. Оперирована по поводу болезни Педжета, состояния после оперативного лечения.
В анамнезе — ИБС, стенокардия напряжения, 6 лет назад — операции по поводу патологического перелома проксимальной части правого бедра (на почве болезни Педжета), 32 суток назад — эндопротезирование правого тазобедренного сустава эндрпротезом Сиваша на удлиненной ножке с применением костного цемента (после этой операции отмечалась наклонность к артериальной гипо-тензии — АД-108/70, ЧСС-88, ЦВД-75 мм вод. ст.).
При поступлении в отделение реанимации АД-130/90, ЧСС-100, в медикаментозной седации на самостоятельном дыхании. Через 4 часа отмечено значительное ухудшение состояния. В сознании, контактна, артериальная гипотензия — АД 50/30, ЦВД — 30, повязка сухая. В легких везикулярное дыхание, хрипов нет. Потребовалась длительная инфузия больших дозах допамина (до 50 мкг/кг/мин) и норадреналина с поддержанием АД на уровне 90-100/50 при ЧСС-120-150. В течение первых суток отмечалась гипертермия до 39,4°С, в крови и моче определялись капли жира различной величины. Начиная со 2-х суток появилась анемия (НЬ-85 г/л, Ht-21%). В анализах в 1-е сутки- отмечено повышение ACT (165), АЛ Т (60), гипопротеинемия (58 г/л), гипергликемия (9 ммоль/л), лейкоцитоз (26-109/л), сдвиг формулы до миелоцитов, лимфоцитопения (6%), на ЭКГ — признаки субэндокардиальной ишемии боковой и задней стенки левого желудочка.
Переливалась плазма, альбумин, допамин, норадреналин, кортикостероиды, проводилась оксиге-нотерапия. Гемодинамика стабилизировалась на 5 сут. АД-130/80, ЧСС-92 в мин, НЬ-90 г/л, переведена в отделение.
Интересно, что через 1 неделю после первой операции был выраженный подъем уровня транс-аминаз (184 и 58 соответственно), что свидетельствовало о токсическом влиянии костного цемента на печень. Этот фактор, возможно, и сыграл предрасполагающую роль в развитии у больной СЖЭ после следующей операции, не сопровождавшейся манипуляциями на костно-мозговом канале.
Больной Е,, 30 лет, поступил в отделение реанимации ЦИТО из травматологического отделения с жалобами на одышку, кашель, боль в грудной клетке без четкой локализации (3 сут после травмы — открытого перелома костей левой голени в нижней трети со смещением, 2 сут после перевода в ЦИТО с иммобилизацией гипсовой лангетой).
При поступлении в отделение реанимации состояние тяжелое, одышка до 28 в мин, АД 130/80, тахикардия, ЧСС-100, гипертермия 38,3°С, умеренная анемия НЬ-100 г/л, ослабление дыхания в
боковых отделах, больше справа. Через сутки — появились петехии на боковой поверхности грудной клетки, на 4-е сутки после поступления — анемия НЬ-90 г/л, Ht-25%. Рентгенологически отмечено понижение прозрачности легочных полей.
Состояние было расценено как СЖЭ, подо-строе течение, легочная форма. Проводилась реологическая инфузионная терапия, антикоагулянт-ная терапия, переливался внутривенно спирт, вводились липостабил, эссенциале, антибиотики, переливались эритроцитарная масса и плазма, проводилась витаминотерапия.
На 6 сутки (10-е после травмы) в среднетяже-лом состоянии с выраженной положительной динамикой при отсутствии признаков дыхательной недостаточности переведен обратно в травматологическое отделение для продолжения лечения.
ЛИТЕРАТУРА
1. Г.В.Алексеева, А.В.Букреев, И.В.Ильина, В.В.Алферова и др. Мониторинг неврологического статуса у больных с по-стгипоксической энцефалопатией при переводе их на самостоятельное дыхание после длительной ИВЛ. "Актуальные проблемы и переспективы развития современной рсаниматоло-гии". Матер, междунар. симп. - М.. 1994. - с. 10.
2. И.И.Дерябин, О.С.Насонкин. Травматическая болезнь. -Л.: Медицина, Ленинград, отд-е, 1987. - с. 301.
3. А.П.Зильбер. Клиническая физиология в анестезиологии и реаниматологии. - М.: Медицина, 1984, с. 480.
4. А.Ю.Пащук, П.А.Фадеев. Лечение травматической болезни, осложненной жировой эмболией./ Метод, рекоменд. -Харьков, 1991.
5. Г.А.Рябов. Синдромы критических состояний. - М.: Медицина, 1994. - с. 368.
6. Д.И.Сальников, В.В.Кузменко, С.А.Куликов и др. Профилактика и лечение жировой эмболии при травмах опорно-двигательного аппарата. Метод, рекоменд. - М., 1989.
7. Fabian Т.е., Hoots A.V.,Stanford D.S., et al. // Crit Care Med. 1990. Jan. - №18(1). - p. 42-6.
8. Guenter C.A., Braun Th.E. Fat embolism syndrome; Changing prognosis. // Chest - 1981. v.79. - №2. - p. 143-145.
9. Hsu D.T., Chao Т.К., Shih C.H. Post-traumatic fat embolism syndrome. // Chang-Keng-I-Hsueh. - 1990 Jun 20. -№13(2). - p. 86-95.
10. Kroupa J., K.Unger // Чехословацкая медицина. -1988. -Т.Н.-№4.-с. 224-234.
11. Levy D. The fat embolism syndrome. A review. // Clin. Orthop. - 1990 Dec. - №261. - p. 281-6.
12. Muiler C., Rahn B.A., Pfister U. Fettembolie und Fraktur, eine LUeraturubersicht // Actuel Traumatol. -1992, Jun. - №22 (3). - p. 104-13.
11111111111111111111111111111111111111111111111111111111111111111111111111111111111