
- •Закон мозлі
- •9 Квантово-механічна модель атома корпускулярно-хвильовий дуалізм
- •Принцип невизначеності
- •Хвильове рівняння шредінгера
- •Хвильові функції та електронні орбіталі
- •Характеристика стану електрона за квантовими числами
- •Атомні ядра склад і будова атомних ядер
- •Властивості взаємодіючих атомів
- •Валентність
- •Метод валентних зв'язків умови утворення ковалентного зв'язку
- •Водневий зв'язок природа й енергія водневого зв'язку
- •Міжчастинкові взаємодії доказ існування міжчастинкових сил
- •Вандерваальсова взаємодія молекул
- •Іонно-молекулярна взаємодія
- •Будова твердого тіла загальна характеристика твердого стану речовини
- •Будова ідеальних кристалів 7.2.1. Основні положення
- •Кристалічна гратка
- •Типи кристалічних ґраток
- •Будова іонних кристалів основні типи кристалічних ґраток іонних сполук
- •Металічний стан і його особливості кристалічна структура металів
- •Хімічний зв'язок у металах
Хвильові функції та електронні орбіталі
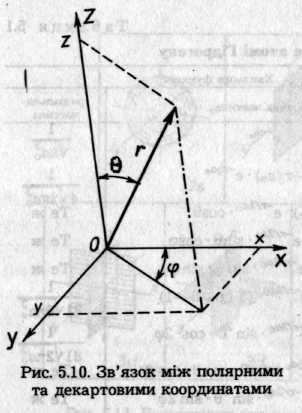
Потенціальне поле ядра сферично симетричне, тому зручніше користуватися не прямокутними декартовими координатами, а сферичними полярними координатами: радіусом-вектором r, кутом широти θ й кутом довготи φ(рис. 5.10). Зв'язок між полярними та декартовими координатами визначають із подібності трикутників
![]()
Межі
зміни параметрів т
(0
...![]() ),
θ (0 ... π) і φ (0 ... 2π). Рівняння (5.25) у сферичних
координатах має вигляд
),
θ (0 ... π) і φ (0 ... 2π). Рівняння (5.25) у сферичних
координатах має вигляд
![]()
Хвильову функцію в полярних координатах можна подати у вигляді добутку трьох окремих функцій, кожна з яких залежить від однієї змінної
\|/ (r, θ, φ) = R(r) • θ (θ) • (Ф) φ, (5.30) де R(r) — радіальна складова; θ (θ) і Ф(φ) — сферичні (кутові) складові функції \|/. Таким чином, вдається розділити змінні та спростити задачу.
Конкретний вираз хвильових функцій у вигляді радіальної R(r) і сферичної Y(θ,φ) = θ (θ) • Ф(φ) частин для деяких станів електрона в атомі водню наведено в табл. 5.1. У цих виразах г — відстань електрона від ядра; а0 — радіус першої борівської орбіти; e — основа натуральних логарифмів.
Радіальна складова (амплітуда ймовірності) дає змогу обчислити ймовірність місця перебування електрона залежно від відстані його від ядра; сферична складова — ймовірність розміщення електрона залежно від кутів θ і φ, тобто від напрямку радіуса-вектора. їх добуток дає змогу обчислити розподіл імовірності розміщення електрона в атомі.
Щоб розв'язки рівняння (5.30) мали значення для опису руху електрона в атомі, вони повинні відповідати вимогам регулярності. При цьому згідно з трьома ступенями вільності поступального руху з'являються три цілочислові параметри — квантові числа п, l і тl Хвильова функція \|/ п l тl характеризує певний стан електрона, якщо задані всі три квантові числа. Радіальна складова хвильової функції R(r) залежить від чисел п і l, сферичні складові θ (θ) — від l i ml, а Ф(φ) — від числа тl Отже, загальним розв'язком рівняння (5.29) є повна власна функція
![]()
Знаходження функції зводиться до підстановки в рівняння (5.31) такого набору чисел п, l і тl який би забезпечив мінімальну енергію даному стану електрона в атомі.
Одноелектронну хвильову функцію зі заданими значеннями трьох квантових чисел називають атомною орбіталлю (АО). Запис \|/i означає, що стан електрона характеризується хвильовою функцією, для якої n = 1, l = 0, тl = 0. Замість символу атомної орбіталі часто вказують лише число п і буквене позначення l:1s,3p,4f і т. д.
Кожна орбіталь характеризує певну об'ємну геометричну фігуру, орієнтовану в просторі, тобто сукупність положень електрона в атомі, що обмежена вузловими поверхнями, на яких хвильова функція перетворюється в нуль. Якщо \|/= 0, то \|/2 = 0, тому густина ймовірності локалізації електрона на вузловій поверхні дорівнює нулю. Вузлові поверхні бувають двох видів: сферичні, що не проходять через центр атома, та площинні, або конічні, що проходять через нього. Кожна орбіталь має п вузлових поверхонь і серед них l площинних.
Таблиця 5.1 Хвильові функції електрона в атомі Гідрогену

Проаналізуємо алгебричні вирази (табл. 5.1) для випадків п = 1 та п = 2.
Для 1s-орбіталі вираз e-r/a0 свідчить про те, що коли r значно перевищує а0, то функція Rn,l (r) прямує до нуля. Тому 1s-орбіталь має одну сферичну вузлову поверхню (r =). Вираз (2 — r/ао) e-r/2a0 для 2s-орбіталі перетворюється на нуль, коли r1 = 2а0 (перша сферична вузлова поверхня) і коли r2 = (друга сферична вузлова поверхня). Орбіталь 2р обмежена сферичною та площинною вузловими поверхнями, про що свідчить тригонометрична складова хвильової функції. Для 2рz-орбіталі функція перетворюється на нуль при = 90°, що відповідає площині XOY, або z = 0 (рис. 5.10). Для 2рх-орбіталі \|/= 0 при = 0° і φ= 90°, що відповідає площині YOZ, або рівнянню х = 0. Для 2ру -орбіталі \|/ = 0 при = 0° і φ = 0° (площина XOZ, рівняння якої у = 0).
Вузлові поверхні для 2s-, 2p- та Зd-станів електрона зображені

Рис. 5.11. Розміщення вузлових поверхонь для різних станів електрона
на рис. 5.11. Рівняння площин, що характеризують вузлові поверхні 3d і 4f-орбіталей, наведені в табл. 5.2.
Атомну орбіталь можна побудувати лише в чотиривимірному просторі. Тому доводиться розглядати окремо її радіальну та сферичну частини. Радіальна частина орбіталі Rn,l(r) швидко (за експоненціальним законом) зменшується з віддаленням від ядра. Аналогічно змінюється і ймовірність перебування електрона в атомі, що можна виразити графіком радіального розподілу ймовірності.
Для знаходження ймовірності перебування електрона на віддалі г від ядра атома незалежно від напрямку розглянемо нескінченно тонкий сферичний шар об'ємом dv = 4r2dr, де dr — товщина шару. Ймовірність перебування електрона у цьому шарі пропорційна 4r2dr R2n,l(r) і характеризує радіальну електронну густину, значення якої залежить від поверхні сфери 4r2, що зростає, і від густини ймовірності R2(r), яка спадає зі збільшенням r (рис. 5.12, а).
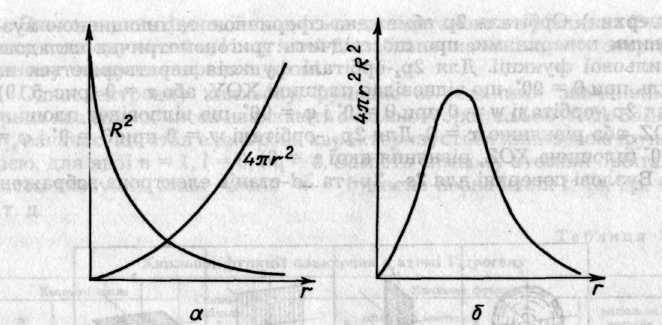
Рис. 5. 12. Радіальна електронна густина ‘1s-електрона в нескінченно тонкому
сферичному шарі
У результаті електронна густина спочатку збільшується, бо 4r2 зростає швидше, ніж спадає R2(r), а потім зменшується, коли R2(r) починає спадати швидше, ніж зростає 4r2. Отже, при певному значенні г електронна густина проходить через максимум (рис. 5.12, б).
Таблиця 5.2 Рівняння площин вузлових поверхонь 3d- і 4f-орбіталей
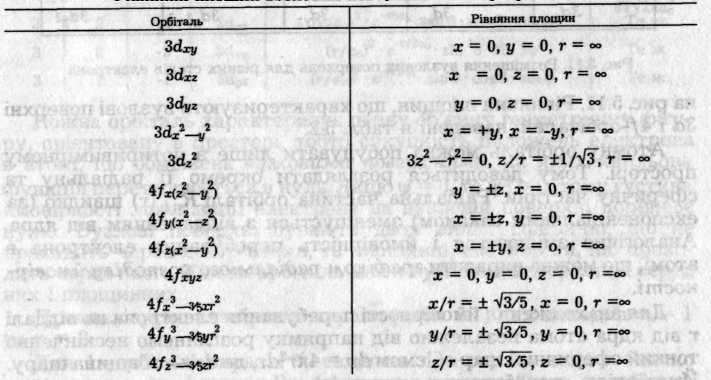
Радіальний розподіл імовірності для основного (1s) і одного із збуджених (2s) станів атома Гідрогену зображено на рис. 5.13. З рис. 5.13 а, б видно, що електрон може перебувати в будь-якій точці атома з різною ймовірністю, тому межі атома розмиті. Ймовірність перебування електрона в стані 1s наближається до нуля вже на віддалі близько 0,3 нм. Це дає змогу обмежити об'єм простору, в якому зосереджена майже вся (~90 %) електронна густина, граничною поверхнею (рис. 5.13, в). Розподіл електронного заряду в просторі навколо ядра нагадує хмарку, яку називають хмаркою ймовірності перебування електрона, або електронною хмаркою.

Рис. 5.13. Зміна радіальної частини орбіталі (а), радіального розподілу ймовірності (б) і розріз електронної хмарки (в) для 1s- і 25-станів атома Гідрогену (ГП — граничні поверхні, ВП — вузлова поверхня)
Радіальний розподіл електронної густини для ls-орбіталі має максимум при а0 = 0,053 нм, що збігається з радіусом першої борівської орбіти. Для стану 2s радіальна частина хвильової функції проходить через 0 (вузлова точка) і змінює знак. Це приводить до двох максимумів електронної густини і появи сферичної вузлової поверхні, що відбувається на віддалі 0,106 нм від ядра (рис. 5.13, а). Оскільки n зросло, протяжність орбіталі збільшилась, то другий максимум міститься уже на віддалі 0,212 нм (рис. 5.13, б). Зовнішній максимум значно більший, ніж внутрішній, тому утворення хімічного зв'язку відбувається саме в зовнішній частині атома.
Для інших збуджених станів радіальному розподілу електронної густини властиві ті ж закономірності.
Залежність електронної густини від віддалі для різних станів атома Гідрогену представлена на рис. 5.14. Графіки розподілу електронної густини 1s-, 2p-, 3d-, 4f-орбіталей мають схожий вигляд, бо ці орбіталі містять тільки по одній сферичній вузловій поверхні, але максимуми на графіках не збігаються. Число максимумів визначається різницею квантових чисел (n-1), яка для s-орбіталей дорівнює n, для р-орбіталей — на одиницю менша, для d-орбіталей — на дві одиниці менша і для f-орбіта-лей — на три одиниці менша.
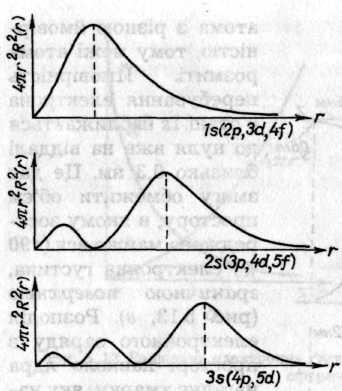
Pис. 5.14. Графіки залежності радіальної електронної густини від віддалі для різних станів атома Гідрогену
Причому зі збільшенням п максимуми дедалі більше згладжуються й віддаль між ними зростає. Максимум ls-орбіталі збігається зі значенням а0, а для 2р- і Зd-орбіталей дорівнює 4а0 і 9а0 відповідно. До того ж розподіл електронної густини для s-орбіталей однаковий у всіх можливих напрямках, а для інших орбіталей — залежить від кутів і φ(див. табл. 5.1).
Для графічного зображення сферичної частини хвильової функції Yl,m (,φ) використовують полярні діаграми, які показують розподіл імовірності локалізації електрона в напрямках, що задані кутами і φ. Кутова складова визначає симетрію та форму граничної поверхні атомних орбіталеи (електронних хмарок). На рис. 5.15 і 5.16 зображено форми та просторову орієнтацію електронних хмарок, що відповідають s-, p-, d- і f-орбіталям (показані також знаки кутової частини хвильової функції).
Усі атомні s-орбіталі мають сферичну симетрію, бо їх власні функції не містять членів, залежних від кутів. Знак функції (+ або —) однаковий у всіх точках сфери. Постійність радіуса-вектора символізує незалежність імовірності перебування електрона від напрямку (рис. 5.15).
Кожна з трьох р-орбіталей спрямована по відповідній координаті. Вони мають по одній вузловій поверхні, що проходить через ядро. Для рz-орбіталі максимум електронної густини розміщений вздовж осі Z, вузловою поверхнею її є площина XY. Гранична поверхня цієї орбіталі нагадує об'ємну вісімку або гантель. Знак рz-орбіталі збігається із знаком осі: при z>0 орбіталь додатна, при z<0 — від'ємна, при z = 0 кутова частина хвильової функції та її квадрат дорівнюють нулю. Аналогічну симетрію та граничні поверхні мають рх- і рy-орбіталі (рис. 5.15).
Для d-орбіталей можливі п'ять різних орієнтацій у просторі(puc. 5.16)
Зі зростанням значення l форми орбіталей ускладнюються. Граничні поверхні семи /-орбіталей, що відповідають різним значенням т, представлені на рис. 5.16.
Форми атомних орбіталей, їх орієнтація в просторі мають важливе значення при утворенні хімічного зв'язку.

Рис. 5.15. Форми та просторова орієнтація s-, p- і d-орбіталей

Рис. 5.16. Форми та просторова орієнтація /-орбіталей
