
- •Закон мозлі
- •9 Квантово-механічна модель атома корпускулярно-хвильовий дуалізм
- •Принцип невизначеності
- •Хвильове рівняння шредінгера
- •Хвильові функції та електронні орбіталі
- •Характеристика стану електрона за квантовими числами
- •Атомні ядра склад і будова атомних ядер
- •Властивості взаємодіючих атомів
- •Валентність
- •Метод валентних зв'язків умови утворення ковалентного зв'язку
- •Водневий зв'язок природа й енергія водневого зв'язку
- •Міжчастинкові взаємодії доказ існування міжчастинкових сил
- •Вандерваальсова взаємодія молекул
- •Іонно-молекулярна взаємодія
- •Будова твердого тіла загальна характеристика твердого стану речовини
- •Будова ідеальних кристалів 7.2.1. Основні положення
- •Кристалічна гратка
- •Типи кристалічних ґраток
- •Будова іонних кристалів основні типи кристалічних ґраток іонних сполук
- •Металічний стан і його особливості кристалічна структура металів
- •Хімічний зв'язок у металах
Водневий зв'язок природа й енергія водневого зв'язку
Водневим зв'язком називають зв'язок двох дуже електронегативних атомів за допомогою атома водню. Перше уявлення про його існування висловив Ільїнський (1887) і теоретично обгрунтували Латімер і Родебуш (1920). Водневий зв'язок (Н-зв'язок) займає проміжне положення між електростатичним притяганням і донорно-акцепторною взаємодією. Він звичайно виникає під час взаємодії сильно полярних молекул між собою або з іншими полярними молекулами:
![]()
де А та В — атоми електронегативних елементів (крапками позначено водневий зв'язок).
Водневий зв'язок тим міцніший, чим більша електронегатив-ність атома-партнера і чим менший його розмір. Тому він характерний для водневмісних сполук Флюору та Оксигену, меншою мірою — Нітрогену, ще меншою — Хлору, Сульфуру та Карбону.
Утворення водневого зв'язку зумовлене дуже малим розміром додатньо поляризованого атома Гідрогену, який фактично перетворюється на протон, і його здатністю глибоко проникати в електронну оболонку сусіднього від'ємно поляризованого атома. Між протоном та негативно зарядженим атомом полярно-ковалентної молекули виникає електростатична взаємодія. Проте чисто електростатичною взаємодією неможливо пояснити напрямленість і насичуваність водневого зв'язку, залежність між його енергією та дипольним моментом або поляризовністю взаємодіючих атомів. Необхідно ще враховувати й донорно-акцепторну взаємодію, на що вперше вказав Соколов (1964).
В електронній структурі фрагмента А—Н ... В з неподіленою електронною парою атома В і двома електронами ковалентного зв'язку А—Н відбувається зміщення валентної електронної густини в напрямку від В до А. Це, природно, стосується не лише атомів А, Н і В, але майже всіх атомів обох взаємодіючих молекул. У результаті між цими молекулами утворюється донорно-акцептор-ний зв'язок. Особливістю цього зв'язку є те, що донор електронів — молекула R2B — має атом В з електронною парою, що безпосередньо взаємодіє з атомом Н групи А—Н. Через цю групу переноситься заряд на акцептор — молекулу R1AH. Чим більше молекул бере участь в утворенні комплексу з водневими зв'язками, тим ефективніше перерозподіляється електронний заряд по ряду послідовно зв'язаних молекул, тим сильніші водневі зв'язки й вища їхня енергія.
Описати електронну конфігурацію водневого зв'язку можна за допомогою схеми рівнів трьохорбітального трицентрового фрагмента А—Н ... В з чотирма електронами (два від групи А—Н і два від неподіленої пари атома В). Група А—Н, як двохатомна молекула, має σ i σ* -орбіталі В — орбіталь неподіленої пари. Хвильова функція електрона в Н-зв'язку утворюється як лінійна комбінація цих трьох орбіталей
![]()
У комплексах з Н-зв'язком рівні МО, локалізовані в основному на донорі електронів, завжди знижуються, а рівні МО, локалізовані на акцепторі — підвищуються порівняно з рівнями вільних молекул. Це відрізняє Н-зв'язок від ковалентного, де знижуються рівні МО обох учасників.
Водневий зв'язок може виникати не тільки між атомами різних молекул, а й між атомами однієї молекули.
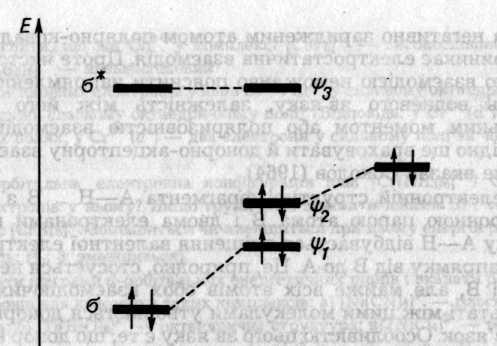
Рис. 6.44. Молекулярні орбіталі акцептора А—Н (зліва) неподіленої пари атома В донора (справа) і водневого містка А—Н —В (у центрі)
![]()
Енергія водневого зв'язку в загальному містить у собі різні енергетичні зміни в усій системі й залежить від природи атомів А та В і від електронної конфігурації молекул R1AH і R2B у цілому. Розрізняють слабкі несиметричні та міцні симетричні водневі зв'язки. У слабких зв'язках між'ядерна відстань коливається від 0,27 до 0,30 нм, а енергія зв'язку — від 8 до 29 кДж/моль. Такі зв'язки утворюються в димерах (Н2О)2, (HF)2 та ін. Для міцних зв'язків характерні коротші відстані (0,23 ... 0,26 нм) й високі значення енергії, близькі до енергій зв'язку в двохатомних молекулах (120 ... 250 кДж/моль). Міцний зв'язок реалізується в іоні [HF2]- де атом Гідрогену розміщений посередині між двома атомами Флюору (0,113 нм) і має дуже високу енергію (168 кДж/моль).
Енергія Н-зв'язку зменшується зі збільшенням температури, тому цей зв'язок характерніший для речовин у конденсованому стані.
