
- •Закон мозлі
- •9 Квантово-механічна модель атома корпускулярно-хвильовий дуалізм
- •Принцип невизначеності
- •Хвильове рівняння шредінгера
- •Хвильові функції та електронні орбіталі
- •Характеристика стану електрона за квантовими числами
- •Атомні ядра склад і будова атомних ядер
- •Властивості взаємодіючих атомів
- •Валентність
- •Метод валентних зв'язків умови утворення ковалентного зв'язку
- •Водневий зв'язок природа й енергія водневого зв'язку
- •Міжчастинкові взаємодії доказ існування міжчастинкових сил
- •Вандерваальсова взаємодія молекул
- •Іонно-молекулярна взаємодія
- •Будова твердого тіла загальна характеристика твердого стану речовини
- •Будова ідеальних кристалів 7.2.1. Основні положення
- •Кристалічна гратка
- •Типи кристалічних ґраток
- •Будова іонних кристалів основні типи кристалічних ґраток іонних сполук
- •Металічний стан і його особливості кристалічна структура металів
- •Хімічний зв'язок у металах
Закон мозлі
Закон Мозлі давав змогу визначати точні значення порядкових номерів елементів, а також передбачати положення ще не відкритих елементів у періодичній системі. Для цього треба знайти частоту лінії випромінюючого елемента, наприклад Кα, і порівняти її з графіком, одержаним для досліджених елементів (рис. 5.4). Старанні досліди Чедвіка (1920), який за розсіюванням α-частинок з великою точністю визначив заряди атомних ядер Купруму, Аргентуму, Платини, підтвердили, що вони збігаються з атомними номерами у формулі Мозлі.
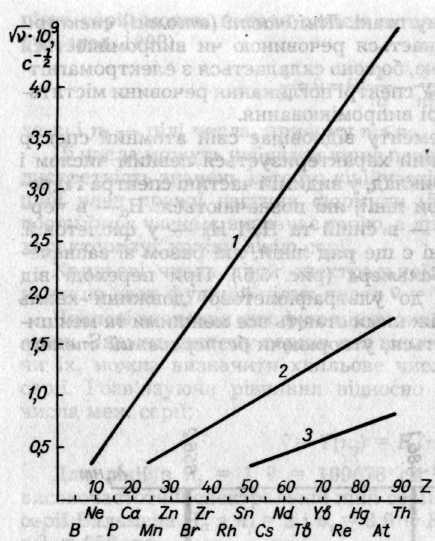
Рис. 5.4. Графік закону Мозлі: 1— лінія серії Кα; 2 — серії La; 3 — серії Ma
Приклад. Обчислити порядковий номер і назвати елемент, для якого довжина хвилі випромінювання Ка λ = 1,931 • 10 -8см. Відомо, що для Ка(Сu) λ = 1,541 • 10 -8 см.
Обчислюємо відповідні частоти обох елементів
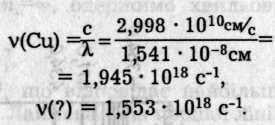
Визначаємо сталу а з рівняння Мозлі за спектральною лінією Купруму (v)1/2= aZ, бо для Ка Ь = 1;
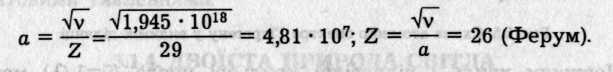
9 Квантово-механічна модель атома корпускулярно-хвильовий дуалізм
Двоїста природа світла наштовхнула де Бройля (1924) на думку про те, що корпускулярно-хвильовий дуалізм властивий будь-яким матеріальним частинкам. Для них повинно бути справедливим співвідношення

аналогічне для фотона, згідно з яким полю з довжиною хвилі λ відповідає частинка з масою т, яка рухається зі швидкістю v.
Гіпотезу де Бройля підтвердили досліди з дифракції електронів на монокристалі нікелю (Девіссон і Джермер, 1927), які дають таку ж дифракційну картину, як і рентгенівські промені: замість однієї плями виникають серії концентричних кілець різної інтенсивності. Дифракційні кільця спостерігали у тому ж році Дж. П. Томсон і Тартаковський при проходженні електронів крізь металеві пластинки. Була також виявлена (1930) двоїста природа а-частинок, маса яких у 7360 разів більша від маси електрона.
Хоч дуалізм властивий всім об'єктам матеріального світу, але виявляє себе тільки для мікрочастинок. Зокрема, з електроном, що
рухається зі швидкістю 2,2 • 106 м/с, асоціюється довжина хвилі
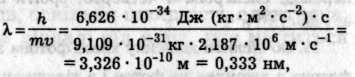
співмірна з розмірами атомів. Тому при проходженні електронів через кристали (дифракційну гратку) спостерігається їх дифракція. З рухом частинки, що має, наприклад, масу 1 г і швидкість руху 10 м/с, асоціюється хвиля довжиною лише
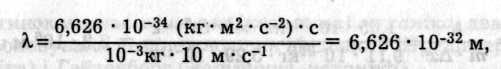
зафіксувати яку неможливо через відсутність відповідної дифракційної ґратки. Це означає, що хвильові властивості макрооб'єктів не виявляються, якщо довжина хвилі значно менша, ніж розміри атома (10-10 м).
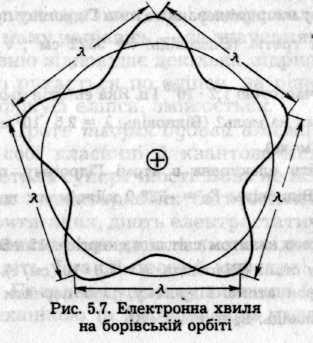
Обчислена з рівняння де Бройля довжина хвилі електрона (0,333 нм) дорівнює довжині кола першої борівської орбіти з радіусом а0 = 0,053 нм. Таким чином, на стаціонарних орбітах довжина хвилі електрона повинна вкладатися ціле число разів (рис. 5.7), тобто
2πr=n λ
Отже,
розмір квантово-механічної орбіти
електрона кратний довжині його хвилі.
Розв'язуючи рівняння разом з рівнянням
де Бройля,
приходимо
до рівняння т
vr
=
n![]()
Принцип невизначеності
У хвильових властивостях електрона закладено перший принцип квантової механіки. Другим є принцип невизначеності (Гей-зенберг, 1927), згідно з яким неможливо одночасно точно визначити місце перебування мікрочастинки у просторі та її швидкість або імпульс. Добуток невизначеностей координати та швидкості (або імпульсу) мікрочастинки не може бути меншим від певного значення
Δx
*Δv≥![]() /m,
або
Δx
*Δр≥
/m,
або
Δx
*Δр≥![]() (5.21)
(5.21)
Де Δх, Δv, Δр— невизначеності (похибки) у значеннях координати проекції швидкості та проекції імпульсу на вісь X у даний момент. Аналогічні співвідношення справедливі й для координат Y і Z.
Співвідношення
невизначеностей зумовлене об'єктивними
властивостями мікрочастинок. Замкнена
хвиля електрона охоплює атом, утворюючи
електронну хмарку, в якій неможливо
уявити рух електрона по певній траєкторії.
Траєкторія розмивається, виникає смуга
невизначеності, в межах якої перебуває
електрон. Зі співвідношення
невизначеностей випливає, що чим точніше
визначена область локалізації електрона
(Δх→0),
тим більша невизначеність його швидкості
(Δv→![]() )
або імпульсу (Δр→
)
або імпульсу (Δр→![]() ),
які з однаковою ймовірністю набувають
будь-яких значень.
),
які з однаковою ймовірністю набувають
будь-яких значень.
Обчислимо похибку у визначенні швидкості електрона в атомі Гідрогену, прийнявши невизначеність координати електрона рівною борівському радіусу. Підставивши у (5.21) значення радіуса та перетворивши вираз відносно Δv, одержимо

Оскільки похибка при обчисленні швидкості дорівнює швидкості, то, фіксуючи координату електрона, не можемо визначити його швидкість.
Принцип
невизначеності є загальним для всіх
матеріальних об'єктів, але внаслідок
малого значення
![]() для
макрооб'єктів ним можна нехтувати.
для
макрооб'єктів ним можна нехтувати.
