
- •2)Ускорение точки. Нормальное и тангенсальное кскорение. Проекции ускорения на координатные оси.
- •3) Кинематика вращательного движения. Угловая скорость и ускорение.
- •4)Динамика мат. Т-ки. Сила,масса и импульс частицы. З-ны Ньютона.
- •5) Инерциальные системы отсчета. Принцип относительности Галилея. Преобразования Галилея.
- •7)Центр инерции (масс). Движение центра инерции замкнутой с-мы.
- •8) Работа. Работа переменной силы. Мощность.
- •11)Полная механическая энергия системы. З-н сохранения механической энергии.
- •12) Вращательноe движение твердого тела. Момент инерции мат т-ки и тв тела относительно неподвижной оси. Кинетическая энергия вращающегося тв тела. Т-ма Штейнера.
- •13)Работа, совершаемая при вращении тв тела. Момент силы от-но точки и оси вращения. Осн ур-е динамики вращательного двожения тв тела.
- •14)Момент импульса мат т-ки и тв тела от-но неподвижной оси вращения. З-н сохранения импульса.
- •15)Понятие о неинерциальных системах отсчета и силах инерции
- •Скорости газовых молекул. Закон Максвелла для распределения молекул идеального газа по скоростям. Наиболее вероятная ,средняя квадратичная и средняя арифметическая скорости молекул.
- •Барометрическая формула. Распределение молекул в поле силы тяжести. Распределение Больцмана.
- •Среднее число столкновений и средняя длина свободного пробега молекул. Зависимость средней длины свободного пробега молекул от давления и температуры.
- •Явления переноса в газах.З-ны диффузии, внут трения и теплопроводности.
- •23, Число степеней свободы молекул. З-н равномерного распространения энергии по степеням свободы молекул. Внут энергия ид газа
- •Теплоемкость. Зависимость теплоемкости ид газа от вида процесса. Классическая теория теполемкости ид газа и ее ограниченность.
- •Первое начало термодинамики и изопроцессы.
- •Первое начало термодинамики и адиабатический процесс.Политропический процесс.
- •Реальные газы. Силы и потенц энергия межмолекулярного воздействия.Ур-е Ван-дер-Ваальсса.
- •Поверхностный слой жидкости.Поверхностное натяжение.Коэф пов нат и его зависимость от т-ры и примесей пав.
- •32. Явление смачивания.Краевой угол.Св-ва тонких пленок.
- •31. Давление под ихогнутой пов-тью жтдкости.Ф-ла Лапласа. Капиллярные давления.
Первое начало термодинамики и изопроцессы.
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются изопроцессы, при которых один из основных параметров состояния сохраняется постоянным.
И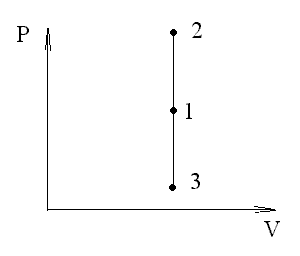 зохорный
процесс (V=const).
процесс 1-2 есть изохорное нагревание,
а 1-3 - изохорное охлаждение. При изохорном
процессе газ не совершает работы над
внешними телами, т.е.
зохорный
процесс (V=const).
процесс 1-2 есть изохорное нагревание,
а 1-3 - изохорное охлаждение. При изохорном
процессе газ не совершает работы над
внешними телами, т.е.
.δA=pdV=0.Для изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии: dQ=dU
Изобарный процесс (p=const). При изобарном процессе работа газа при расширении объема от V1 до V2 равна
![]()
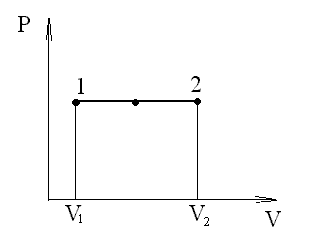 и
определяется площадью прямоугольника.
и
определяется площадью прямоугольника.
В изобарном процессе при сообщении газу массой m количества теплоты
![]() его
внутренняя энергия возрастает на
величину
его
внутренняя энергия возрастает на
величину
![]()
Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля - Мариотта: PV=const. Диаграмма этого процесса (изотерма)в координатах р, V представляет собой гиперболу, расположенную на диаграмме тем выше, чем выше температура, при которой происходил процесс..
Так как при T=const внутренняя энергия идеального газа не изменяется
![]() то
из первого начала термодинамики
(dQ=dU+dA)
следует, что для изотермического процесса
dQ=dA,
т.е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил
то
из первого начала термодинамики
(dQ=dU+dA)
следует, что для изотермического процесса
dQ=dA,
т.е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил
Первое начало термодинамики и адиабатический процесс.Политропический процесс.
А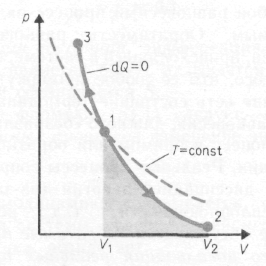 диабатическим
называется процесс, протекающий без
теплообмена с окружающей средой (dQ = 0.
Из первого начала термодинамики d Q = dU
+ dA для адиабатического процесса следует,
что d A = – dU т. е. газ при адиабатическом
расширении совершает работу за счет
запаса внутренней энергии.
диабатическим
называется процесс, протекающий без
теплообмена с окружающей средой (dQ = 0.
Из первого начала термодинамики d Q = dU
+ dA для адиабатического процесса следует,
что d A = – dU т. е. газ при адиабатическом
расширении совершает работу за счет
запаса внутренней энергии.
Политропический процесс-процесс протекающий при постоянной теплоемкости газа.
Обратимые и не обратимые процессы. Круговой процесс (цикл).Тепловые двигатели.Цикл Карно и его КПД. Второй з-н т\д.
Круговой процесс(цикл)-процесс,при котором после ряда изменений система возвращается в исходное состояние.Работа совершаемая сичтемой численно =S ограниченной графиком процесса,будет >0 если цикл прямой и<0 если цикл обратный.
Обратимым наз процесс удовлетворяющий след требованиям:1)его одинаково легко провести в 2 противоположных направлениях в прямом и обратном.2)в обоих случаях с-ма проходит ч\з одни и те промежуточные состояния.
Необратимый-процесс после завершения к-го систему и окр тела нельзя вернуть в исходное состояние.Протекают с конечной скоростью и самопроизвольно только в одном направлении в таком при котором каждое последующее состояние системы ближе к равновесному чем предыдущее.
Теплота никогда сама собой не может перейти от менее нагретых тел к более нагретым.
Наибольшим КПД обладают круговые циклы, состоящие из обратимых процессов. Карно проанализировал цикл состоящий из 2 обратымых процессов Т=const.P=const.A=Qн+Qx. КПД показывает долю тепла к А.
Т.к цикл Карно обратимый то можем записать
Приведенное кол-во тепла.Нер-во Клаузиса.Энтропия.Св-ва ее. Энтропия изолир с-мы. Статистическое толкование 2 начала т\д.
Энтропия-скалярная физ величина характеризующая состояние т\д системы,проращение к-1 в обратимом процессе равно приведенной теплоте полученной системой в этом процессе.Св-ва энтропии определяются св-ми W но в отличии от W энтропия яв-ся аддитивной величиной.
