
5 Локальна корозія
Локальною корозією називають корозію, при якій руйнування металів і сплавів відбувається на окремих ділянках, в той час як інша частина поверхні виробу майже не руйнується. До локальної корозії відносяться міжкристалітна, точкова, контактна і щілинна.
5.1 Міжкристалітна корозія
До міжкристалітної корозії схильні нержавіючі сталі, алюмінієві і нікелеві сплави. Цей вид корозії один з найбільш небезпечних видів місцевої корозії, що викликає вибіркове руйнування на межі зерен, в результаті відбувається втрата пластичності і міцності сплаву, тобто передчасне руйнування виробів. Причиною схильності сплавів до міжкристалітної корозії є електрохімічна неоднорідність структури сплаву, коли кордони зерен або прикордонні зони є більш електрохімічно негативними в порівнянні із зерном. Найбільш обґрунтованою причиною виникнення міжкристалітної корозії нержавіючих сталей слід вважати збіднення хромом кордонів зерен внаслідок виділення на них фаз, багатих хромом. Це відбувається при відпуску загартованих нержавіючих сталей. При відпуску нержавіючих сталей по межах зерен випадає карбід хрому, в результаті чого вміст хрому в твердому розчині в прикордонній зоні різко зменшується.
Подальше зростання карбідів відбувається внаслідок дифузії вуглецю та хрому з твердого розчину до кордонів зерен. При температурі відпуску швидкість дифузії вуглецю набагато вище швидкості дифузії хрому, тому в освіті карбідів бере участь майже весь вуглець твердого розчину, а хром, що знаходиться в твердому розчині близько кордонів зерен. У результаті цього через деякий проміжок часу відпуску сталі на межі зерен утворюється збіднена хромом область, в якій вміст хрому становить менше 12%, тому її корозійна стійкість нижче, ніж зона зерна, що й визначає схильність аустенітних сталей до міжкристалітної корозії.

Рис. 5.1. Характер корозійного руйнування сталі. Сталь 09Х18Н14 з 0,75% Si після відпуску при 650° С.
При досить великий тривалості відпуску, у міру зменшення концентрації вуглецю, швидкість дифузії хрому починає перевищувати швидкість дифузії вуглецю, в результаті чого вміст хрому в збідненої зоні росте і її корозійна стійкість збільшується.
Таким чином, при відпуску сталі при певній температурі, через деякий час з'являються збіднені хромом зони і сталь набуває схильність до міжкристалітної корозії, а за досить великої тривалості відпуску схильність сталі до міжкристалітної корозії знижується.
Температура відпуску грає важливу роль в появі у сталі схильності до міжкристалітної корозії. При низьких температурах відпуску швидкість дифузії вуглецю та хрому малі, і тому час появи схильності сталі до міжкристалітної корозії значний. З підвищенням температури відпуску швидкість дифузії вуглецю із зерен до кордонів збільшується, в результаті чого час відпуску до появи схильності у сталі до міжкристалітної корозії зменшується і досягає мінімального значення при деякій температурі. При подальшому підвищенні температури відпуску швидкість дифузії хрому в збіднені зони збільшується, що приводить до збільшення часу до появи у сталі схильності до міжкристалітної корозії. При високих температурах відпуску відбувається коагуляція карбідів хрому, що знижує швидкість міжкристалітної корозії.
На схильність нержавіючих сталей до міжкристалітної корозії великий вплив має вміст у них вуглецю. З підвищенням вмісту вуглецю в сталі кількість випадаючого по межах зерен карбіду хрому зростає і схильність її до міжкристалітної корозії підвищується. Легування хромонікелевих аустенітних нержавіючих сталей елементами, що мають більшу спорідненість до вуглецю, ніж хром, і зв'язують вуглець в стійкі карбіди, різко знижує їх схильність до міжкристалітної корозії. До таких елементів відносяться титан, ніобій, тантал.
Різновидом міжкристалітної корозії є ножова корозія, що виникає в дуже вузькій зоні від декількох сотих до десятих часток міліметра на кордоні; «зварний шов - основний метал». Це явище також пояснюється збідненням кордонів зерен на хром у результаті деяких режимів нагрівання, особливо при зварюванні. Для запобігання ножової корозії рекомендується застосовувати низьковуглецеві сталі, оптимальний режим зварювання або піддавати зварні з'єднання стабілізуючому відпалу. Ножовій корозії піддаються і нержавіючі сталі, що містять титан і ніобій. Це пов'язано з тим, що у вузькій зоні біля зварного шва, що нагрівається до високих температур (близько 1300 °С), карбіди титану, ніобію та хрому переходять у розчин, а при швидкому охолодженні, внаслідок контакту з не нагрітим металом, не встигають виділитися, в результаті чого вуглець залишається в твердому розчині, і створюються умови випадання карбідів хрому при нагріванні сталі до температури 600 - 700 ° С.
5.2 Точкова (пітінгова) корозія
Пітінгова корозія - один з небезпечних видів локального корозійного руйнування, характерного для умов, коли пасивний стан поверхні металу або сплаву може частково порушуватися. При цьому корозії піддаються дуже обмежені ділянки металу, а вся інша поверхня знаходиться в стійкому пасивному стані, що призводить до появи точкових виразок або глибоких пітінгів. Зазвичай такий корозії піддаються легкопасивуємі метали і сплави: хромисті і хромонікелеві сталі, алюміній і його сплави, нікель, титан та ін.
Пітінгова корозія виникає в розчинах, що містять окислювачі (наприклад кисень) і одночасно аніони-активатори (Cl‒, Br‒, I‒), наприклад, у розчинах хлорного заліза, в морській воді, у сумішах азотної і соляної кислот та ін. Основна умова утворення пітінга - зміщення електрохімічного потенціалу, за рахунок наявності окислювачів у розчині, позитивніше деякого критичного значення, так званого потенціалу пітінгоутворення, при цьому поверхня пітінга є анодом і руйнується з високою швидкістю внаслідок контакту з іншою поверхнею, що знаходиться в пасивному стані і представляє собою, завдяки відносно великій площі, майже неполяризуємий катод.

Рис. 5.2. Крупний пітінг на поверхні неіржавіючої сталі 03Х18Н11: а – збільшення в 300 раз; б ‒ збільшення в 1000 раз; в ‒ збільшення в 8000 раз.
При розвитку пітінгової корозії слід розрізняти три стадії: виникнення, розвиток пітінга і репасивація. Виникнення пітінга пов'язано з порушенням пасивного стану на окремих ділянках поверхні металів і сплавів внаслідок впливу аніонів-активаторів. На цих ділянках відбувається прискорене руйнування оксидних плівок, що викликає місцеву активацію. Порушення пасивного стану на окремих ділянках призводить до збільшення швидкості корозії. Такими ділянками можуть бути неметалічні включення (наприклад cульфіди), границі зерен, ділянки із зниженою концентрацією хрому в твердому розчині, які можуть утворюватися при термообробці, та ін.
Виникнення точкової корозії металів і сплавів в досить в значній мірі залежить від природи аніонів та їх концентрації. Найбільш сильними аніонами-активаторами є Cl‒, Br‒. Такі аніони, як OH‒, CrO42‒, NO3−, SO42−, ClO3− ускладнюють виникнення точкової корозії нержавіючої сталі в розчині хлориду натрію.
На виникнення точкової корозії впливають склад сплаву, природа металу, стан поверхні і т. д. Наприклад, з підвищенням вмісту нікелю і хрому опір сталей до точкової корозії підвищується. Термічна обробка підвищує схильність сталей до точкової корозії. Так, наприклад, відпуск нержавіючих сталей хромонікелевих викликає схильність до міжкристалітної корозії і знижує опір сталі до точкової корозії.
Зростання пітінга пов'язане з роботою корозійного гальванічного елемента, в якому анодом є пітінг, а катодом - інша поверхня металу, що знаходиться в пасивному стані. Ефективній роботі такого корозійного елемента сприяє достатня кількість деполяризатора, а також перебування пітингу в активному стані, чому сприяє зниження рН розчину. Швидкість корозії в пітінгів різна. У більшості з них процес корозії з плином часу сповільнюється, в частині пітінга корозія припиняється зовсім, і лише в невеликій частині вона розвивається всередину металу. Явище припинення росту пітінга називається репасивацією.
Для захисту від точкової корозії використовують електрохімічні методи, інгібітори і легування металу. Так, легування сталей хромом, кремнієм, молібденом підвищує їх стійкість до точкової корозії.
5.3 Контактна корозія
Контактної корозією називається електрохімічна корозія, викликана контактом металів, що мають різні стаціонарні потенціали в даному електроліті. При цьому виникає корозійний гальванічний елемент, робота якого впливає на швидкість корозії контактуючих металів. Робота корозійного елемента визначається опором анодного і катодного процесів і омічним опором. Зі збільшенням різниці між стаціонарними потенціалами катода і анода, зменшенням омічного опору і опору катодного і анодного процесів контактна корозія зростає. Як правило, корозія металу, що має більш негативний потенціал (анод) збільшується, а швидкість корозії металу з більш позитивним потенціалом (катод) знижується в порівнянні зі швидкістю за відсутності контакту. На контактну корозію металів великий вплив мають площі катодів і анодів, склад середовища, перемішування нейтрального розчину та ін. Зі збільшенням площі катода при постійній площі анода швидкість контактної корозії зростає. Якщо швидкість корозії контролюється швидкістю дифузії, наприклад дифузією кисню при корозії з кисневою деполяризацією, то із збільшенням площі катода швидкість контактної корозії підвищується. При перемішуванні нейтрального розчину зростає дифузія кисню до поверхні катода, отже, збільшується контактна корозія.
Контактна корозія може проявлятися і в атмосферних умовах. При цьому максимальна швидкість корозії спостерігається на ділянках, безпосередньо прилеглих до місця контакту. У міру віддалення від місця контакту щільність струму корозійного елемента падає і, отже, швидкість контактної корозії знижується.
Для захисту від контактної корозії в основному застосовуються такі методи:
- підбір контактуємих металів і сплавів з мінімальною різницею потенціалів;
- ізоляція металів у місцях контакту;
- введення в закриті системи інгібіторів, що знижують корозію контактуємих металів.
5.4 Щілинна корозія
Щілинний корозією називають посилення корозії в щілинах і зазорах між металами, прокладними матеріалами та металом, в морських умовах (між шаром мікроорганізмів і обшивкою корабля). Найбільш чутливі до щілинної корозії пасивуючі метали (нержавіючі сталі, алюмінієві сплави, титан та ін.)
Механізм щілинної корозії полягає в наступному. З плином часу через ускладнення доступу окислювача і витрачання його в процесі корозії в щілинах знижується концентрація окислювача і, тим самим, знижується швидкість катодного процесу. Відбувається зменшення катодного струму, при цьому потенціал катода зміщується в негативну сторону, що призводить до переходу поверхні металу щілини в активний стан і швидкість його розчинення збільшується. Поява в розчині продуктів корозії і їх гідроліз призводять до підкислення розчину. Подальше протікання корозійного процесу при обмеженій швидкості підведення свіжого електроліту сприяє зниженню рН, що полегшує анодний процес розчинення металу і створює можливість протікання корозії з водневою деполяризацією. Це призводить до збільшення корозійного струму, процес підкислення розчину прискорюється, і метал в щілинах при зсуві потенціалу в негативну сторону стає анодом по відношенню до металу відкритої поверхні. Це зазвичай спостерігається в практичних випадках щілинної корозії. Залежно від виду контролю електрохімічної корозії утруднення доступу кисню може викликати збільшення або зменшення швидкості корозії металу в щілині. Якщо швидкість корозії контролюється анодним процесом, то гальмування доступу кисню викликає збільшення швидкості корозії металу. Якщо ж швидкість корозії контролюється катодним процесом, утруднення доступу кисню викликає зменшення швидкості корозії металу.
Особливо чутливі до щілинної корозії метали і сплави, пасивний стан яких пов'язаний з наявністю в електроліті розчиненого кисню і інших пасиваторів. Утруднення доступу цих речовин в щілини призводить до зниження їх концентрації нижче критичного значення, в результаті чого метал переходить з пасивного в активний стан і відбувається щілинна корозія. Зниження рН розчину до 3,5 - 4,0 сприяє посиленню щілинної корозії.
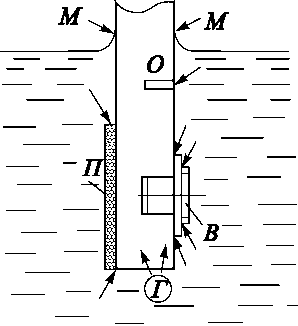
Рис. 5.3. Сприятливі місця для розвитку щілинної корозії : П - ізолююче покриття; Г - газовий пухирець; О - вузький отвір; В - різьбове з’єднання з шайбами, фланцями, прокладками; М - границя контакту розчину с металічним виробом.
6 КЛАСИФІКАЦІЯ МЕТОДІВ ЗАХИСТУ КОНСТРУКЦІЙ ВІД КОРОЗІЇ
У процесі експлуатації хімічного обладнання метали піддаються корозійному руйнуванню, що призводить до їх передчасного виходу з ладу. На швидкість корозії мають істотний вплив матеріал, з якого виготовлено обладнання, його конструкційні особливості, природа агресивного середовища і умови експлуатації. Для підвищення довговічності і надійності експлуатації проектованих апаратів і виробів необхідно правильно вибрати матеріал для виготовлення вузлів та деталей і найбільш ефективний захист від корозії.
Корозію металів можна уповільнити зміною їх стаціонарних потенціалів, пасивуванням, нанесенням захисних покриттів, зниженням концентрації окислювача в корозійному середовищі, ізоляцією поверхні металу від окислювача і т. д. При розробці методів захисту від корозії використовують різні способи зниження швидкості корозії, які вибираються залежно від характеру корозії і умов її протікання. Вибір того чи іншого способу визначається його ефективністю, а також економічною доцільністю. Методи захисту металів від корозії розрізняються за механізмом захисної дії і за способом застосування захисту.
За механізмом захисної дії методи захисту металів від електрохімічної корозії можна розділити на наступні:
- методи, які гальмують переважно катодний процес (застосування катодних інгібіторів, зменшення концентрації катодного деполяризатора в розчині, застосування електрохімічної катодного захисту, зниження катодних включень у сплаві);
- методи, які гальмують переважно анодний процес (застосування анодних інгібіторів або пасиваторів, легування сплаву з метою підвищення пасивності, застосування анодного електрохімічного захисту);
- методи, що збільшують омічний опір системи (застосування ізоляційних прокладок між катодними і анодними ділянками системи);
- методи, що знижують термодинамічну нестабільність корозійної системи (покриття активного металу суцільним шаром термодинамічно стійкого металу, легування термодинамічно нестабільного металу значною кількістю стабільного компоненту, повна ізоляція металу від корозійного середовища);
- змішані методи, тобто методи, які гальмують одночасно кілька стадій корозійного процесу.
Найбільш ефективним методом захисту металів від корозії зазвичай є метод, який переважно гальмує основну контролюючу стадію даного електрохімічного корозійного процесу.
Застосування методів захисту, що зменшують ступінь термодинамічної нестійкості системи, завжди в тій чи іншій мірі буде сприяти зниженню швидкості корозійного процесу. При паралельному застосуванні декількох методів захисту металів від корозії, як правило, легше досягти більш повного захисту, якщо всі ці методи діють переважно на основну контролюючу стадію електрохімічного корозійного процесу. Наприклад, при зменшенні корозії металу додаванням анодних інгібіторів (пасиватором) посилення ефекту захисту буде досягатися також введенням катодних присадок в сплав або додаткової анодної поляризацією.
За способом застосування всі методи захисту металів від корозії поділяються на кілька груп.
6.1 Металеві захисні покриття.
Роль захисту від корозії зводиться до підвищення термодинамічної стійкості металу і до ізоляції виробів від корозійного середовища. За методом нанесення металеві захисні покриття піоділяються на горячедифузійні і гальванічні покриття.
До гарячедифузійних покриттів відностяться покриття, що наносяться механофізичними методами і засновані на взаємодії металу виробу з покриваючим металом, який знаходиться у вигляді розплаву, парів солей або у вигляді листів. До цієї групи відносяться: гаряче, дифузійне, металізаційне і плакіровочне покриття.
До гальванічних покриттів відносяться покриття, що наносяться електрохімічним методом.
6.2 Неметалічні покриття
Захисні властивості неметалічних покриттів зводяться до ізоляції захищаємих виробів від корозійного середовища. До неметалічних покриттів відносяться:
- неорганічні покриття (оксидні, фосфатні, емалеві покриття);
- органічні покриття (лакофарбові, бітумні покриття та полімерні плівки).
6.3Корозійностійкі матеріали
Легування заліза такими металами, як нікель, хром, марганець, кремній, алюміній, молібден, вольфрам, дозволяє підвищити корозійну стійкість металу за рахунок утворення на його поверхні корозійно стійкої оксидної плівки. За складом сплави заліза поділяються на низьколеговані (до двох відсотків легуючих компонентів) і високолеговані, коли залізо легують одним або кількома легуючими компонентами (загальний вміст легуючих компонентів понад 15%), наприклад нержавіюча сталь 12Х18Н10Т. Сюди слід також віднести неметалеві конструкційні матеріали.
6.4 Обробка корозійного середовища
Застосовують два основних методи захисту: видалення з розчину агресивних агентів, які прискорюють корозійний процес, і застосування інгібіторів корозії, які знижують дію агресивних агентів. У першому випадку видаляють з агресивного середовища деполяризатор при роботі корозійного елемента. Наприклад, кип'ятінням видаляють з розчину кисень, що призводить до зниження швидкості корозії з кисневою деполяризацією.
Інгібітори (сповільнювачі корозії) за механізмом дії поділяються на катодні, анодні і змішані. Механізм захисної дії інгібіторів полягає в адсорбції інгібітора на кородуючій поверхні з наступним гальмуванням катодних або анодних процесів корозійного елемента.
6.5 Електрохімічний захист
Він підрозділяється на протекторний, катодниц, анодний і дренажний. Такий захист широко застосовується для захисту підземних і підводних споруд.
6.6 Комплексний електрохімічний захист
При такому захисті застосовуються два і більше методів захисту від корозії, що сприяє більш високогму ступеню захисту виробів від корозії, наприклад захисне покриття плюс катодний захист; захисне покриття плюс катодний захист плюс обробка грунту та ін.
Вибір методу захисту обладнання від корозії обумовлюється ступенем агресивності робочих компонентів, а також зовнішніми умовами, тобто ступенем агресивності середовища, в якому знаходиться апарат чи машина.
7 КОРОЗІЙНОСТІЙКІ І ЖАРОСТІЙКІ КОНСТРУКЦІЙНІ МАТЕРІАЛИ
На хімічну промисловість припадають найбільші втрати від корозії. Це пояснюється високою агресивністю середовищ, жорсткими умовами проведення процесів, застосуванням апаратів складної конструкції. Різноманіття фізичних і хімічних процесів вимагає розширеного асортименту конструкційних матеріалів у хімічному машинобудуванні. В даний час для виготовлення хімічних апаратів застосовуються різні метали і сплави. Найбільше застосування знайшли сталі: вуглецеві, хромисті, хромонікелеві, хромомарганцеві, хромонікельмолібденові, високолеговані аустенітні, корозійностійкі сплави на нікелевій основі, сплави титану з молібденом, паладієм, сплави на основі свинцю і міді та ін. В останні роки розроблено метод отримання хромистих сталей зі зниженим вмістом вуглецю, хромомарганцевих сталей зі зниженим вмістом нікелю (до 4%) або таких, що зовсім не містять нікелю.
Також в хімічному машинобудуванні знайшли застосування неметалеві матеріали на органічній основі (пластмаси, вуглеграфітові матеріали, каучуки, гуми та ін.), і неорганічної основі ( природні кислототривкі, штучні плавлені силікатні, керамічні та ін. ).
7.1 Характеристика корозійної стійкості металів
Під поняттям корозійностійкі метали і сплави розуміють конструкційні матеріали, які в агресивних корозійних середовищах володіють достатньою корозійною стійкістю і жаростійкістю і можуть бути використані без спеціальних засобів протикорозійного захисту. При цьому корозійна стійкість конструкційного матеріалу полягає не лише у збереженні його основної маси, а й виконанні функціональних навантажень самої металевою конструкцією. Хімічна стійкість металів в газах при високих температурах залежить від природи і властивостей оксидних плівок, міцності їх зчеплення з металом. Стійкість металів в електролітах визначається величинами їх термодинамічних потенціалів і здатністю до пасивації. Перехід металу в пасивний стан супроводжується стрибкоподібною зміною значення потенціалу. Характеристика корозійної поведінки металу є відносною, дійсною лише для певних умов.
Наявність у металів в даному агресивному середовищі помітною корозійної стійкості по відношенню до електрохімічної корозії обумовлено наступними причинами. Метал стійкий до корозії внаслідок своєї термодинамічної стабільності. Термодинамічну можливість протікання електрохімічної корозії визначаємо по зміні енергії Гіббса. Характеристика ступеня термодинамічної стабільності різних металів приблизно може бути зроблена за величиною стандартних електродних потенціалів: чим більше електронегативним є потенціал металу, тим він активніше (таблиця 7.1).
Деякі метали, наприклад залізо, алюміній, титан, хром, нікель відносно стійкі завдяки настанню пасивного стану. Пасивний стан поверхні металу порушується за наявності в розчині деяких активних іонів (іони хлору, брому, фтору) і, навпаки, посилюється при наявності окислювачів. Частина металів стійка внаслідок виникнення малорозчинних і досить щільних плівок на поверхні з продуктів корозії. Деякі метали корозійностійкі через відсутність домішок, що утворюють ефективні катоди, так як наявність забруднень може призвести до утворення корозійних мікрогальванічних елементів.
Таблиця 7.1
Е0, В |
Характеристика термодинамічної стійкості металів |
Вірогідні корозійні процеси |
Негативні-ше ‒ 0,414 |
Понижена термодинамічна стійкість – неблагородні метали Zn, Mn, Fe та ін. |
Корозія в нейтральних середовищах, що не містять кисню і окислювачів |
‒ 0,414 0,0
|
Недостатня термодинамічна стійкість - метали Cd, Ni, Sn |
Корозія в нейтральних середовищах тільки при наявності кисню і окислювачів |
0,0….0,815 |
Проміжна термодинамічна стабільність – напівблагородні метали Cu, Bi, Ag |
Корозійно стійкі за відсутності кисню і окислювачів в кислих та нейтральних середовищах |
Позитив-ніше + 0,815 |
Висока термодинамічна стійкість - благородні метали Au, Pt, Pd |
Стійкість в нейтральних середовищах за наявності кисню, окислювачів або комплексоутворювачів |
Примітка. Величини електродних потенціалів -0,414 В і +0,815 В являють собою значення рівноважних потенціалів водневого і кисневого електродів в нейтральному середовищі.
7.2 Корозійностійке легування металів
Теорія корозійностійкого легування металів, стійких до електрохімічної корозії, ґрунтується на вченні про контролюючі фактори корозії - омічного, катодного і анодного гальмування процесу корозії. На основі цих чинників розроблено три напрямки підвищення корозійної стійкості сплавів:
1. Створення сплавів, що утворюють більш досконалий захисний шар продуктів корозії на своїй поверхні. У метал вводять компоненти, що сприяють утворенню щільної захисної плівки на поверхні металу. Гальмування корозії досягається як за рахунок збільшення омічного опору, так і за рахунок екрануючого шару, гальмуючого доставку до металевої поверхні речовин, необхідних для протікання катодного процесу або видалення продуктів електродної реакції. Наприклад, при легуванні заліза міддю настає пасивний стан заліза, але цей метод має обмежене застосування, так як при електрохімічній корозії важко досягти повного екранування поверхні.
2. Зменшення катодної активності металів. Захисні властивості металів підвищуються внаслідок зменшення площі мікрокатодів або збільшення перенапруги виділення водню на мікрокатодах, тобто відбувається гальмування катодного процесу. При легуванні заліза сурмою, вісмутом, миш'яком збільшується перенапруження виділення водню
3. Зниження анодної активності металів. Захисні властивості металів підвищуються в результаті зменшення активності анодної фази шляхом введення компонентів, що підвищують або термодинамічну стійкість сплаву, або його пасивність. Підвищення корозійної стійкості, наприклад, сталі, досягається легуванням її хромом, хромом та нікелем, хромом, нікелем і невеликими добавками паладію. Який з наведених методів підвищення корозійної стійкості сплавів надійніше і перспективніше, можна визначити виходячи з конкретних умов. При кислотній корозії у відновних середовищах з виділенням водню і за відсутності можливості підвищення схильності до пасивації дуже корисними можуть виявитися методи зменшення катодної активності сплавів або підвищення термодинамічної стійкості анодної фази. В умовах можливості встановлення пасивного стану, навпаки, зовсім не ефективні методи зниження катодної активності, а виявляться корисними всі методи, що знижують анодну активність сплавів. При можливості встановлення пасивного стану сплаву ефективним є метод введення активних катодів. Однак цей метод виявиться шкідливим, якщо за умовами корозії (відновлювальна середовище, наявність іонів хлору) встановлення стійкого пасивного стану неможливо.
Підвищення корозійної стійкості металів у кислотах досягається кислотостійким легуванням. Корозія металів у кислотах з неокислюючимся аніоном (розбавлена сірчана кислота, соляна кислота) протікає, в основному, з водневою деполяризацією. При корозії в окислюючих кислотах (азотна кислота, концентрована сірчана кислота) основним катодним процесом є відновлення аніона кислоти.
Корозійну стійкість сплавів в окислюючих кислотах можна підвищити, вводячи легко пасивуючі метали, наприклад хром. Сталь, легована хромом, має підвищену стійкість в азотній кислоті. Стійкість металів у кислотах, в яких можливе настання пасивного стану, підвищується також у результаті легування металами, які є ефективними катодами. Так, легування сталі типу Х18Н10 паладієм підвищує стійкість сплаву в сірчаної кислоти.
Для підвищення корозійної стійкості в неокислюючих кислотах сплави легують молібденом і міддю. Кислотостійкість молібдену пояснюється його схильністю до пасивування і утворення захисних плівок. Кислотостійкість міді пов'язана з її термодинамічною стійкістю в умовах корозії з водневою деполяризацією. При корозії легованих міддю сплавів їх поверхня збагачується міддю внаслідок її більш високої корозійної стійкості.
7.3 Жаростійке легування металів
Жаростійкі називають сплави, що володіють здатністю чинити опір хімічному впливу окисних газів при високих температурах. Якщо деталі машин та апаратів, що використовуються при високих температурах, піддаються механічному впливу, то метал повинен мати і жароміцні властивості.
При жаростійкому легуванні на поверхні сплаву утворюється захисна оксидна плівка легуючого компонента, яка ускладнює дифузію реагентів і окислення основного металу. Оксидна плівка легуючого елемента повинна бути суцільною, тобто її об’єм повинен бути більше об'єму металу, з якого вона утворена. Щоб перешкоджати зустрічній дифузії іонів металу, електронів та іонів кисню, оксидна плівка повинна мати високий електричний опір. Розмір іонів легуючого компонента менше, ніж розмір іонів основного металу, що полегшує дифузію легуючого компоненту на поверхню сплаву, де утворюється оксидна плівка. При цьому кристалічна решітка легуючого компонента з меншими параметрами перешкоджає дифузії основного металу. Оксид легуючого компонента повинен мати високі температури плавлення і сублімації і не утворювати низькоплавкої евтектики в суміші з іншими оксидами. З основним металом легуючий компонент утворює твердий розчин, необхідний для рівномірного розподілу його в металі і створення оксидної плівки на всій поверхні сплаву.
7.4 Класифікація корозійностійких сплавів
Залежно від цілей застосування і умов експлуатації корозійностійкі сплави класифікуються за трьома ознаками:
- за складом: сплави на залізній основі, мідні, нікелеві, цинкові, алюмінієві, магнієві, сплави благородних металів та ін;
- за характером корозійної стійкості: нержавіючі сталі, тобто стійкі в атмосферних умовах, у водних розчинах солей, кислот і основ; кислотостійкі сплави - стійкі в розчинах кислот; жаростійкі сплави - стійкі в газовій атмосфері при високій температурі; сплави спеціальних видів корозійної стійкості (ерозійностійкі, стійкі до корозійного розтріскування і ін);
- за структурою: тверді розчини, бінарні сплави з анодним фоном, бінарні сплави з катодним фоном, більш складні гетерогенні сплави.
У хімічному машинобудуванні використовують різні метали, які, перебуваючи в контакті, можуть змінювати свою корозійну поведінку. Для забезпечення надійної роботи хімічної апаратури, що складається з різних металів, необхідно, щоб корозія металів не змінювалася або навіть зменшувалася при контакті. Використовуючи пасиваційні характеристики металів в даному корозійному середовищі, можна підібрати контактуючі метали так, щоб вони знаходилися в пасивному стані. Корозійна поведінка металів, що знаходяться в гальванічному контакті, залежить також від співвідношення їх поверхонь.
7.5 Корозійностійкі сплави на основі заліза
Серед багатьох металів і сплавів, що застосовуються в якості конструкційних матеріалів, значне місце займають сплави на основі заліза. До них відносяться звичайні і низьколеговані сталі, які використовуються в слабо агресивному середовищі, а також високолеговані хромисті і хромонікелеві нержавіючі сталі, що застосовуються в більш агресивному середовищі, ніж звичайні або низьколеговані сталі.
Стандартний електродний потенціал заліза E0Fe = - 0,44 В, стаціонарний потенціал його в 3% розчині хлориду натрію дорівнює - 0,50 В, тому залізо може кородувати з кисневою та водневою деполяризацією.
У нейтральних розчинах корозія заліза протікає переважно з кисневою деполяризацією. Корозія заліза протікає в декілька стадій:
- первинний анодний процес
Fe – 2e = Fe2+;
- взаємодія катіона заліза з гідроксид-іонами:
Fe2+ + 2OH− = Fe(ОН)2;
- окислення гідроксиду заліза (II) киснем повітря до гідроксиду заліза (III) і перехід в іржу:
4Fe(ОН)2 + О2 + 2Н2O = 4Fe(ОН)3.
Іржа покриває метал пухким шаром, тому погано захищає його від подальшої корозії. На корозійну стійкість залізовуглецевих сталей впливають хімічний склад і структура сплаву. Залізовуглецеві сталі у своєму складі мають ферити, аустеніт, цементит і чистий вуглець (у чавуні). Всі ці структурні складові мають різні електродні потенціали, що впливає на швидкість корозійного процесу. На корозійний процес мають також вплив хімічного складу сплаву і домішки.
Із збільшенням вмісту вуглецю в сталі в кислих розчинах швидкість корозії збільшується. Наприклад, швидкість корозії чавуну в 100 разів вище швидкості корозії чистого заліза. Марганець, поліпшуючи механічні властивості залізовуглецевих сталей (0,5-0,8%), не впливає на швидкість корозії. Спеціальні сталі (марганцевокислі), що містять 12% марганцю, володіють підвищеною корозійною стійкістю. Зростання вмісту кремнію в сталях до 0,3% і в чавунах до 2,0% не впливає на корозійну стійкість сталі. При збільшенні вмісту кремнію у спеціальних кременистих сталях швидкість корозії підвищується, що, можливо, пов'язано зі схильністю цих сталей до розтріскування. а при вмісті кремнію понад 14% спостерігається підвищення корозійної стійкості. Сірка утворює з залізом і марганцем сульфіди, які є катодними включеннями і сприяють збільшенню швидкості корозії. Насичення сталі вуглецем призводить до розтріскування, зниження пластичних властивостей, збільшення крихкості.
Низьколеговані сталі.
Низьколеговані сталі містять, в основному, невеликі кількості міді, хрому, кремнію, нікелю, алюмінію та ін. По корозійній стійкості вони перевершують звичайні залізовуглецеві сталі лише в слабоагресивних середовищах, тому застосовуються обмежено.
Легування низьковуглецевої сталі міддю (0,3-0,8%) підвищує її корозійну стійкість в атмосферних умовах, що пов'язано з утворенням на поверхні сталі плівки з високими захисними властивостями. Легування сталі невеликими кількостями хрому (до 2%) підвищує міцність сталі, не змінюючи її корозійної стійкості. Добавка нікелю в невеликих кількостях (до 1%) підвищує корозійну стійкість сталі в атмосферних умовах.
Високолеговані нержавіючі сталі.
Сталі, що містять велику кількість хрому, нікелю та кремнію, мають високу корозійну стійкість і називаються високолеговані. Найбільшого поширення набули хромисті і хромонікелеві аустенітні нержавіючі сталі.
Високохромисті сталі.
Залізо і хром утворюють безперервний ряд твердих розчинів на основі кристалічної решітки фериту і аустеніту, хром також утворює карбіди з вуглецем. Хімічна стійкість залізохромових сплавів заснована на їх пасивіуємості. Хром, перебуваючи в твердому розчині з залізом, в значній мірі підвищує здатність заліза до пасивування. Чим більше в сплаві хрому, тим легше наступає пасивність і тим важче сталь переходить в активний стан. Корозійна стійкість нержавіючих сталей визначається також умовами середовища. Одні середовища сприяють виникненню пасивного стану, інші, навпаки, руйнують пасивну плівку. Наприклад, окислювачі, анодна поляризація, зниження температури середовища сприяють утворенню пасивної плівки. Наступ пасивного стану хромистих сталей до деякої міри підкоряється правилу Таммана про межі стійкості твердих розчинів. Перша межа стійкості з'являється при вмісті хрому в сталі понад 12%. При цьому електродний потенціал різко облагороджується, сталь переходить в пасивний стан і швидкість корозії різко падає. Сталь стійка в розведеній азотній кислоті і в нейтральних розчинах. При подальшому підвищенні вмісту хрому здатність сталі до пасиваіції посилюється, і при вмісті хрому 17% в сталі з'являється нова межа стійкості. Така сталь стійка в гарячій розведеній азотній кислоті і в атмосфері, насиченій водяною парою.
При вмісті хрому 35,8% з'являється третя межа стійкості. Сталь корозійностійка до таких активних середовищ, як 30% розчин хлорного заліза.
Корозійні властивості хромистих сталей сильно залежать від вмісту в них вуглецю. Чим більше в сплаві вуглецю, тим більше хрому бере участь в утворенні карбідів хрому і тим більше його необхідно ввести в сплав, щоб отримати стійку феритну структуру.
Хромисті сталі мають високу жаростійкість, тобто здатність проти окислення при високих температурах. Жаростійкість хромистих сталей цілком визначається вмістом в них хрому.
Корозійна стійкість хромистих сталей залежить також від режимів їх термічної обробки. Після загартування хром і вуглець перебувають у твердому стані, і сплав має високу корозійну стійкість. При відпуку після гарту випадають карбіди хрому, в результаті чого корозійна стійкість сплаву знижується. Тому для забезпечення високої корозійної стійкості хромової сталі зі збільшенням змісту вуглецю необхідно вводити в неї додаткову кількість хрому.
Як корозійностійких конструкційних сталей набули поширення три групи сплавів:
˗ сталі з вмістом 12-14% хрому і різних кількостей вуглецю з повним або частковим фазовим перетворенням. Залежно від змісту вуглецю розрізняють такі марки сталей: 08Х13, 12Х13, 20Х13. Максимальна корозійна стійкість цих сталей спостерігається після гарту з відпуском, що відповідає максимальному вмісту хрому в твердому розчині. Ці сталі стійкі в прісній воді, а також в атмосферних умовах. У морській воді та морській атмосфері сильно піддаються корозії. Стійкі у холодній розведеній азотній кислоті. У соляній і сірчаній кислотах сильно піддаються корозії.
˗ сталі з вмістом 17-18% хрому, напівферитні сталі з частковим фазовим перетворенням: 08Х17, 12Х17, 12х18. Сталі цього класу більш корозійностійкі як в умовах впливу окисних середовищ, так і у високотемпературних газових середовищах. У цих сталей погіршуються механічні властивості, особливо ударна в'язкість, не можуть зварюватися.
˗ сталі з вмістом 25-30% хрому не мають фазових перетворень. До них відносяться сталі типу 15Х25, 15Х28. Ці сталі не піддаються загартуванню, мають високу пластичність. Однак при зварюванні знижується пластичність зварних швів і з'являється схильність до міжкристалітної корозії в зоні термічного впливу. Добавка до цих сталей невеликих кількостей благородних металів, наприклад паладію або платини, сприяє переходу високохромистих сталей в пасивний стан і в неокислюючих кислотах (соляній і розведеній сірчаній кислотах).
Хромонікелеві сталі.
Нікель утворює з залізом безперервний ряд твердих розчинів і сприяє утворенню аустенітних сталей. Найбільше застосування в промисловості знаходять хромонікелеві сталі типу 12Х18Н10, містять 17-20% хрому і 8-16% нікелю. Ці сталі мають високу корозійну стійкість, володіють хорошими механічними і технологічними властивостями, добре піддаються зварюванню. Однак у хромонікелевих сталях може виникати схильність до міжкристалітної корозії, особливо після тривалого або повторного нагрівання загартованої сталі, внаслідок випадання по межах зерен карбідів. Небезпечними зонами при зварюванні аустенітних сталей є зони по лініях сплаву. Для зниження схильності сталі до міжкристалітної корозії рекомендується: легування карбідоутворюючими елементами - титаном, ніобієм, танталом, які володіють великим спорідненістю до вуглецю, ніж хром; зниження вмісту вуглецю до 0,015% і менше; тривале нагрівання при температурі 870 °С з метою коагуляції карбідів хрому, порушення суцільності карбідної сітки і вирівнювання концентрації хрому, що призводить до підвищення пасивуємості зон близько кордонів зерен.
Корозійна стійкість хромонікелевих сталей може бути підвищена легуванням їх молібденом, міддю і кремнієм. Сталі 10Х17Н13М2Т стійкі в середовищах, що містять хлор-іони, і в органічних кислотах. Для більш агресивних середовищ, наприклад при виробництві сірчаної кислоти, застосовують сталі з підвищеним вмістом хрому і нікелю типу 06Х23Н28МДТ. Ця сталь має високу пластичність, гарну зварюваність і має підвищену корозійну стійкість.
7.6 Корозійна стійкість мідних сплавів
Стандартний електродний потенціал міді E0Cu 2 / Cu + = +0,34 В, в 3%-му розчині кухонної солі він дорівнює + 0,05 В, тому мідь в більшості випадків кородує з кисневою деполяризацією. У воді і нейтральних розчинах, що не містять сполук, які з катіонами міді можуть утворювати комплексні іони, мідь володіє високою корозійною стійкістю. Підвищена корозійна стійкість міді визначається утрудненням протікання анодного процесу, викликаного не явищем пасивності, а досить високою термодинамічною стійкістю міді. В атмосферних умовах вона корозійностійка, внаслідок утворення на її поверхні плівки, що складається з продуктів корозії Сu(ОН)2 • СuСО3. Структура мідних сплавів у більшості випадків однорідна, так мідь з багатьма компонентами утворює тверді розчини в широких межах концентрацій. Корозійні властивості мідних сплавів, як правило, дещо вище, ніж у чистої міді, так як легуючі компоненти підвищують стійкість захисних оксидних плівок.
У промисловості знаходять широке застосування сплави міді: бронза (мідь-олово, мідь-алюміній), латунь (мідь- цинк), мельхіор (мідь-нікель), нейзильбер (мідь-нікель-цинк). Бронзами називають сплави міді з оловом, алюмінієм, марганцем та іншими металами. Оловянисті бронзи, що застосовуються в промисловості, містять не більше 10% олова. Корозійна стійкість оловянистих бронз трохи вище, ніж міді. Вони корозійностійкі в атмосферних умовах, морській воді і сірчаній кислоті невисокої концентрації.
Алюмінієві бронзи містять 9-10% алюмінію. Вони мають дещо гірші ливарні властивості, ніж оловянисті бронзи, але високу механічну міцність і більш високу корозійну стійкість.
Латунь містить 10-50% цинку. Латуні із вмістом до 39% цинку представляють собою однорідний α-твердий розчин, сплав з вмістом 47-50% цинку - β-латуні, а при вмісті 39-47% цинку - двофазний сплав α + β-латуні.
По корозійній стійкості у атмосферних умовах латуні займають проміжне положення між міддю і цинком. Корозійна стійкість латуні підвищується при додатковому легуванні нікелем, оловом, алюмінієм. Латунь зі змістом 1% олова називається адміралтейської латунню, вона володіє високою корозійною стійкістю в морській воді.
Характерним видом корозії латуней є обезцинкування і корозійне розтріскування. Обезцинкування латуней - це корозійне руйнування латуней, особливо містять багато цинку. Атоми цинку в твердому розчині Cu-Zn зберігають підвищену електрохімічну активність у порівнянні з атомами міді і переважно переходять в розчин. Атоми міді в залежності від умов можуть перейти в розчин, утворити суцільний, більш збагачений міддю поверхневий шар або перейти в стан адсорбованих атомів, що виділяються на поверхні у вигляді пухкого шару губчастої міді. Розвинена поверхня осаду міді підвищує ефективність катодного процесу і сприяє прискореної корозії. Додаткове введення в латунь невеликих кількостей миш'яку (0,04 - 0,08%), сурми або фосфору помітно знижує схильність латуні до обезцинкуванню. Корозійне розтріскування пов'язано з наявністю у сплаві розтягуючих напружень (внутрішні або додані ззовні). Подібне руйнування може протікати як між-, так і транскрісталітно. Швидкість розвитку корозійного розтріскування латуней може бути значною, якщо в атмосфері містяться аміак або сірчистий ангідрид.
Мельхіор володіє більш високою корозійною стійкістю в морській атмосфері і морській воді, ніж бронзи та латуні.
7.7 Корозійна стійкість алюмінієвих сплавів
Алюміній володіє цілим рядом цінних фізико-механічних властивостей, тому він знаходить широке застосування. Завдяки високій пластичності алюміній добре прокочується і штампується, добре зварюється і обробляється. Однак ливарні властивості алюмінію невисокі, і з цієї причини лиття з алюмінію знайшло обмежене застосування. Стандартний потенціал алюмінію E0Al3 + / Al = - 1,66 В. На повітрі алюміній покривається плівкою оксиду алюмінію Аl2О3, при цьому електродний потенціал підвищується. У 3% розчині кухонної солі електродний потенціал алюмінію дорівнює - 0,55 В, тому в нейтральних розчинах електролітів алюміній може кородувати як з кисневою, так і з водневою деполяризацією. Наявність на поверхні алюмінію оксидної плівки додає йому високу корозійну стійкість в атмосферних умовах і в нейтральних розчинах.
У промисловості застосовуються сплави алюмінію з міддю, цинком, марганцем, кремнієм і ін. Сплави алюмінію володіють кращими технологічними властивостями і більш високою міцністю, ніж чистий алюміній. У корозійному відношенні всі алюмінієві сплави мають значно меншу стійкість, ніж чистий алюміній.
Дюралюміній ˗ сплав алюмінію з міддю ˗ має високу механічну міцність, але низькою корозійною стійкістю. Корозійну стійкість дюралюмінію підвищують плакуванням його чистим алюмінієм.
По відношенню до дюралюмінію чистий алюміній є анодом, тому здійснює не тільки механічну, а й електрохімічний захист поверхні сплаву.
З сплавів на основі алюмінію, що мають хороші ливарні властивості і високою корозійною стійкістю, найбільше застосування знайшли силуміни - сплав алюмінію з кремнієм. Корозійна стійкість силумінів пояснюється утворенням на їх поверхні комбінованої плівки, що складається з оксидів алюмінію і кремнію. Дюралюміній і силумін широко використовуються в різних галузях промисловості. Алюміній і його сплави дуже чутливі до контактування з іншими металами. Найбільш небезпечними є контакти з більш позитивними металами - міддю і мідними сплавами. У ряді умов шкідливий контакт з залізом, сталлю. Контакт з цинком і кадмієм в умовах, коли алюміній знаходиться в пасивному стані, нешкідливий і навіть кілька захищає. У результаті небезпечних контактів відбувається більш істотне руйнування алюмінію в електропровідних середовищах, що містять іони хлору.
7.8. Поведінка металів і сплавів в агресивних хімічних середовищах.
7.8.1 Залізо та його сплави
Потенціал заліза при активній корозії близький до потенціалу процесу Fe→Fe2++2e, т.б. Е0= – 0,44 В. У окисних умовах залізо має більш позитивний електрохімічний потенціал у зв'язку з його пасивацією.
Проте за своєю схильності до пасивації залізо знаходиться приблизно в середині ряду пасивності:
Cu-Pb-Sn-Cd-Zn-Mn-Fe-Co-Ni-Mg -Mo-Cr-Al-Nb-Ta-Zr-Ti
Ряд зростання ступеня пасивного не буде відповідати ряду підвищення корозійної стійкості металів, так як корозійна стійкість залежить не тільки від пасивного, тобто анодного гальмування, але і від катодного гальмування, термодинамічної стійкості металу в даних умовах. Характеристики досконалості пасивного стану металу, поряд з його термодинамічною стабільністю, є основними чинниками, що визначають корозійну поведінку металу.
Підвищення доступу окислювачів до поверхні заліза веде до полегшення пасивації та підвищення корозійної стійкості. При підвищенні концентрації кисню у воді до 16 см3/л корозія заліза різко зростає, а потім, проходячи через максимум в атмосфері кисню, знижується до дуже малих значень. Збільшення швидкості корозії пояснюється дією кисню як катодного деполяризатора, а зниження - наступаючою пасивацією заліза.
У окисних електролітах, наприклад, в 50%-ій азотній кислоті (рис. 7.1), а також в сірчаній кислоті при зсуві потенціалу в позитивну сторону +0,5 В залізо переходить в пасивний корозійностійкий стан (рис. 7.2).
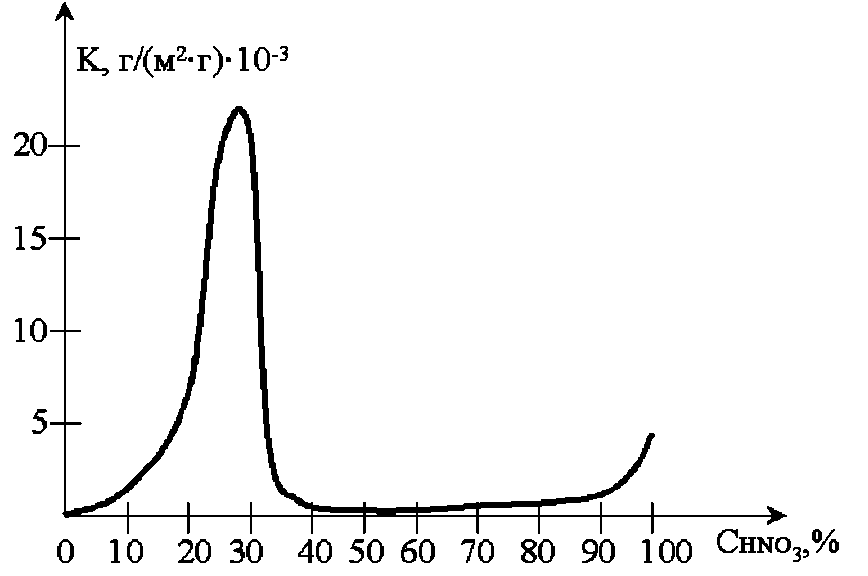
Рис. 7.1. Залежність швидкості корозії низьковуглецевої сталі (0,3% С) від концентрації азотної кислоти при 25 °С.
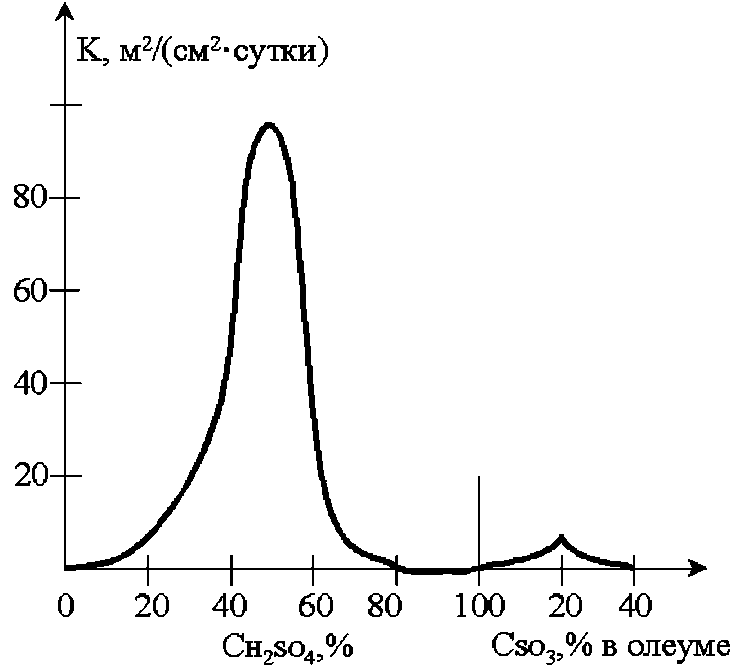
Рис. 7.2. Залежність швидкості корозії заліза від концентрації сірчаної кислоти при 20 °С.
Однак підвищення температури або присутність в розчині Cl‒, Br‒ іонів активує залізо в окисних середовищах. Як видно з рис. 7.1, максимальна швидкість корозії спостерігається у 35%-ій HNO3 (це відповідає максимуму електропровідності HNO3 при даній концентрації). В області концентрацій 50-80% залізо є практично стійким. На ньому встановлюється потенціал, близький до потенціалу платинового електрода. Підвищення швидкості розчинення заліза w зі збільшенням концентрації HNO3 понад 80% пояснюється можливістю утворення більш розчинних оксидів шестивалентного заліза, тобто процесом його перепасиваціі. Максимальна швидкість корозії заліза спостерігається у 50%-ій H2SO4 (рис. 7.2). У більш концентрованих розчинах 70-100% йде зниження швидкості корозії, що пояснюється окислювальною пасивуючою дією H2SO4 (конц). Другий максимум корозії (невеликий) спостерігається в сірчаній кислоті з 20%-ним надлишком SO3, це можна пояснити руйнуванням оксидних пасивних плівок і подальшим виникненням сульфатних або сульфідних захисних плівок. Це дозволяє застосовувати залізні ємності для зберігання і транспортування концентрованої H2SO4 і олеуму.
Швидкість корозії заліза і низьковуглецевих сталей в соляній кислоті зростає в експоненційній залежності від концентрації HCl (рис. 7.3).
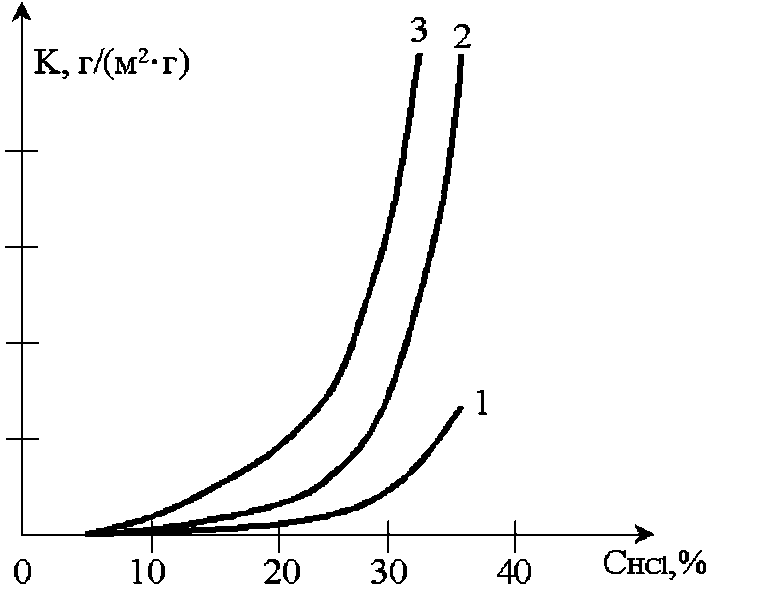
Рис 7.3. Залежність швидкості корозії вуглецевих сталей від концентрації HCl при 25 °С.
1 - армко-залізо (0,01% С), 2 - сталь 10 (0,1% С), 3 - сталь 30 (0,3% С) .
З підвищенням вуглецю в залізі швидкість корозії помітно зростає, що пояснюється підвищенням катодної ефективності через збільшення карбідної складової в сталі. У фтористоводневій кислоті залізо швидко руйнується до концентрації кислоти 50%, але в більш концентрованих розчинах (60-95%) при звичайній температурі залізо є досить стійким. Наприклад, допускається зберігання HF в сталевих балонах, якщо концентрація не нижче 60%.
У органічних кислотах, особливо оцтовій, лимонній, щавлевій, мурашиній залізо кородує, але зі значно меншою швидкістю, ніж у мінеральних кислотах.
Розчинений у воді CO2 збільшує швидкість корозії заліза (котельня корозія). Це пояснюється тим, що іони Ca2+, які знаходяться у воді не виділяються на поверхні заліза у вигляді щільних захисних шарів малорозчинних карбонатів, а залишаються в розчині у вигляді більш розчинних бікарбонатів, які не надають захисної дії.
За нормальних температур залізо і сталь стійкі в розчинах лугів при їх концентрації вище 1 г/л, проте при концентрації більше 30% захисні властивості плівок гідроксиду заліза знижуються, тому що йде їх розчинення з утворенням ферратів. Якщо залізо і низьколеговані сталі в лужних розчинах піддаються впливу розтягуючих напружень, особливо при підвищених температурах, то виникає корозійне розтріскування, що називається «каустичною хрупкістю».
Залізо є стійким в розчинах аміаку, за винятком гарячих концентрованих розчинів, в яких воно помірно кородує. Широке застосування в хімічному машинобудуванні знаходять корозійностійкі сталі, які мають досить високі механічні та технологічні властивості і є поширеними конструкційними матеріалами.
У табл. 7.2 наведені основні корозійностійкі сталі, що застосовуються в хімічній і нафтохімічній промисловості.
Таблиця 7.2
Клас сталі |
Марки сталі |
Області застосування, характерні, властивості |
Хромисті стали |
||
Ферритні |
08Х13 12Х17 15Х28 15Х25Т |
Вода, пара, атмосферні умови. Окислювальні кислоти та луги. Жаростійкі сталі (до 1000 ° С ). |
Мартенситні |
20Х13 |
Слабоагресивні середовища (вода, пар, водні розчини солей органічних кислот ). |
Мартенситно- ферритні
|
0,4С15Cr 12Х13 0,7C28Cr 0,1С29Сr 0,4C28Cr4Ni |
Пар, вода, холодна азотна к-та. Тверді зносостійкі деталі. Відлиття підвищеної корозійної стійкості. Застосовуються для азотної і органічних кислот. Мають високим опором до стирання |
Хромонікелеві стали |
||
Аустенітні |
12Х18Н10Т 12Х18Н9Т
08Х18Н10Т 08Х18Н12Б 03Х18Н11 |
Використання як зварних конструкцій в контакті з HNO3 та ін окисними середовищами, в деяких органічних кислотах середніх концентрацій, органічних розчиніть лях. Жароміцний матеріал, а також використовується в кріогенній техніці. Використання як зварних конструкцій в контакті з HNO3 та ін окисними середовищами, в деяких органічних кислотах середніх концентрацій, органічних розчиніть лях. Жароміцний матеріал, а також використовується в кріогенній техніці. |
Високолеговані сталі |
||
|
08Х17Н13М2Т 10Х17Н13М2Т 10Х17Н13М3Т 08Х17Н15М3Т
0,02С8Cr22Ni6Si
03Х21Н21М4ГБ
06ХН28МДТ
03ХН28МДТ 0,03С18Сr20Ni- 3Si3Mo3CuNb |
Зварні конструкції в контакті з H3PO4, мурашиної, оцтової та ін середовищами підвищеної агресивності. Сталь 08Х17Н15М3Т використовується для виготовлення колон синтезу сечовини. Для обладнання, що працює під впливом конц. HNO3 при високих температурах. Для обладнання виробництва екстракційної фосфорної кислоти і комплексних мінеральних добрив. Для обладнання виробництва сірчаної кислоти (до 80%), складних мінеральних добрив, екстракційної фосфорної кислоти та інших середовищ підвищеної кислотності. У порівнянні зі сталлю 06ХН28МДТ має більш високу стійкість до міжкристалітної корозії. Для апаратури, що працює в розчинах Н2SO4. |
Хромоникельмарганцевые стали |
||
|
10Х14Г14Н4Т
12Х17Г9АН4 |
Для зварний апаратури, що працює в середовищах слабкою агресивності, у кріогенній техніці (до -253 ° С) Для виробів, які тривалий час працюють в атмосферних умовах і при підвищених температурах (до 400 ° С). |
Аустенітно- феритно |
08Х22Н6Т 0,03С23Сr6Ni 08Х21Н6М2Т 0,03С22Сr6Ni2Mo 08Х18Г8Н2Т 0,08С18Cr8Mn3- Ni2MoTi
|
Сталі з підвищеною міцністю. Замінники сталей марки Х18Н10Т і 17Н13М2Т. Застосовуються у виробництві HNO3, капролактаму, сечовини, аміачної селітри і ін. |
Аустенітно- мартенситні |
07Х16Н6 09Х17Н7Ю 08Х17Н5М3
|
Високоміцний корозійно-стійкий матеріал, використовуваний в слабоагресивних середовищах. Коррозионностойкий в середовищах середнього агресивності, жароміцний (до500 ° С ). |
За існуючими стандартами легуючі компоненти сталі позначаються наступним чином: Cr - X, Ni - H, Mo - M, Cu - Д, Si - C, Mn - Г, Al - Ю, V - Ф, Ti - T, Nb - Б, N2 - A. Цифра після позначення легуючого компонента означає його вміст у %, а цифра перед маркою сталі - вміст вуглецю в сотих долях %.
Високолеговані чавуни - це сплави заліза з 14-18% кремнію. Вони володіють високою корозійною стійкістю в багатьох агресивних середовищах. Як видно з рис. 7.4, різке зростання корозійної стійкості чавунів спостерігається в сплавах, що містять не менше 14,5% кремнію. Ця концентрація кремнію відповідає складу сплаву Fe3Si, при якому відбувається впорядкування в системі Fe-Si. При вмісті Si 16% і більше відбувається утворення на поверхні сплаву пасивної плівки SiO2.

Рис. 7.4. Швидкість корозії сплавів Fe-Si в киплячій 35%-ій H2SO4.
Залізо-кременистий сплав має дуже високу корозійну стійкість в розчинах H2SO4 навіть при температурі кипіння. Наприклад, швидкість корозії в 40%-ій H2SO4, де спостерігається максимальне значення корозії, не перевищує 0,5 мм/рік, а в 60-90%-ій становить менше 0,025 мм/рік. У HNO3 сплав відрізняється високою корозійною стійкістю, особливо в концентрованих розчинах при температурах кипіння. У соляній кислоті сплав є менш корозійнстійким, але легування 2-5% молібдену збільшує його стійкість в гарячій HCl.
Залізо-кременисті сплави широко застосовуються при виготовленні відцентрових насосів для перекачування агресивних рідин, вентилів, теплообмінників при переробці високоактивних корозійних середовищ, а також для апаратів по упарювання H2SO4. Поліпшення механічних властивостей (зниження крихкості) досягається в результаті збільшення однорідності структури, для цього використовують лігатуру рідкоземельних металів ітрієвої групи.
7.8.2 Нікель та його сплави
У чистому вигляді нікель в хімічній промисловості не використовується, але служить легуючим компонентом для корозійностійких сталей та інших сплавів. В останні роки, у зв'язку з великою витратою нікелю на виробництво нержавіючих сталей, спостерігається його дефіцит, тому посилюється тенденція заміни сплавів на основі нікелю сплавами на основі титану. Необхідно відзначити стійкість нікелю до лугів різної концентрації і температур.
Найбільше поширення з мідно-нікелевих сплавів знаходить сплав на основі нікелю типу «монель», що містить близько 30% Cu і 3-4% Fe + Mn. Цей сплав має підвищену стійкість в неокислювальних кислотах (H3PO4, H2SO4 і HCl), а також у розчинах солей і багатьох органічних кислот. Легування нікелю молібденом (понад 15%) повідомляє сплаву дуже високу стійкість до неокислювальний кислот. Широке практичне застосування знаходять сплави наступного складу (%):
Ni Mo FeCr C
ХН70 (хастеллой В) 60-85 26-30 4-7 до 0,12
ХН65МВ (хастеллой С) 55-60 16-18 4,5-8 15-17 до 0,16.
Хастеллой В є більш корозійнстійким, ніж хастеллой С в неокислюючих кислотах, але в окислюючих, внаслідок високого вмісту молібдену, є нестійким. Хастеллой С набуває високу стійкість навіть у киплячій HNO3, а також у розчинах, що містять Cl2 і гіпохлорити. Поряд з високою хімічною стійкістю вони володіють великою міцністю і є цінним матеріалом для хімічного машино-і апаратобудування.
Сплави нікелю з хромом (ніхромом) є жаростійким, жароміцним і кислотостойким матеріалом. Найбільше застосування знайшли 2 типи ніхрому: 15Cr60Ni (15-18% Cr, 55-61% Ni, 1% Si, 1,5% Mn, інше - Fe) і 20Cr80Ni (20 Cr, 75-78 Ni, до 1, 5% Mn). Ці сплави широко застосовують для нагрівальних елементів.
7.8.3 Титан і його сплави
Технічне значення титану та сплавів на його основі визначається тим, що вони є високоміцними і корозійностійкими. Корозійна стійкість титану і його сплавів спостерігається в набагато більш широкому наборі агресивних середовищ, ніж для сплавів на основі заліза або алюмінію. Особливо важлива їх підвищена стійкість у середовищах, що містять Cl-іони. Титан стійкий, а нержавіюча сталь 18Cr12Ni2Mo швидко руйнується в таких агресивних середовищах, як царська горілка, гіпохлорит натрію (10-20 г/л Cl2), хлористе залізо (20%), фосфорна кислота (30%), хромова кислота (50%) і ін.
Відзначена підвищена стійкість титану і його сплавів по відношенню до місцевих видів корозії – питінгової, міжкристалітної, щілинної корозії і розтріскування. Титан мало схильний до контактної корозії - це дозволяє поєднувати його з іншими металами без спеціальної ізоляції. Титан схильний до перепасивації, тобто до сильних окислювачів або при анодній поляризації до значних позитивних потенціалів.
Незважаючи на те, що титан добре пасивується, для поліпшення його корозійних властивостей використовують такі метали як тантал, ніобій, молібден, цирконій. Тантал - найбільш стійкий метал у кислотах як окисного, так і відновлювального характеру - утворює з титаном гомогенні тверді розчини, але для одержання сплавів TiTa, стійких до гарячих розчинів HCl і H2SO4, необхідно, щоб вміст танталу в сплаві перевищував 20%. Так, сплав з вмістом 40% Ta по стійкості в киплячих концентрованих кислотах HCl, H2SO4, H3PO4 майже не поступається чистому танталу.
До титану застосують новий метод підвищення пасивності і корозійної стійкості - катодне легування або модифікування. Це пояснюється тим, що встановлення самопасивуємості титану зазвичай досягається при меншому відсотку його легування благородними металами, ніж інших металів. Титан, легований паладієм (сплав TiО2Pd) як конструкційний матеріал, володіє досить рідкісною і цінною властивістю для хімічної промисловості - одночасною корозійною стійкістю і в окислювальних, і в неокислювальний кислих середовищах. Механічні і фізичні властивості цього сплаву відповідають властивостям чистого титану.
Сплави Ti-Ni в 3,5%-ному кислому розчині NaCl при температурі кипіння були значно більш стійкі, ніж чистий титан. Він не схильний до розтріскування і щілинної корозії і в зазорах. Ці сплави можна рекомендувати для теплообмінної апаратури, що працює з морською водою .
7.8.4 Алюміній та його сплави
Алюміній має досить високу стійкість у воді, нейтральних і слабокислих розчинах, а також в атмосфері внаслідок великої схильності до пасивації. Не тільки кисень повітря або кисень, розчинений у воді, але й сама вода є по відношенню до алюмінію пасиватором. Пасивна плівка на алюмінії (на відміну від титану) досить легко руйнується під впливом Cl‒, Br‒, F‒, I‒- іонів, особливо в підкислених розчинах, а окисні іони типу хроматів або бихроматів, а також розчинні солі кремнієвої кислоти і фторосилікати є сильними сповільнювачами корозії алюмінію. В HNO3 з підвищенням її концентрації стійкість алюмінію збільшується. Це дозволяє розглядати алюміній як один з кращих матеріалів для зберігання і транспортування концентрованої HNO3. За стійкістю він навіть перевершує хромоникелеву сталь - це пояснюється несхильністю алюмінію до перепассіваціі.
Алюміній досить стійкий в розведеній H2SO4 і олеумі, але нестійкий в H2SO4 середніх і високих концентрацій.
У порівнянні з чистим алюмінієм, його сплави мають більш високі механічні властивості, але нижчу корозійну стійкість. Це відноситься до сплавів алюмінію з міддю, кремнієм, цинком, магнієм, марганцем. Алюміній і його сплави застосовуються для зберігання, перевезення та переробки крижаної оцтової кислоти, жирних кислот, гліцерину, перекису водню, мінеральних добрив, антибіотиків, бензину та ін Алюміній абсолютно нестійкий в лугах і лужних розчинах.
7.8.5 Мідь і мідні сплави
Мідь, незважаючи на її знижену міцність в порівнянні з її сплавами, застосовують через її специфічну стійкість в ряді хімічних середовищ, а також високої електро-і теплопровідності. Її використовують у хімічній промисловості для теплообмінної апаратури (ректифікаційних апаратів і розгінних колон у виробництві спиртів), для апаратури з обробки багатьох органічних сполук. Мідь корозійностійка в лужних розчинах, а також у розчинах багатьох органічних кислот при малому доступі кисню. У воді і розчинах нейтральних солей мідь досить стійка, проте доступ повітря і окислювачів помітно збільшує її розчинення. Мідь і мідні сплави досить стійкі в розбавлених розчинах і розчинах середніх концентрацій не окислюючих кислот (HCl, H2SO4, оцтова, лимонна), однак наявність окислювачів (HNO3, H2O2) або навіть продування повітря через розчини помітно підвищує швидкість корозії міді та мідних сплавів. Оловяністі бронзи (8-10% олова) мають хорошу корозійну стійкість в неокислюючих кислотах. У деяких випадках, наприклад, в органічних кислотах, розведеній соляній і морській воді хімічна стійкість алюмінієвих бронз вище, ніж оловянистих. Крем'янисті бронзи (3-5% Si, 1% Mn) більш кислотостійкі. Бронзи застосовують для виготовлення насосів та арматури для перекачування розбавлених кислот.
Латуні застосовують як високопластичних, добре деформуюємі конструкційні матеріали для виготовлення труб, конденсаторів, охолоджуваних морською водою.
7.8.6 Свинець та його сплави
Свинець мало схильний до пасивації в окисних кислотах, проте на його поверхні можливе утворення захисних покривних шарів із продуктів корозії, які нерозчинні у певних середовищах, наприклад, у розчинах, які містять сульфат-іони. У азотній і оцтовій кислотах свинець нестійкий, тому що нітрати та ацетати розчиняються. Нестійкий свинець і в лугах, тому що його гідроксиди амфотерні легко розчиняються в надлишку лугу. Свинець стійкий у сірчистій, фосфорній, хромовій і фтористоводневій кислотах, а також у розчинах тих солей, з аніонами яких можливе утворення його нерозчинних сполук.
Свинець широко використовується в хімічній промисловості, особливо в установках, пов'язаних з виробництвом або застосуванням сірчаної кислоти. Для виготовлення труб і кислототривких насосів застосовують сплави свинцю з сурмою (6-13% Sb) - твердий свинець .
7.9. Неметалічні конструкційні матеріали. Процеси старіння
Фенопласти - композиції, що складаються з фенольних смол, наповнювачів і різних добавок (затверджувачів, змащувальних речовин та ін.) У хімічній промисловості застосовуються хімічно стійкі марки фенопластов - фаоліти, які отримують на основі фенолформальдегідних смол і кислотостойкого наповнювача. Вони мають підвищену тепло-стійкістю і хімічну стійкість в органічних розчинниках. Фаоліт випускають трьох марок: А - наповнювач - азбест, В - тальк, Т - графіт.
Вироби з фаоліта можна формувати при звичайних температурах з післідующим затвердінням при температурі 60-130 °С.
Фторопласти - полімери фторпохідних ряду етилену. Вони характеризуються високою термостійкістю, міцністю, діелектричними й антифрикційними властивостями, а також високою хімічною стійкістю при збереженні механічних властивостей.
У табл. 7.3 наведені дані по хімічній стійкості фторопластів, найбільш широко застосовуються в хімічній промисловості при температурі експлуатації від 20 до 150 оС.
Таблиця 7.3
Середовище |
ПТФЭ |
ПТФХЭ |
ПВХ |
ПВДФ |
ТФЭ- ГФП |
ТФЭ- Э |
ТФЭ- ВДФ |
Вода і розчини солей |
В |
В |
В |
В |
В |
В |
В |
Основи |
В |
В |
В-С |
В-С |
В |
В |
В |
Кислоти слабкі |
В |
В |
В |
В-С |
В |
В |
В |
Кислоти сильні |
В |
В |
В |
В-С |
В |
В |
В |
Кислоти конц |
В |
В |
В |
В-С |
В |
В |
В |
Окисники (крім кисл) |
В |
В |
- |
|
В-С |
В |
В |
Бензин, рідке топливо |
В |
С |
В |
В |
В |
- |
В |
Эфіри |
В |
М |
О |
М |
В |
В |
Н |
Спирти |
В |
В |
В |
В |
В |
В |
В |
Умовні позначення: В - цілком стійкі; С - стійкі; О - відносно стійкі; М - малостійкі; Н - нестійкі.
Фторопласти застосовуються для виготовлення футеровки труб, використовуваних для транспортування агресивних середовищ в широкому діапазоні температур, виготовлення деталей протикорозійного призначення (поршневих кілець, підшипників ковзання, фасонних частин до трубопроводів, компенсаторів і ін.)
Вуглеграфітові матеріали - характеризуються низькою щільністю і високою хімічною стійкістю, збереженням міцності до температури 2500 °С. До недоліків відносяться крихкість, низька стійкість в окисних середовищах, пористість. Зниження пористості графітових матеріалів можна домогтися нанесенням захисних покриттів, введенням в сировині кремнію, фосфору, просоченням органічними речовинами з наступною термічною обробкою та інші.
Вуглеграфітові матеріали бувають наступних типів: грубозернисті (ГМЗ, ППГ, ВПП та ін), дрібнозернисті (МР, МР-1, АРВ-2), антифрикційні (АТ-1500, АГ-1500, АФГМ та ін), піролітичним графіти (ПГВ, ПГН, ПГИ), вуглецеві композиційні матеріали (УКМ-1, УУТ-2 тощо) і графітопластини (АТМ, АТМ-1Т).
Найбільш висока хімічна стійкість у графітів, просочених фторопластом. З вуглеграфітів виготовляють ущільнюючі кільця, наполегливі і радіальні підшипники для хімічних апаратів, футеровку хімічної апаратури, стійку в окисних середовищах (з силіцованого графіту), пристрої для перемешіванія розплавів, насадки для розпилення абразивних хімічно активних середовищ (з боросиліцованого графіту) і ін.
Скло володіє високою хімічною стійкістю, дозволяє отримувати продукти високої чистоти. Основна область застосування технічного скла в хімічній промишлнності – виготовлення трубопроводів. Їх використовують для гідро-, пневмо-і вакуум-транспортування агресивних речовин.
Підвищену термо-і хімічну стійкість має кварцове скло, що складається більш ніж на 96% з кремнезему. Воно стійкіше, ніж боросилікатне скло.
Процеси старіння
При дії агресивних середовищ може відбуватися зміна експлуатаційних властивостей полімерних матеріалів через протікання фізичних і хімічних процесів, таких як хімічні реакції агресивного середовища з хімічно нестійкими зв'язками компонентів матеріалу, дифузія агресивного середовища в об'єм матеріалу, адсорбція агресивного середовища на поверхні полімерного матеріалу, зміна фізічної структури. Хімічно активні середовища поділяються на речовини кислотно-основного характеру, солі і речовини, що володіють окисними властивостями. По відношенню до кислот, лугів та солей нестійкі полімери з гетероатомами, а стійкі карбоцепні полімери, що не мають подвійних зв'язків. По відношенню до речовин, які володіють окисними властивостями, нестійкі практично всі полімери. Хімічно активні середовища при контакті з полімерними матеріалами можуть викликати необоротні зміни експлуатаційних властивостей.
Стійкість полімерних матеріалів до дії агресивних середовищ характеризується коефіцієнтом старіння (k), що представляє собою відношення контрольованого показника властивостей полімерного матеріалу після контакту зразків протягом певного часу з середовищем до цього ж показника до занурення зразка в агресивне середовище. У довідниках наведені коефіцієнти старіння за наступними показниками: руйнівна напруга при розтягуванні, розривне подовження при розтягуванні, руйнівне напруження при стиску і вигині і ін.
В даний час використовується кілька способів збільшення хімічної стійкості полімерних матеріалів, заснованих на наступних принципах: введення хімічно стійких наповнювачів, хімічна модифікація макромолекул шляхом введення заміщувачів, введення в матеріал акцепторів агресивного середовища та ін.
10 МЕТАЛЕВІ ЗАХИСНІ ПОКРИТТЯ
Захисними металевими покриттями називають штучно створені на поверхні захищаємого виробу шари металу з метою захисту його від корозії. Якщо поряд із захистом від корозії покриття служить також для декоративних цілей, його називають захисно-декоративним. Роль покриття, як засобу захисту від корозії, зводиться, в основному, до ізоляції металлу від зовнішнього середовища, зметою припинення роботи гальваноелементів на поверхні металу і підвищення термодинамічної стійкості металу.
10.1 Класифікація металевих покриттів
Металеві покриття розрізняються за призначенням, умовами експлуатації, методами нанесення, механізмом захисту. За призначенням металеві покриття поділяються на:
- захисні, застосовувані для захисту основного металу від корозії;
- захисно-декоративні, застосовувані для деталей, що вимагають, поряд із захистом від корозії, також і декоративного оздоблення;
- покриття, що застосовуються для спеціальних цілей, наприклад, для підвищення твердості, зносостійкості, антифрикційних властивостей деталей і ін.
За умовами експлуатації покриття підрозділяються на такі, що експлуатуються в агресивному середовищі, в атмосферних умовах, в умовах високих температур.
За методами нанесення металеві покриття підрозділяються на гальванічні, гарячі, термодифузійні, металізаційні, плакіровочні.
До гальванічних ставляться покриття, які наносяться шляхом осадження шару металу з електроліту, що містить іони цього металу, під дією постійного струму.
Гарячі покриття наносяться при зануренні захищаємого виробу у ванну з розплавленим металом (наприклад покриття листового заліза, дроту, морозильних агрегатів деяких типів холодильників розплавленим цинком, оловом або свинцем).
Термодифузійні покриття утворюються внаслідок насичення поверхневих шарів захищаємого металу атомами захищємого металу при високих температурах.
Металізація - спосіб нанесення металевих захисних покриттів шляхом розпилення розплавленого металу струменем стисненого повітря або інертного газу.
Плакіровочні покриття наносяться шляхом нанесення на обидві сторони захищаємого металу шару корозійно-стійкого металу. Міцне з'єднання виходить в результаті взаємної дифузії на кордоні двох металів у процесі гарячої прокатки.
Незалежно від способу нанесення, всі металеві покриття повинні відповідати таким основним вимогам:
- бути міцно зв’язаними з основою і не відшаровуватися при будь-яких умовах експлуатації;
- бути щільними, дрібнокристалічними, що забезпечує корозійну стійкість виробу;
- мати мінімальну пористість;
- задовольняти спеціальним вимогам до покриття: твердості, зносостійкості, питомого електроопору, оптичним властивостям, антифрикційним властивостями та ін
По механізму захисту металеві покриття поділяються на анодні і катодні. До катодним покриттів відносяться покриття, потенціали яких в даному середовищі мають більш позитивне значення, ніж потенціал основного металу. По відношенню до сталі катодними покриттями є мідні, нікелеві, золоті, срібні, паладієві та ін. Катодні покриття можуть служити надійним захистом від корозії тільки за умови відсутності в них пор, тріщин та інших дефектів, тобто за умови їх суцільності. При пошкодженні покриття або наявності пор виникає корозійний елемент, в якому основний метал служить анодом і розчиняється, а матеріал покриття - катодом, на якому йде процес або відновлення водню, або іонізації кисню (рис. 10.1, а).
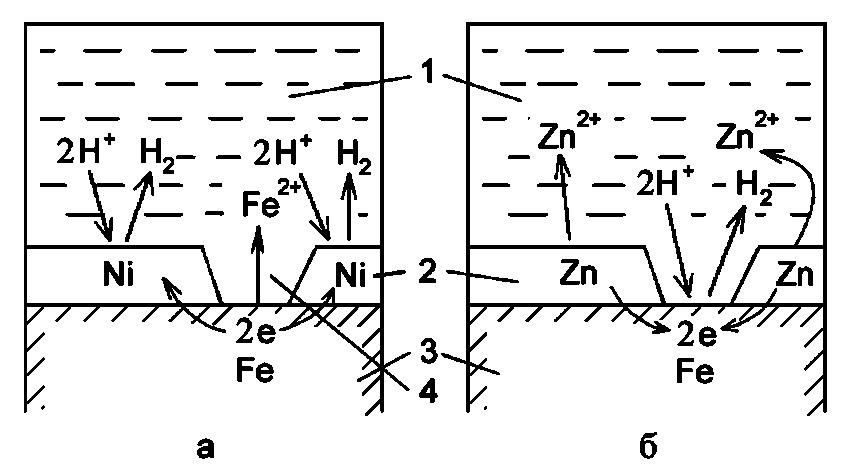
Рис 10.1 Схема корозії металу в кислому розчині при порушенні металевих покриттів:
а - катодного, б - анодного; 1 - розчин, 2 - покриття, 3 - основний метал, 4 - дефект в покритті.
Анодні покриття мають більш негативний потенціал, ніж потенціал основного металу. По відношенню до сталі анодними покриттями є цинкове, кадмієве, марганцеве та ін. У випадках застосування анодних покриттів умова суцільності є необов'язковою. При наявності дефектів в покритті при дії агресивних розчинів виникає корозійний гальванічний елемент, в якому основний метал буде катодом, а метал покриття - анодом, тому захищаємий виріб не буде кородувати (рис. 10.1, б). Захисні властивості і тривалість терміну служби анодних покриттів залежать від їх товщини, а катодних покриттів - не тільки від товщини, але і від їх суцільності. При виборі покриття, поряд з конструктивними міркуваннями, необхідно враховувати умови експлуатації деталі, корозійну стійкість металів, можливість виникнення гальванічних пар, що виникають при з’єднанні деталей у вузли, і характеристику захисних властивостей покриття. Вид покриття вибирається з урахуванням електрохімічних властивостей металів основи і покриття. Величиною, що визначає електрохімічні властивості металу, є електродний потенціал.
При з’єднанні деталей у вузли не допускається утворення гальванічних пар, що викликають корозію металу. У довідниках машинобудівника є спеціальні таблиці, де наведено допустимі і недопустимі гальванічні пари, наприклад, хром, олово, мідь та її сплави, нержавіюча сталь утворюють неприпустимі гальванічні пари з цинком і його сплавами.
10.2 Гальванічні покриття
Гальванічні покриття, як захисні покриття від корозії, знайшли широке застосування в багатьох галузях промисловості завдяки надійному захисту від корозії, високої економічності процесів і легкої керованості.
10.2.1 Основні закономірності електроосадження металів.
Для електроосадження металу використовується установка, що складається з електролізера і джерела постійного струму з регулюванням величини сили струму. Електролізер складається з гальванічної ванни і електродів. У ванну заливають електроліт.
Електроосадження металів проводять в гальванічній ванні під дією постійного струму. Захищаєма деталь вішається на катодну штангу, підключену до негативного полюса джерела струму, і в результаті іонно-електронного переходу на кордоні метал - електроліт, тобто реакції відновлення іонів, відбувається осадження металу на поверхні деталі. До складу електроліту входять прості або комплексні солі металу, які осаджуються на катоді, а також речовини, що підвищують електропровідність і буферні властивості електроліту, поверхнево – активні і вирівнюючі добавки, що сприяють отриманню дрібнокристалічних, рівних, напівблискучих або блискучих покриттів. В електроліті сіль осаджуємого металу піддається дисоціації, і на катоді протікає реакція розряду гідратованого іону металу з подальшим входженням утворених ад-атомів металу до складу кристалічної решітки покриття. Одночасно з розрядом металу на катоді може протікати реакція виділення водню. Катодний процес у загальному вигляді можна записати наступними рівняннями:
[Me(H2O)x]n+ + ne → Me + xH2O;
2H+ + 2e → H2↑.
Для отримання дрібнокристалічних, рівномірних по товщині, напівблискучих і блискучих покриттів осадження в багатьох випадках поводяться з комплексних електролітів, в яких іони металу утворюють комплексні іони. У цьому випадку процес розряду протікає з комплексних іонів, що супроводжується значно більшою поляризацією. Наприклад, електроосадження цинку з амміакатних електролітів протікає за наступною схемою:
[Zn(NH3)4]Cl2 = [Zn(NH3)4]2+ + 2Cl–;
[Zn(NH3)4]2+ + 2е = Zn + 4NH3.
Дрібнозернисту структуру осадів, отриманих з комплексних електролітів, зазвичай пов'язують з величиною катодного поляризації, яка при розряді з комплексних розчинів значно більше, ніж з простих розчинів солей тих же металів. Висока катодна поляризація обумовлена труднощами, які визначаються природою комплексних іонів і механізмом їх розряду, а також характером зміни енергетичного стану поверхні катода під час електролізу. Константи нестійкості більшості комплексних іонів металів значно менше, ніж їх простих солей. Згідно з наведеною вище схемою, при розряді комплексного іона приєднання електрона до центрального іону (цинку) і звільнення ліганда (аміаку) представляють собою одночасно протікаючі процеси. При цьому склад разряжаючихся комплексних іонів може відрізнятися від складу комплексних іонів, що переважають у розчині, і залежить від концентрації ліганда, кислотності розчину, що в кінцевому результаті впливає на структуру і якість покриття.
Для підвищення електропровідності електроліту в розчин додають солі лужних або лужноземельних металів, а в окремих випадках - відповідні кислоти або луги. У водних розчинах завжди присутні іони водню, їх концентрація відіграє велику роль при електроосадженні металів. Вони особливо виділяються при значних електровід'ємних потенціалах (цинк, нікель, кадмій, залізо та ін.). При електролізі водних розчинів простих солей цих металів вже при невеликій концентрації водневих іонів відбувається виділення на катоді водню спільно з металом, внаслідок чого вихід металу по струму знижується. Чим більше кислотність розчину, тим нижче вихід металу по струму. Крім зниження виходу за струмом, виділення водню спільно з металом часто викликає зміну структури та фізико-механічних властивостей осаду. Включаючись в катодний осад, водень підвищує внутрішню напругу, викликає крихкість, розтріскування, пухирчаті здуття, піттінг. Збільшення рН розчину вище певної межі призводить до випадіння в осад гідроксидів металів, які, включаючись в катодне покриття, погіршують його зовнішній вигляд, призводять до підвищення внутрішніх напружень, розтріскування осаду, викликають його крихкість. Щоб уникнути утворення та накопичення гідроксидів у катода кислотність розчинів у процесі електролізу повинна бути постійною, для цього в електроліти додають спеціальні речовини, що дозволяють підтримувати в певному інтервалі рН розчину. Такими речовинами є слабо диссоційовані неорганічні і органічні кислоти (борна, оцтова, амінооцтова і т.д.) та їх солі, слабкі луги та їх солі. При електролізі простих солей електропозитивних металів (мідь, срібло, вісмут, паладій, золото) надлишок іонів водню не впливає на вихід металу по струму, тому що в цих умовах потенціал відновлення водневих іонів не досягається. У цьому випадку підвищення кислотності розчинів необхідно, перш за все, для попередження гідролізу солей і збільшення електропровідності розчинів. В даний час електроосадження більшості металів роблять з розчинів їх комплексних солей. У цих розчинах концентрація водневих іонів впливає як на склад комплексних іонів, так і на їх стійкість, що відбивається на величині катодного поляризації та структури опадів. Підвищення значення рН електроліту, в більшості випадків, сприяє утворенню більш складних за складом і більш міцних комплексних іонів. На структуру і властивості гальванічних покриттів впливають багато факторів. Структура металевих покриттів багато в чому визначає хімічні, фізичні і механічні властивості гальванічних опадів. Згідно сучасним уявленням, електрокристаллізація спочатку відбувається не на всій поверхні електрода, а лише на його активних ділянках.
Інша частина поверхні грані кристала при цьому залишається пасивною. До активних місць відносяться вершини кутів і ребер кристалів, спотворення кристалічної решітки та інші дефекти поверхні катода. На них і виникають перші зародки, які ростуть і утворюють новий шар за рахунок приєднання до межі структурних елементів - ад-атомів. Структура гальванічного осаду визначається співвідношенням швидкостей утворення кристалічних зародків і їх зростання. Чим вище відносна швидкість утворення зародків, тим більше мілкозерниста структура покриття. Утворенняа кристалічних зародків, особливо на чужорідної поверхні катода, пов'язане з більшою витратою енергії в порівнянні з їхнім зростанням. Тому підвищення катодної поляризації сприяє утворенню дрібнозернистих покриттів, які мають кращі захисні властивості. До факторів, що впливають на катодну поляризацію, а отже, і на структуру осаду, відносяться, головним чином, стан поверхні катода, природа і концентрація разряджаючихся іонів, щільність струму, температура, спеціальні добавки до електроліту органічних і неорганічних речовин. Як було показано вище, для електроосадження більшості металів застосовують комплексні електроліти. Застосування комплексних солей замість простих призводить до підвищення поляризації виділення металів і, як наслідок, до отримання дрібнокристалічних напівблискучих і блискучих покриттів. Великий вплив на структуру електролітичних осадів надають поверхнево-активні речовини. У залежності від природи та концентрації цих речовин в електроліті осади на катоді виходять дрібнозернистими, напівблискучими або блискучими. Зміна структури осадів у присутності ПАР відбувається через підвищення катодного поляризації, тобто труднощі процесу електроосадження металу. Дія ПАР пов'язано з адсорбцією їх на межі поділу метал-розчин. Поверхнево-активні речовини повністю або частково закривають поверхню катода, внаслідок чого виділення металу гальмується. При цьому структура та властивості осадів будуть залежати від відносних швидкостей процесів адсорбції ПАР та осадження металу. Якщо швидкість адсорбції ПАР мала в порівнянні зі швидкістю осадження металу і пасивуються лише окремі активні ділянки поверхні катода, то можливо періодичне чергування процесів адсорбції і десорбції пасиватора (ПАР), приводить до загасання зростання одних мікроділянок катода і утворення нових кристалів на інших. Відбувається як би рівномірний перерозподіл струму на поверхні катода. Завдяки цьому структура осаду металу стає більш однорідною, а осад рівномірним і блискучим.
Якщо швидкість адсорбції велика, катод покривається суцільним шаром ПАР. Виділення металу відбувається в результаті розряду іонів, рівномірно проникаючих до поверхні електрода через адсорбційну плівку. Для проникнення іонів через щільний шар адсорбованої речовини необхідна підвищена енергія активації, тому процес осадження металу протікає при значній поляризації катода. При цьому поверхню катода стає енергетично однорідною, і іони металу розряджаються з однаковою швидкістю на всіх ділянках катода, завдяки чому утворюється дрібнозернистий і рівномірний електролітичний осад. Поверхнево активні речовини застосовують також у якості блискоутворюючих і вирівнюючих добавок, які забезпечують отримання блискучих покриттів безпосередньо в процесі електролізу.
Підвищення щільності струму призводить до збільшення поляризації і, отже, збільшення числа одночасно зростаючих активних місць поверхні катода. Це сприяє утворенню на катоді дрібнокристалічного осаду. Однак при дуже високій щільності струму (поблизу граничного струму) утворюються пухкі дендрітообразні осади. Утворення дендритів пояснюється переважним зростанням кристалів на окремих ділянках катода, на яких, внаслідок нерівномірного розподілу струму, встановлюється щільність струму, що перевищує допустиму для даного електроліту. Тому катодна щільність струму повинна вибиратися в залежності від складу електроліту, концентрації солі виділяємого металу, температури і ступеню перемішування розчину. Чим вище концентрація металу, температура електроліту і інтенсивність перемішування, тим більша допустима щільність струму. Підвищення температури електроліту знижує катодну поляризацію, сприяючи утворенню крупнозернистих осадів. При цьому може бути збільшена допустима катодна щільність струму і, отже, швидкість осадження металу. Крім того, при підвищенні температури електроліту зростає вихід по струму, зменшуються внутрішєі напруження і крихкість осадів. Якість і властивості гальванічних покриттів визначаються не тільки їх структурою, а й рівномірністю розподілу металу по товщині на поверхні покриваємих деталей.
При проходженні через електроліт струм розподіляється по поверхні електроду нерівномірно, особливо при покритті деталей складної конфігурації. Внаслідок нерівномірного розподілу струму фактична товщина покриття відрізняється від розрахункової: на одних ділянках поверхні катода вона більше, на інших менше. Це може негативно позначитися на захисні властивості покриттів. Здатність електроліту давати більш рівномірні по товщині покриття на рельєфній поверхні деталі в порівнянні з первинним розподілом струму називають розсіювальною здатністю. Фактори, що впливають на розсіювальну здатність електроліту, поділяються на електрохімічні та геометричні. Електрохімічні фактори - це зміна катодного потенціалу залежно від щільності струму, електропровідність розчину і залежність виходу металу по струму від щільності струму. Геометричні фактори - це розміри і форма електродів, їх розташування відносно один одного. Рівномірність товщини осаджуємого покриття покращується електропровідністю електроліту, зростанням поляризації, щільністю струму, збільшенням відстані між катодом і анодом. Найбільшу розсіювальну здатність мають комплексні електроліти.
10.2.2 Розрахунок і визначення основних параметрів процесу електроосадження металу
До основних технологічних параметрів процесу електроосадження відносяться: швидкість осадження, час електроосадження покриття заданої товщини, вихід металу по струму, розсіююча здатність електроліту і ін
Для розрахунку виходу по струму необхідно знати масу фактично виділеного металу і кількість пропущеного електрики, що визначають за допомогою приладів - кулонометрия. Кулонометрия поділяються на масові, об'ємні та тітраціонний.Особливість кулонометрия полягає в тому, що на катоді протікає тільки одна реакція осадження металу з 100% виходом по струму.У масових кулонометра (мідний, срібний) кількість пропущеного електрики визначається за прирости катода, в об'ємних кулонометра - за кількістю виділеного на електроді газу або ртуті, в тітраціонний - за результатами титрування розчину прікатодном або пріанодного простору.Найбільш широке застосування знайшли мідні кулонометр.
Товщину гальванічного покриття визначають різними методами. Існують неруйнівні і руйнують методи.До неруйнуючим методам контролю за ГОСТ 9-302-79 відносяться: магнітний, електромагнітний, радіаційний та гравіметричний, до руйнуючих - кулонометрический, метод струменя, метод краплі і ін
Магнітний метод заснований на реєстрації зміни магнітного опору покриття залежно від товщини. Метод застосуємо для вимірювання товщини покриттів, отриманих на деталях з феромагнітних матеріалів.Для визначення товщини покриття рекомендуються магнітні товщиноміри типу МТ-10А, МТ-20Н, МТ-30Н, МТ-31Н, МТ-40НЦ.
Електромагнітний (вихрових струмів) метод заснований на реєстрації зміни взаємодії власного магнітного поля котушки з електромагнітним полем, що наводяться цією котушкою в деталі з покриттям.Метод застосуємо для вимірювання товщини електропровідних та неелектропровідних покриттів, отриманих на деталях їх феромагнітних і неферомагнітних металів. Для вимірювання використовуються вихрові струмові товщиноміри типу ВТ-30Н, ВТ-40НЦ.Гравіметричний метод заснований на визначенні маси покриття шляхом зважування деталей на аналітичних вагах до і після осадження. Метод застосуємо для визначення середньої товщини одношарових покриттів.
Кулонометрический метод заснований на анодному розчинення ділянки покриття під дією стабілізованого струму у відповідному електроліті. У момент повного розчинення покриття та появи основного металу спостерігається стрибок потенціалу, що і є ознакою закінчення виміру.
Метод струменя заснований на розчиненні покриття під дією струменя розчину, що випливає з певною швидкістю. У момент повного розчинення покриття відбувається стрибок потенціалу, який фіксується приладом.
Пористість гальванічних покриттів визначають методами занурення, пасти і накладення фільтрувального паперу, які засновані на взаємодії основного металу з реагентом в місцях пір з утворенням забарвлених сполук.Метод занурення заснований на рівномірному змочуванні зразка зануренням його у відповідний розчин. Деталі, змочені розчином, витримують протягом певного часу - 5 хвилин, після чого на контрольованій поверхні підраховують число синіх точок, відповідних числу пір.З отриманого результату розраховують середнє число пор.
Метод пасти заснований на тому, що на поверхню покриття наноситься рівномірний шар пасти. Після витримки пасти протягом певного часу проводять підрахунок пір.
Метод накладення фільтрувального паперу заснований на накладенні фільтрувального паперу, просоченою відповідним розчином, на контрольовану поверхню таким чином, щоб між поверхнею деталі і папером не залишалось бульбашок повітря.Після витримки протягом певного часу папір з відбитками пір у вигляді крапок або плям знімають і просушують на склі. Пористість покриття розраховується за кількістю часу, що припадають на один квадратний сантиметр.
Рівномірність розподілу струму і металу визначається наступними методами:
- Графічним методом визначення щільності струму на різних ділянках катода, заснованим на дослідженні поляризації електродів і вимірюванні питомого опору електроліту;
- Методом побудови ліній електричного поля або еквіпотенціальних ліній за даними вимірювання потенціалів між різними ділянками електроліту;
- Методом безпосереднього вимірювання сили струму, що проходить через окремі секції катода, розташовані на різних відстанях від анода.
Методи вимірювання розподілу струму дають правильне уявлення про рівномірність розподілу металу лише за умови, що вихід металу по струму однаковий на різних ділянках катода, тобто вихід за струмом не залежить від щільності струму.В іншому випадку отримані результати розподілу струму слід коригувати з урахуванням відповідних значень виходів за струмом.
Для визначення розподілу металу за катодного поверхні запропоновані два типи приладів: з плоскими, паралельно розташованими, катодами і анодами;і з катодами рельєфної форми при плоских анодах.
Згідно з методом Херінга і Блюма, у ванночку прямокутної форми завантажують плоский сітчастий анод і дві катодні пластини однакового розміру, розташовані по обидві сторони анода на різній відстані від нього (рис. 10.2).
Рис. 10.2 Прилад для вимірювання розподілу струму і металу по поверхні катода:
1 - анод, 2 - далекий катод, 3 - ближній катод, А1, А2 - міліамперметри, А3 - міліамперметр для вимірювання загальної сили струму.
За приростами ваги обох катодів після електролізу судять про розподіл металу при даному відношенні між відстанями від анода до далекого і ближнього катодів.
У методі, запропонованому Фільда, катоди встановлюються по один бік від анода на різній відстані і відокремлюються одне від одного струмонепровідних перегородкою.
Найбільш точним методом визначення розсіює здатності є метод Молер за допомогою щілинної осередки.У ванні прямокутної форми катодне простір відокремлений від анодного струмонепровідних перегородкою, причому між нею і однією з бічних стінок ванни утворюється щілину шириною 1-2 мм.У даному випадку щілину грає роль неполярізующегося анода, а анодний метал, що знаходиться в анодній просторі, забезпечує підведення струму. Катод може бути виконаний у вигляді суцільної пластинки або окремих вузьких однакового розміру смуг
(Рис. 10.3).
Рис. 10.3 Схема щілинної осередку Молер: 1 - ванна, 2 - катодне простір; 3 - анодна простір; 4 - анод, 5 - катоди; 6 - резистори; 7 - перегородка.
Підготовка поверхні металу перед нанесенням покриття Одним з основних умов одержання прочносцепленной з основою металевого покриття є ретельне очищення поверхні виробу, що покривається від жирових, окисних і інших забруднень.Міжатомні сили, які зумовлюють зчеплення між основою і гальванічним покриттям, помітно проявляються при відстані між атомами порядку 10-3 мкм. При збільшенні цієї відстані міцність зчеплення зменшується приблизно в геометричній прогресії.
Для підготовки поверхні виробів перед нанесенням покриття застосовуються механічні, хімічні і електрохімічні способи. Механічна підготовка поверхні може складатися з шліфування, полірування, крацевания і піскоструминної обробки.
Шліфування - процес видалення з поверхні металу грубих нерівностей шляхом зняття тонкого шару металу гострими гранями дрібних зерен абразивних матеріалів з метою отримання рівної і порівняно гладкої поверхні.Шліфування здійснюють на спеціальних шліфувально - полірувальних верстатах з допомогою абразивних кіл.Застосовуються кола двох типів: тверді, що складаються із зерен абразивного матеріалу на цементи-ючий зв'язці, і еластичні, що складаються з еластичного матеріалу (войлоч-ні, бязеві, фетрові, шкіряні, брезентові та ін), На периферійну поверхня яких наклеюються абразивні зерна клеєм або рідким склом. Абразивним матеріалом є дрібні зерна (200-75 мкм і менше) корунду, наждаку, кварцу та ін
Шліфування в барабанах, а також вібраційна обробка виробляються із застосуванням зазначених вище абразивів або обкатаного бою абразивних кіл.
Полірування - процес видалення з поверхні виробів найменших нерівностей і повідомлення їй блискучого, дзеркального виду.Полірування здійснюють за допомогою еластичних кіл, на робочу поверхню яких наноситься шар полировальной пасти. Для полірування колами застосовують абразивні матеріали з більш дрібними (50-5 мкм) зернами, ніж при шліфуванні (віденська вапно, оксид хрому, оксид алюмінію, оксид заліза та ін.)Зерна цих абразивів зв'язуються напівтвердими жирами (стеарин, віск, парафін та ін), утворюючи полірувальні пасти, які наносять на периферію кола під час його обертання. Лінійна швидкість обертання круга - від 20 до 35 м / с залежно від оброблюваного матеріалу.Для полірування вуглецевих і нержавіючих сталей застосовують хромову пасту наступного складу (%): оксид хрому-80, стеарин-15, олеїнова кислота-5. Для полірування нікелю, міді і її сплавів використовують пасту складу (%): оксид алюмінію-65, технічне сало-8, стеарин-10, церезин-14, скипидар-3.Шліфування та полірування дрібних деталей може здійснюватися в обертових барабанах. Така обробка називається галтовку. Для полірування дрібних деталей в обертових барабанах застосовують сталеві кульки діаметром 1-8 мм, обрізки шкіри, фетру, повсті, деревна тирса і ін
Крацеванієм - обробка поверхні виробів металевими дисковими щітками на верстатах з метою матування, очищення від задирок, окислів травильного шламу, а також для ущільнення деяких гальванічних покриттів (олов'яного, срібного).Така обробка проводиться сталевими або латунними щітками із застосуванням рідини (води, розчину мила, поташу та ін) або без неї.
Піскоструминна обробка полягає в тому, що поверхня виробів піддається дії сильного струменя сухого піску під тиском стисненого повітря.Останнім часом застосовують так звану гідроабразивну чистку: поверхню виробу обробляють струменем води, що містить у зваженому стані зерна абразивного матеріалу. Поверхня металу, як правило, покрита жировими забруднень і оксидною плівкою.Така поверхня не змочується електролітом і перешкоджає осадженню металу. Тому всі вироби перед нанесенням гальванічного покриття піддаються знежирення і травленню з метою видалення з поверхні жирових забруднень і оксидних плівок.
Знежирення проводять в лужних розчинах або органічних розчинниках з метою видалення жирів тваринного і рослинного походження (омилюваного жирів), а також мінеральних масел. Під дією лугу омилюваного жири розкладаються, утворюючи розчинні у воді солі жирних кислот і гліцерин.
Мінеральні масла хімічно не розкладаються лугами, але під дією сил поверхневого натягу плівка масла руйнується і збирається в крапельки.Для повного звільнення поверхні металу від масла необхідно присутність в розчині поверхнево-активних речовин, що володіють миючими та емульгуючими властивостями, а також рух рідини за рахунок нагрівання або перемішування розчину.
Для знежирення деталей зі сталі, міді і її сплавів застосовують розчини наступних складів (г / л):
- Натрій їдкий - 30-50, натрій вуглекислий - 20-30, тринатрійфосфат - 50-70, рідке скло - 10-15; температура - 60-80 ° С.
- Тринатрійфосфат - 25 - 35, натрій вуглекислий - 25-35, поліетіленгліколевий ефір - 20 - 30; температура розчину - 70-90 ° С.
Знежирення в органічних розчинниках зводиться до звичайного процесу розчинення жирів.Для цієї мети застосовують гас, бензин, хлоровані вуглеводні (трихлоретилен, діхлоретілен, дихлоретан та ін.) До недоліків органічних розчинників слід віднести те, що бензин і гас легко займаються, а хлоровані вуглеводні токсичні.
Електрохімічне знежирення проводиться на катоді або аноді в лужних розчинах приблизно того ж складу, що і при хімічному знежирюванні. Ефективність електрохімічного знежирення вище хімічного.Механізм процесу електрохімічного знежирення зводиться до зменшення змочуваності маслом поляризованої поверхні. Крім того, емульгування масел і жирів полегшується виділяються бульбашками газів водню або кисню.Знежирення проводять при температурі розчину 60 - 80 ° С і щільності струму 300-1000 А/м2.
Недоліком катодного знежирення, особливо при обробці виробів з високовуглецевої сталі, є зниження механічної міцності металу, поява крихкості за рахунок наводороживания.У таких випадках застосовують комбіновану обробку (спочатку на катоді, а потім на аноді) або анодний обробку.
Травлення виробляють з метою видалення окалини і товстих оксидних плівок.
При хімічному травленні чорних металів застосовують, головним чином, сірчану і соляну кислоти.Травлення сталевих виробів в сірчаної кислоти протікає за такими рівняннями:
FeO + H2SO4 = FeSO4 + H2O;
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O;
Fe + H2SO4 = FeSO4 + H2.
Швидкість розчинення оксидів залежить від концентрації і температури кислоти. Травлення проводять в розчинах, що містять 5-10% сірчаної кислоти або 10-15% соляної при температурі 40-60 ° С в першому розчині і 20 - 40 ° С - у другому.Для травлення спеціальних сортів сталей, наприклад нержавіючої, застосовують розчини, що містять сірчану, соляну і азотну кислоти. При травленні сталевих виробів часто відбувається перетравліваніе і наводороживания поверхні.Для запобігання цих явищ в розчини додають інгібітори травлення, які, практично не впливаючи на швидкість розчинення оксидів заліза, уповільнюють або припиняють розчинення металевого заліза.
Як інгібіторів застосовують органічні речовини: смоли, аліфатичні аміни, білкові речовини, спирти та їх похідні і ін Найбільшого поширення набули інгібітори ЧС - хінолінові підстави, ПБ-5 - продукт конденсації аніліну з уротропіном катапін, КПІ-1 та інЗміст інгібіторів у травильному розчині становить 0,1-2,0%. Травлення міді та її сплавів проводять звичайно в концентрованих розчинах суміші азотної, сірчаної та соляної кислот.Зокрема, глянсове травлення міді і її сплавів проводять у розчині, що містить 1 л азотної кислоти (щільність 1,38 г/см3), 1 л сірчаної кислоти (щільність 1,84 г/см3) і 5-10 г кухонної солі при кімнатній температурі протягом 5-10 с. Електролітичні покриття металами
Для захисту від корозії і в захисно-декоративних цілях широко використовуються цинкове, нікелеве, хромове та інші гальванічні покриття.
Електролітичне цинкування
Цинк - сріблясто-білий метал, на повітрі тьмяніє, покриваючись плівкою оксиду цинку або його вуглекислої сіллю. Електролітичне покриття цинком застосовують для захисту сталі і чавуну від корозії.Цинк має більш негативним потенціалом, ніж залізо, тому в гальванічской парі з залізом він є анодом. Цинкове покриття, руйнуючись у процесі експлуатації, оберігає від корозії основний метал, і чим більшу товщину має цинкове покриття, тим довше воно захищає.Цинкові покриття широко застосовуються для покриття деталей приладів, виробів, кріпильних деталей, труб, резервуарів.
Для цинкування використовують електроліти двох видів: прості кислі (сірчанокислі, хлористі, борфтористоводородной та ін), в яких цинк знаходиться у вигляді гідратованих іонів;і комплексні, в яких цинк присутній у вигляді комплексних іонів. До комплексних електролітів належать: ціанідні, пірофосфатная, амміакатние, цінкатние та інКислі електроліти мають низьку розсіює здатністю, тому вони, в основному, застосовуються для покриття деталей простої конфігурації.У присутності деяких органічних добавок, що підвищують катодну поляризацію,з кислих електролітів можна отримати відносно рівномірні по товщині світлі опади і на рельєфних деталях. Як приклад можна привести склад сірчанокислого електроліту цинкування (моль / л):
сульфат цинку - 3,;сульфат алюмінію - 1,8; сульфат натрію - 0,6; декстрин - 10 г / л.
Електроосадження ведуть при рН 4,5, кімнатній температурі і щільності струму 100-200 А/м2.
Для покриття деталей складної конфігурації рекомендують амміакатний електроліт цинкування.У ньому цинк присутній у вигляді аміачного комплексу [Zn (NH3) 4] 2 + з константою нестійкості КН = 10-10. Амміакатние електроліти отримують розчиненням оксиду або гідроксиду цинку в надлишку хлориду амонію:
ZnO + 4NH4Cl + 2NaOH = [Zn(NH3)4]Cl2 + 3H2O + 2NaCl.
Амміакатние електроліти мають високі буферними властивостями і при наявності органічних речовин (уротропін, желатин, клей, декстрин) з них осідають світлі, мелкокристаллические опади. Для покриття деталей складної конфігурації рекомендують наступний амміакатний електроліт (моль / л):
оксид цинку - 0,75;
хлорид цинку - 0,6;
хлорид амонію - 4,6;
борна кислота - 0,3;
клей столярний - 1г / л.
Електроосадження ведуть при рН 6-8, температурі електроліту 20-40 ° С і щільності струму 100-300 А/м2.
Для підвищення корозійної стійкості цинкових покриттів застосовують їх Пасивування.Безпосередньо після електролітичного на-несення і промивки цинкове покриття піддають хімічній обробці протягом 5-10 в пасивуючим розчині при кімнатній температурі, який представляє собою розчин біхромату натрію 200 г / л і сірчаної кислоти 7-10 мл / л.Цинкове покриття при цьому має зеленувато-жовте забарвлення з райдужними відтінками. Для покриттів, осаджених з кислих електролітів з метою отримання блискучих покриттів, застосовують пасивуючий розчин, що містить 150 г / л хромового ангідриду, 20 мл / л сірчаної кислоти і 20 мл / л азотної кислоти.Введення азотної кислоти в розчин дозволяє поєднати в одній операції Пасивування і освітлення цинкових покриттів.
Електролітичне кадміювання
Кадмій - сріблясто-білого кольору, м'яка, пластичний, ковкий,легко полірується. Електрохімічний потенціал кадмію близький до потенціалу заліза.У розчинах, що містять хлориди, потенціал кадмію більш електроотріцателен, ніж потенціал заліза, тому кадмієві покриття рекомендують для виробів, що піддаються дії атмосфери або вологого середовища, містить хлориди (морська, тропічна атмосфера).
Оскільки кадмій значно пластічнєє цинку, різьбові і інші скручувані деталі воліють кадміровать. Для кадміювання застосовують кислі, ціанисті, амміакатние та інші електроліти.
Кислі електроліти мають низьку розсіює здатністю і мають тенденцію утворювати грубозернисті опади. З метою поліпшення якості покриттів в електроліт вводять поверхнево-активні речовини.Для підтримки кислотності на певному рівні в електроліт додають сульфати алюмінію або амонію, борну кислоту і т.д. Ці речовини підтримують кислотність електроліту в заданих межах.
З кислих електролітів, що володіють найбільшою розсіює здатністю, рекомендується наступний склад:
сульфат кадмію - 0,8 моль / л;
сульфат амонію - 8,0 моль / л;
диспергатор НБФ - 80 мл / л;
уротропін - 20 г / л;
ВП-10 - 1 г / л.
Електроосадження ведуть при рН 5-6, температурі електроліту 20-30 ° С і щільності струму 100-150 А/м2.
Амміакатний електроліт кадміювання отримують при взаємодії оксиду або гідроксиду кадмію з концентрованим розчином сульфату амонію.До амміакатному електроліту кадміювання додають органічні поверхнево-активні речовини: желатин, клей, тіосечовина, декстрин, уротропін, глікокол та ін
Трілонатний електроліт має високу розсіює здатністю, тому він рекомендується для покриття полублестящім кадмієм деталей складної конфігурації. Для електроосадження кадмію можна рекомендувати наступний електроліт (г / л):
сульфат кадмію - 75-80;
трилон Б - 120-130;
гідроксид калію - 35 - 40.
Електроосадження ведуть при рН 6,5-7,5, температурі 20-45 ° С і щільності струму 100-200 А/м2. Вихід за струмом становить 65-70%. За розсіює здібності трілонатний електроліт не поступається ціаністого, однак має дещо меншу криючу здатність.
Електролітичне нікелювання
Нікель - твердий і ковкий метал, відрізняється високою стійкістю проти атмосферних впливів. На повітрі нікель покривається прозорою пасивної плівкою, внаслідок чого довго зберігає блиск. Нікелеві покриття широко застосовуються для захисно-декоративних цілей.Широкому поширенню нікелевого покриття сприяла його висока антикорозійна стійкість в атмосфері, в розчинах лугів та деяких органічних кислотах, що в значній мірі обумовлено сильно вираженою здатністю нікелю до пасивування в цих середовищах.Так як нікель є більш благородним металом, ніж залізо, то захист від корозії нікелевим покриттям можлива тільки за відсутності в ньому пір.
Для підвищення корозійної стійкості сталеві деталі звичайно покривають спочатку щодо товстим (25-35 мкм) шаром міді, а потім шаром нікелю товщиною 10-15 мкм.
Для нікелювання застосовують сірчанокислі, борфтористоводородной, сульфамінової, хлористі і інші електроліти.У практиці найбільшого поширення набули сірчанокислі електроліти. У таблиці наведено приблизні склади електролітів для отримання полублестящіх і блискучих покриттів нікелем.
Таблиця
Найменування компо- нентів і режим електро- лізу |
Концентрація, г/л |
|
I |
II |
|
Сульфат нікелю |
200 - 400 |
260 - 300 |
Хлорид нікелю |
30 - 60 |
40 - 60 |
Борна кислота |
30 |
30 - 35 |
Сахарин |
- |
0,7 - 1,2 |
Фталимід |
- |
0,08 - 0,1 |
1,4 бутиндіол |
- |
0,2 - 0,5 |
РН |
4,5 - 5,5 |
3,5 - 5,0 |
Температура, °С |
20 - 50 |
50 - 60 |
Для отримання блискучих опадів нікелю запропоновано велику кількість добавок до сірчанокислому електроліту, що відносяться до різних класів органічних сполук: сульфосполук ароматичного ряду, ненасичені спирти і гліколі, кумарин і його похідні, азотовмісні сполуки (хінолін,піридин) і т.д. Багато хто з речовин надають компенсаційна дію, згладжують мікропрофіль поверхні, зменшують пористість осаду.
Крім блискоутворюючими і вирівнюючих компонентів, до нікелевому електроліту іноді додають поверхнево-активні речовини типу змочувачів, наприклад миючий засіб "Прогрес".Ці добавки зменшують поверхневий натяг розчину і полегшують відрив бульбашок водню, знижуючи тим самим утворення точкової виразкової в осаді (питтинга).
Електролітичне хромування
Хром - метал сріблясто-сталевого кольору, твердий, крихкий, має більш негативний потенціал, ніж залізо, але не захищає його електрохімічно на повітрі і в окислювальному середовищі, тому що внаслідок сильно вираженої здатності до пасивування він набуває властивості благородних металів.Тому електролітичні опади хрому довго зберігають на повітрі блиск. Крім того, хром стояків у азотної кислоти, а органічні кислоти і сірководень на нього взагалі не діють, розчиняється в соляній та гарячої сірчаної кислотах.
Хромові покриття жаростійкі і володіють великою твердістю і зносостійкістю. По твердості вони перевершують високовуглецеву і загартовану сталі.Хромування отримало широке застосування в промисло вості при виготовленні ріжучих інструментів, осей, циліндрів двигунів, лопатей водяних і парових турбін, прес-форм, штампів. Хромування широко застосовується і як захисно-декоративне покриття.Електролітичні опади хрому, особливо блискучі, відрізняються великою пористістю, схильністю до розтріскування. У зв'язку з цим хромове покриття, нанесене безпосередньо на поверхню сталі, не забезпечує надійного захисту її від корозії.Для підвищення корозійної стійкості виріб спочатку покривають шаром міді (15-20 мкм), потім шаром нікелю (10-15 мкм) і тонким шаром хрому. Пористість хромових покриттів в деяких випадках використовують для збільшення терміну служби деталей, що труться, що вимагають постійного мастила поверхні.Хромове покриття, пронизане мікротріщинами, вбирає мастило, забезпечуючи тим самим мастило без безперервної подачі її ззовні. Електролітичні опади хрому можна отримувати з розчинів як три-, так і шестивалентного сполук хрому.У промисловості застосовують поки тільки шестивалентний сполуки хрому - розчин хромових кислот.
Процес хромування має ряд відмінних особливостей у порівнянні з виділенням багатьох інших металів: високий негативний потенціал відновлення хромат-іонів, низький вихід металу по струму, високі щільності струму, невелику розсіювальну здатність електроліту.У практиці для захисно-декоративних цілей вироби хромуються в розчині наступного складу (г / л):
триоксид хрому - 200-250;
сірчана кислота - 2-2,5.
Процес ведуть при температурі 45-550С і щільності струму 2000-6000 А/м2. Вихід хрому по струму 12-16%. Блискучі, тверді опади хрому, отримані в цих умовах, дуже пористі і мають сітку мікротріщин.Розтріскування осаду відбувається за рахунок великих внутрішніх напружень.На противагу блискучим опадам "молочні" опади хрому, одержувані, головним чином, при високій температурі електроліту (60-70 ° С) і порівняно невеликих густинах струму (2000-3000 А/м2), не мають мікротріщин і менш пористі.Такі опади, товщиною до 20 мкм можуть бути використані для захисту сталевих виробів від корозійного руйнування в атмосферних умовах при підвищених значеннях вологості і температури.Для забезпечення більшої стійкості хромового електроліту у ванну вводять сульфат стронцію і кремнійфторід калію в кількостях, що перевищують їх розчинність. Ці солі, переходячи в розчин, поповнюють його потрібними аніонами і підтримують сталість їх концентрацій.Такий електроліт називається саморегульованим. Застосовують електроліт наступного складу (г / л):
триоксид хрому - 200-300;
сульфат стронцію - 5,5-6,3;
кремнійфторід калію - 18-20.
Процес ведуть при температурі електроліту 50-70 ° С і щільності струму 4000-7000 А/м2.
10.2.3 Багатошарові гальванічні покриття
Одношарові гальванічні покриття, незважаючи на широке застосування в промисловості, не можуть задовольнити всіх вимог, що пред’являються до виробів з корозійної стійкості, декоративності, зносостійкості і ін. В даний час широко застосовують багатошарові гальванічні покриття.
Це дозволяє підбирати покриття залежно від умов експлуатації виробів. В якості захисно-декоративних покриттів для сталі застосовують багатошарові покриття: мідь-нікель, мідь-нікель-хром та ін (рис. 10.4).
РОЗЧИН |
ПОРИ |
|
Рис. 10.4 Багатошарове гальванічне покриття
Сталь спочатку покривають товстим шаром міді (приблизно 30 мкм), потім шаром нікелю товщиною порядку 18 мкм і хромом товщиною 1 мкм. Товщини шарів встановлюють залежно від умов експлуатації виробів. При такому поєднанні мідне покриття є катодним по відношенню до заліза, нікелеве покриття є анодним стосовно мідному і хромовому покриттям. У агресивному середовищі при наявності пор в покриттях корозійний процес починає протікати в результаті роботи локального корозійного елемента хром-нікель. У даному гальванічному елементі хром, внаслідок перетворення (пасивації), набуває більш позитивний електродний потенціал у порівнянні з нікелем і є катодом, а нікелеве покриття - анодом. У результаті роботи локального елемента нікелеве покриття руйнується, а на хромовому покритті йде процес іонізації кисню:
(−) Ni − 2e = Ni2+;
(+) 1/2O2 + H2O + 2e = 2OH−.
Після місцевого руйнування нікелевого підшару корозія досягає мідного покриття, виникає трьохелектродний корозійний елемент хромнікель-мідь. У трьохелектродному елементі хром є катодом, а мідь - анодом. Нікелеве покриття грає роль проміжного електрода: або "слабкого аноду", або "слабкого катоду" залежно від умов. Після руйнування мідного підшару корозія проникає до основного металу, виникає чотириелектродний корозійний елемент. У цьому випадку анодом є сталь, а катодом - всі інші метали. Таким чином, захисні властивості багатошарового покриття визначаються товщиною кожного металевого шару. Такий механізм корозійного руйнування багатошарових гальванічних покриттів передбачає відсутність наскрізних пор до сталі. При наявності наскрізних пор механізм корозійного руйнування змінюється. У процесі експлуатації в агресивному середовищі в багатошарових покриттях з'являються здуття, останні виникають за рахунок пластичної деформації багатошарових покриттів, в яких потім відбувається розрив покриття (ріс.10.5).
Рис. 10.5 Схема корозійного руйнування основного металу в місці здуття покриття
Через утворений розрив в об’єм здуття з атмосфери проникають волога і кисень, що призводить до утворення корозійного гальванічного елемента, в результаті роботи якого сталь руйнується, заповнюючи об’єм здуття продуктами корозії - іржею.
Для зменшення величини здуття на поверхні багатошарових покриттів застосовують різні види покриттів. Так, покриття нікель-мідьнікель-хром довше протистоїть утворенню здуття, ніж покриття мідь-нікель-хром, у зв'язку з тим, що кисень всередину корозійного руйнування проникає повільніше. Застосування двошарового нікелювання з використанням різних за складом електролітів дозволяє значно підвищити корозійну стійкість багатошарових гальванічних покриттів.
10.2.4 Електролітичне покриття сплавами
Електроосадження сплавів замість чистих металів дозволяє значно поліпшити фізико-механічні та хімічні властивості покриттів. Електролітичні сплави мають більш високу корозійну стійкість, жаростійкість, зносостійкість, твердість, декоративні властивості і т.д. В даний час електролітичні сплави широко застосовують у ряді галузей промисловості.
Склад, структура та фізико-механічні властивості сплавів визначаються станом іонів у розчині, умовами співосадження металів і характером кристалізації сплавів. Закономірності електроосадження сплавів і формування їх структури залежать від термодинамічних і кінетичних параметрів.
Електроосадження сплавів на катоді можливо при рівності потенціалів виділення металів.
Зближення потенціалів виділення двох металів можна здійснити за допомогою зміни концентрацій відповідних солей в розчині. Однак підвищення концентрації для більш негативного металу обмежується межею розчинності його солі. Зменшення концентрації солі більш позитивного металу призводить до зниження робочої густини струму. Так, зміна концентрації солі металу в 10 разів, відповідно до рівняння Нернста, зрушує рівноважний потенціал для одновалентних іонів металу на 0,058 В, для двовалентних іонів металу - на 0,029 В.
Найбільш ефективним способом зближення потенціалів виділення металів з метою отримання сплаву хорошої якості є електроосадження сплавів з комплексних електролітів. Застосування комплексних електролітів дозволяє в значній мірі зміщувати потенціали в бік негативних значень. Величина зсуву рівноважного потенціалу залежить від міцності комплексного іона: чим менше константа нестійкості комплексного іона, тим менше в розчині вільних іонів металу і тим більше зміщується потенціал в негативну сторону.
На кінетику електроосадження сплаву має істотний вплив стан іонів у розчині, будова подвійного електричного шару на межі електрод-електроліт, взаємодія металів при утворенні сплаву. Застосування комплексних сполук не тільки зрушує потенціал осадження, але і змінює характер поляризації, що призводить до отримання дрібнокристалічних опадів. Змінюючи концентрацію ліганда, можна змінити швидкість розряду іонів одного металу, не змінюючи її в іншого, тим самим можна регулювати склад сплаву.
Електролітичні сплави можуть утворювати тверді розчини, хімічні сполуки та механічні суміші. При електроосадженні деякі сплави по своїй структурі можуть збігатися зі структурою сплавів, отриманих металургійним шляхом. Таке явище обумовлено природою взаємно осаджуваних металів і режимом осадження. В даний час розроблено більше 200 подвійних і потрійних сплавів, однак у промисловості знайшла застосування незначна кількість сплавів. Однією з причин обмеженого використання електролітичного способу нанесення покриттів сплавами є труднощі контролю складу електроліту і сплаву. У промисловості застосовуються електролітичні сплави: мідь-олово, свинець-олово, мідь-цинк, олово-вісмут, з благородних металів: срібло-сурма, золото-нікель, паладій-нікель і ін.
Сплав мідь-цинк, або латунь, містить від 10 до 90% міді. Покриття сплавом, що містить 60-65% міді (жовта латунь), застосовується для захисту поверхні від корозії й для декоративного оздоблення різних деталей, а також в якості підшару перед електролітичним нікелюванням або хромуванням. Сплав з вмістом близько 70% міді застосовується для збільшення міцності зчеплення між сталлю і гумою при гарячому пресуванні їх з наступною вулканізацією.
Для електроосадження сплаву мідь-цинк застосовують комплексні електроліти, так як з кислих розчинів простих солей практично неможливо осадити даний сплав через велику різницю їх потенціалів осадження. Найбільше застосування знайшов пірофосфатний електроліт, який має наступний склад (г / л):
сульфат міді - 4,8-6,2;
сульфат цинку - 4,4-6,0;
пірофосфат натрію - 50-60;
щавлева кислота - 10-15;
борна кислота - 4-5;
рН - 8-9.
Електроосадження ведуть при температурі 15-30 °С, катодної щільності струму 80-120 А/м2. При цьому осідає сплав з вмістом міді 65-70%.
Покриття сплавом мідь-олово, або бронзування, застосовуються як для захисту від корозії, так і для декоративної обробки поверхні виробів. У промисловості застосовують малооловянисті бронзи (10-20% олова) - жовта бронза і високооловянисті бронзи (40-45% олова) - біла бронза.
Для електроосадження сплаву використовують цианисті, пірофосфатнофторидні і борфтористоводневі електроліти. Для осадження білої бронзи застосовують пірофосфатно-фторидні електроліти наступного складу (г / л):
олова хлорид - 20-25;
міді фторид - 9-10;
калію пірофосфат - 350;
желатин - 0,2-0,4.
Електроосадження ведуть при температурі 18-25 ° С і щільності струму 100-200 А/м2.
Покриття сплавом свинець-олово з вмістом олова від 10 до 60% застосовуються в промисловості для захисту від корозії, як антифрикційні покриття, а також під пайку.
У промисловості застосовують борфтористоводневий електроліт складу (г / л):
сіль свинцю (у перерахунку на метал) - 55 ... -60;
сіль олова (у перерахунку на метал) - 30 ... -35;
борфтористоводородной кислота - 40 ... -42;
борна кислота (вільна) - 25 ... -28;
клей столярний - 2 ... -3.
Електроосадження ведуть при кімнатній температурі і щільності струму 100 ... -120 А/м2.
10.3 Дифузійні, гарячі, металлізаційні і плаковані покриття
Нанесення покриття методом занурення в розплавлений метал. Спосіб гарячого нанесення металевих покриттів полягає в зануренні деталі (після знежирення і травлення) в розплавлений метал. Для отримання покриттів гарячим способом необхідні наступні умови:
- металеве покриття повинно утворювати хімічну сполуку чи твердий розчин з основним металом, у противному випадку розплавлений метал не змочує поверхню металу та утворення покриття є неможливим;
- металеве покриття повинно мати більш низьку температуру плавлення, ніж температура плавлення основного металу.
Цей метод використовують для покриття сталевих виробів цинком, оловом, сплавами свинцю та алюмінію. Гаряче лудіння застосовується в основному для захисту від корозії апаратів і виробів харчової та медичної промисловості. Гаряче цинкування використовують для захисту листів покрівельного заліза, дроту, стрічки і готових виробів від корозії в атмосфері, воді та ряді нейтральних розчинів. У хімічному машинобудуванні великого поширення набуло покриття сплавами свинцю. Розплавлений свинець не змочує залізо, тому в нього додають олово або сурму, які розчиняються і у свинці, і в сталі.
Метод занурення в розплавлений метал має ряд недоліків:
- трудність регулювання товщини покриття;
- нерівномірність товщини покриття;
- велика витрата металу.
Лудіння здійснюють зануренням виробу у розплавлений метал або натиранням. Якість гарячого покриття багато в чому залежить від попередньої обробки виробу: знежирення, травлення, обробки поверхні флюсом. Обробка флюсом видаляє що залишилися на поверхні виробу після травлення солі, оксиди, шлакові включення. При цьому видаляється волога, яка при подальшому зануренні виробу може викликати розбризкування розплавленого олова, а також поверхня охороняється від окислення в момент занурення вироби в розплавлений метал, що сприяє кращому змочування поверхні в розплаві. У якості флюсу використовують концентрований розчин хлориду цинку. Пройшовши через шар флюсу, виріб нагрівається, волога з його поверхні випаровується, і сухий виріб занурюється в розплавлене олово. При зануренні залізних виробів в місці зіткнення олова з залізом утворюється сплав залізо-олово. Поверх цього сплаву осідає шар чистого олова. Чим вище температура розплавленого олова і більше час перебування виробу в розплаві, тим товщі шар железооловянного сплаву.Температура розплавленого металу підтримується в межах 270-300 ° С. При більш високій температурі відбувається перевитрата флюсу і окислення олова на поверхні виробу, при більш низькій температурі - перевитрата олова, так як воно стає більш в'язким.
Гаряче цинкування знайшло широке застосування в промисловості внаслідок простоти і великій швидкості процесу. Перевага гарячого способу цинкування перед гальванічним проявляється в тому випадку, коли необхідно наносити товсті цинкові покриття (до 100 мкм). Підготовка поверхні виробу складається з операцій знежирення і травлення. Підготовлену поверхню обробляють флюсом.
Застосовують два типи флюсів: суміш хлоридів цинку і амонію або підігрітий флюс, який складається з 19% хлориду амонію, 79% хлориду цинку і 2% гліцерину. Після висушування на поверхні металу утворюється твердий склоподібний шар. Цинкування ведуть в розплаві, що складається з 98% цинку, 0,3% алюмінію і 1,7% олова при температурі 450 ° С протягом 15-25 с.
При гарячому способі поверхню покриваємої деталі сплавляєють з металом покриття, утворюючи металеву плівку залізоцинкового сплаву, різного за своїм складом: FeZn13, FeZn10, FeZn7 (твердий α-розчин цинку в залізі). Утворені шари інтерметалідів зменшують еластичність покриття і тим самим знижують його захисні властивості. Після виходу з ванни цинкування деталі охолоджують для прискорення процесу кристалізації і одночасно струшують для стікання надлишків рідкого цинку. Так як чистий свинець не утворює на поверхні заліза високоякісних покриттів, то гаряче свинцювання здійснюють зануренням виробу в розплав, що складається зі свинцю і 2-25% олова або 1-10% сурми.
Коли необхідно покрити залізо товстим шаром чистого свинцю, його попередньо покривають тонким шаром олова, а потім проводять свинцювання.
Залізні вироби з дифузійним покриттям металевими сплави володіють недостатньою стійкістю проти газової корозії. Підвищення жаростійкості металу можна досягти насиченням його поверхні іншими металами. Дифузійні покриття володіють порівняно високою корозійною стійкістю і жаростійкістю.
Дифузійні покриття отримують в результаті насичення поверхневих шарів захищаємого металу атомами захищаючого металу при високих температурах. У результаті взаємної дифузії утворюються покриття, товщина яких визначається температурою і часом обробки. Покриття мають змінний склад: поверхня покриття складається з чистого металу, а в міру віддалення вглиб зменшується відсоток металу покриття.
Практичне застосування знайшли покриття алюмінієм (алітування), кремнієм (термосіліціювання), титаном (титанування), хромом (термохромування). Ці покриття мають високу корозійну стійкість і жаростійкість внаслідок утворення на поверхні оксидів захищаючого металу.
Дифузійне покриття отримують при спільному нагріванні захищаємих виробів і металу покриття при певній температурі. Насичення можна проводити в порошкоподібних сумішах, в розплавлених середовищах і в газовій фазі. Можливість утворення дифузійних покриттів пов'язана з процесом дифузії в твердих тілах при нагріванні. При цьому атоми металу можуть залишати свої місця в кристалічній решітці в результаті теплових коливань і міграції, утворюючи вакантні місця, відбувається переміщення як атомів, які залишили свої місця в решітці,так і порожніх місць - "дірок". З підвищенням температури кількість "дірок" збільшується. У тих випадках, коли "дірки" заповнюються чужородними атомами розчиненої речовини, відбувається процес дифузії одного елемента в іншому.
У процесі отримання дифузійних покриттів, коли в поверхневому шарі утворюється твердий розчин впровадження або твердий розчин заміщення, відбувається спотворення решітки основного металу, що призводить до втрати пружної стійкості решітки та руйнування поверхневого шару металу. Утворення стійких дифузійних шарів без порушення суцільності твердого тіла можливе лише за умови, коли решітка насичуємо металу не зазнає сильного спотворення в місцях утворення покриттів. На викривлення кристалічної решітки впливає різниця діаметрів атомів покривається і диффундирующего металів. Встановлено, що різниця у розмірах атомних діаметрів стосовно до заліза не повинно перевищувати 15%. Важливим чинником утворення дифузійних покриттів є розчинність диффундирующего металу в залізі при кімнатній або підвищеній температурі. Товщина дифузійного покриття залежить від температури і тривалості процесу.
Термохромування підвищує жаростійкість, твердість сталі та опір до зношування. Жаростійкість термохромованої сталі підвищується до 800 °С. Висока твердість поверхневого шару обумовлена утворенням карбідів хрому. Термохромування ведуть в порошкових сумішах і газовій фазі. Найбільш продуктивним є газове термохромування - у суміші газів хлориду водню та хлориду хрому. Процес здійснюють при температурі 1000 °С. При взаємодії хлориду хрому з залізом протікає реакція витіснення хрому залізом:
CrCl3 + Fe = FeCl3 + Cr.
Хром дифундує в поверхневі шари сталі, утворюючи сплав хром-залізо, що містить до 30% хрому. Силіциювання підвищує жаростійкість сталі до 850 °С, а також корозійну стійкість у азотній і соляній кислотах. Силіциювані вироби з вуглецевої сталі набувають властивостей, що притаманні залізокремнмистим сплавам. Цьому процесу піддають, в основному, сталеві кислотопроводи, деталі насосів для перекачування кислот, різну арматуру апаратів, яка застосовується в хімічній промисловості.
Силіциювання сталевих виробів ведуть в порошкових сумішах і газовій фазі. Основними компонентами порошкової суміші є феросиліцій (від 60 до 90% кремнію в порошку), шамот або кварцовий пісок в кількості 20-25% для запобігання стікання суміші в процесі покриття. Для підвищення швидкості дифузії кремнію в порошкову суміш вводять 2-5% хлориду натрію або амонію. Силіціювання ведуть при температурі 1100 °С протягом 10-24 год. Товщина дифузійного шару досягає 1 мм. Силіціювання в газовій фазі ведуть при температурі 980 °С при взаємодії заліза з хлоридом кремнію:
3SiCl4 + 4Fe = 3Si + 4FeCl3.
Атомарний кремній дифундує в сталь, а пари хлориду заліза і присутній газоподібний хлор виводяться з системи витяжною вентиляцією. Поверхневий сплав залізо-кремній містить до 19% кремнію.
Алітирування - процес насичення алюмінієм поверхневих шарів сталі, чавуну і міді - призначено для підвищення жаростійкості виробів. Процес алітирування може бути здійснено як у суміші порошків, що містять 49% сплаву залізо-алюміній, 49% оксиду алюмінію, 2% хлориду амонію, так і в газовій фазі, де використовується летючий хлорид алюмінію:
AlCl3 + Fe = FeCl3 + Al.
Дифузійні покриття дозволяють поєднувати високу жароміцність основного металу з високою жаростійкістю поверхневого шару.
10.4 Металізаційні покриття
Металізація - спосіб одержання металевих захисних покриттів на різних апаратах, деталях судів і т.д. При цьому способі розплавлений метал за допомогою струменя стисненого повітря або інертного газу наноситься на поверхню, що захищається. Цим методом можна отримати шари будь-якої товщини і з гарним зчепленням з основним металом.
Широке застосування в промисловості має металізація цинком, кадмієм, свинцем, алюмінієм, нікелем, міддю, молібденом, вольфрамом, титаном і іншими металами.
Рис. 10.6 Схема плазмово-дугового пальника: 1 - дугова камера, 2 - позитивний електрод, 3 - сопло пальника (катод); 4 - генератор постійного струму.
Для покриття тугоплавкими металами застосовують плазмово-дуговий метод металізації. На рис. 10.6 наведена схема плазмово-дугового пальника. Метал у вигляді дроту або порошку подається в камеру за допомогою механізму, що подає і служить анодом. Катодом служить охолоджений водою наконечник. За допомогою високочастотних пристроїв між електродами запалюється дуга. Плазмоутворюючий інертний газ при великому тиску і швидкості продувають через область горіння. При зіткненні з електронами газ іонізується, набуває властивості плазми і виходить з сопла пальника у вигляді струменяю. Температура плазми 8000 °С, завдяки чому тугоплавкі метали швидко розплавляються і можуть бути нанесені за допомогою інертного газу на метал, кераміку і інші матеріали. В даний час знаходить широке застосування розпорошення металу у вакуумі розпорошення алюмінію, магнітних матеріалів у вигляді плівок.
Недоліками покриттів, одержуваних методом розпилення, є їх пористість, недостатньо міцне зчеплення з поверхнею, що захищається і порівняно великі втрати металу.
10.5 Плакірування
Плакірування застосовується для захисту корозійно-нестійких металів металами, що володіють підвищеною корозійною стійкістю в даному середовищі. Суть плакірування полягає в тому, що на одну або обидві сторони металу наноситься корозійно-стійкий шар металу (у вигляді пакету), що потім покритий метал піддають гарячому прокатуванню. При цьому утворюється міцне з'єднання внаслідок дифузії на кордоні двох металів. Таким чином, сталь плакірують міддю, латунню, нікелем, алюмінієм, нержавіючої сталлю; мідь плакірують золотом, сріблом; дюралюміній - алюмінієм і т. д.

