ВВЕДЕННЯ
Суспільство не може розвиватися без споживання. Для задоволення своїх потреб люди організують господарську діяльність. Основою цієї діяльності є виробництво. Для функціонування виробництва необхідні апарати, допоміжне обладнання, комунікації. У сучасному світі чисельність населення Землі швидко зростає. У 1850 р. воно становило 1,2 млрд. осіб, до 1950 р. збільшилося до 2,5 млрд. чоловік, а до середини 1987 р. - до 5 млрд. осіб, зараз нас майже 6 млрд. Відповідно зростають і потреби людей, причому не пропорційно зростанню їх чисельності, а більш високими темпами. Задовольнити ці безперервно примножують потреби можна тільки за рахунок розвитку виробництва. Так, якщо за останню чверть століття населення планети зросло в 1,6 рази, то обсяги основних виробництв - в 2-5 разів. Необхідність в масовій транспортуванні різноманітної сировини з районів видобутку газо- і нафтопродуктів в райони споживання та переробки призвело до будівництва широкої мережі комунікацій. Промисловість любої країни має підприємства з різноманітними технологіями виробництва. Обладнання для них виготовляють на основі сплавів чорних і кольорових металів, а також з природних або штучних хімічно стійких матеріалів. З часом воно старіє або руйнується внаслідок корозії. Це приносить не тільки великі економічні втрати, а також може призвести до глобальних екологічних катастроф. Економічний і екологічний збиток, що наноситься нашій планеті корозією металевих виробів, обладнання і конструкцій, досить значний. В останні роки, наприклад, тільки в Сполучених Штатах Америки щорічні втрати від корозії склали 300 мільярдів доларів, що відповідає 6% національного доходу всієї країни. Щорічні втрати металів через їх корозію становлять до 12% загальної маси металофонду, що відповідає втраті до 30% щорічно виробленого металу. Крім таких величезних пов'язаних з корозією прямих втрат, існують ще великі непрямі втрати. До них належать витрати, зумовлені втратою потужності металевого обладнання, його вимушеними зупинками через аварії, а також витрати на ліквідацію наслідків аварій, часто носять характер екологічних катастроф. Як правило, металевий виріб, що прийшов в непридатність внаслідок корозійних руйнувань, відправляють на переплавку. У цьому випадку загальні втрати будуть включати безповоротні втрати металу, що прокородував, вартість виготовлення металевих виробів і непрямі втрати. За статистичними даними безповоротні втрати становлять 8-12% від початкової маси металу. Вартість виготовлення металевих конструкцій найчастіше перевершує вартість самого металу. До непрямих втрат відносять витрати, пов'язані з відмовою в роботі металевого обладнання, з його простоями і ремонтом. Сумарно в більшості країн втрати від корозії становлять 4-6% національного доходу. Зростанню втрат від корозії сприяє постійне інтенсивний розвиток найбільш металомістких галузей промисловості, наприклад, енергетики (теплової та атомної), транспорту (у тому числі трубопровідного), металургії, хімічної, нафтової та нафтохімічної промисловості та ін., а також жорсткість умов експлуатації металу як в промисловості, так і в міському господарстві. Все це вказує на виняткову важливість проблеми боротьби з корозією металів, а отже, і на велику значимість розвитку науково-технічних робіт у цій галузі.
Для знаходження шляхів практичного вирішення тих чи інших завдань, що виникають в результаті корозійного руйнування різних металевих об'єктів, необхідно, в першу чергу, знання законів такого руйнування, тобто теорії корозії металів. Це вимагає розгляду загальних питань, до яких, крім механізму корозії металів, слід віднести такі розділи, як:
• діагностика конструкцій та обладнання потенційно небезпечних виробництв і об'єктів;
• оцінка міцності і залишкового ресурсу експлуатованих конструкцій і обладнання об'єктів підвищеної небезпеки;
• розробка ресурсозберігаючих технологій зварювання та суміжних процесів для підвищення надійності роботи конструкцій;
• сертифікація та нормування, як основа забезпечення якості обладнання;
• екологічні та соціально-економічні проблеми забезпечення надійності експлуатації потенційно небезпечних об'єктів.
Цільовим призначенням описуваних в підручнику матеріалів зазначених напрямків є виклад наукових основ корозії металів і способів практичного використання цих основ під час вибору і реалізації оптимальних шляхів протикорозійного захисту металевих виробів і конструкцій.
Чатина 1 Основи теорії корозії металів
Глава 1 газова корозія металів
1.1. Загальна характеристика процесів газової корозії
Газова корозія протікає при контакті металів з газами у відсутності електропровідних розчинів. У природних умовах газова корозія зустрічається рідко, а в технологічних процесах, особливо на металургійних та хімічених виробництвах, - досить часто. Як правило, газова корозія протікає по хімічному механізму.
Хімічна корозія металів - це самовільний окисно - відновний процес, який підпорядковується законам гетерогенних хімічних реакцій, які проходять одночасно в одному акті в точці взаємодії металу з компонентом агресивного середовища. Метал в процесі хімічної корозії виступає в ролі відновника, він віддає електрони і окислюється. Компонент агресивного середовища виступає в ролі окислювача, акцептора електронів. В процесі реакції він відновлюється. У ролі окислювачів можуть бути О2, CL2, НСL, SО2, СО2 і т.д.
Приклад. У промисловості синтез хлористого водню з хлору і водню здійснюють при температурі 1000-1200 °С. Якщо при цьому застосовують металеві печі, то внутрішня поверхня печей схильна до газової корозії. Залежно від вмісту хлору та водню в суміші газів протікають реакції:
Fe + CL2 = FeCL2
або
2Fe + 3CL2 = 2FeCL3.
Залізо виступає в якості відновника, хлор - окислювача, а на поверхні металу утворюється сольова плівка. Найбільш часто хімічний механізм реалізується в процесах газової корозії і в рідкому середовищі неелектролітів. Для більшості процесів основною умовою здійснення хімічної корозії є відсутність на поверхні металу плівки води. Ця вимога може бути досягнуто при дотриманні однієї з трьох умов:
• гази, що реагують містять мінімальну кількість вологи (як правило, не більше сотих часток відсотка);
• контакт металу і газів здійснюється при високих температурах, що перевищують «точку роси», коли конденсація вологи на поверхні металу не відбувається;
• метал знаходиться в середовищі неполярних органічних сполук.
У технологічних процесах часто вводять стадію осушки газів для зниження їх корозійної активності. Приклад. Вологий хлор є коррозіонноактівной середовищем. У ньому стійки тільки титан або графітові матеріали. Тому заключній стадією виробництва хлору є осушення газу сірчаною кислотою, що дозволяє знизити вміст вологи до 0,003-0,04%. При дотриманні цих умов швидкість корозії різко знижується і можливе застосування сталевої апаратури і трубопроводів. Аналогічну операцію проводять при отриманні брому, знижуючи на останніх стадіях процесу вміст вологи до 0,003-0,01%. Академік П.А. Ребіндер класифікував форми зв'язку води з матеріалом в залежності від енергії зв'язку. Вода в адсорбційних шарах (фізико-хімічний зв'язок) відрізняється від вільної води як за хімічними, так і по термодинамічних властивостях. Діелектрична постійна адсорбованої води в 40 разів менше, ніж у вільної води, а температура замерзання на кілька десятків градусів нижче. Припускають, що при контакті металу з газами, що містять до 0,05% Н2О, на поверхні металу знаходиться тільки фізико-хімічно зв'язана вода. Область існування високотемпературної газової корозії визначається інтервалом температур. Нижня межа відповідає температурі конденсації пари на поверхні металу. Це стан, який називається «точкою роси», залежить від парціального тиску парів води. Для повітря при атмосферному тиску вона оцінюється температурою, рівної 240-250 °С, а для газів, що відходять теплоелектростанцій - 90-100 °С. При температурах, що перевищують «точку роси», починається область хімічної газової корозії. Верхня температурна межа визначається такими властивостями металу, як жаростійкість і жароміцність. Жаростійкість характеризує здатність металу чинити опір корозійному впливу газів при високій температурі. Жароміцність визначає здатність матеріалу в умовах високотемпературного впливу зберігати хороші механічні властивості, тривалу міцність і опір повзучості. Метал може бути жаростоек, але не жароміцний, і навпаки - жароміцний, але не жаростоек. Так, наприклад, жароміцні сталі на основі заліза можна експлуатувати при температурах до 700 ° С, алюмінієві та мідні сплави - до 400-450 ° С, свинець - до 150 ° С. Ефективне поєднання жароміцності і жаростійкості досягається в сплавах системи нікель-хром - до 1000 °С. Високотемпературне взаємодія металів з окислювальним середовищем має місце при багатьох хімічних процесах.
Приклади. При виробництві сірчаної кислоти стадія випалювання серосодержащего сировини протікає при 700-800 °С, а контактна окислювання діоксиду сірки SО2 при 420-550 °С. При отриманні азотвмісних сполук конверсія метану СН4 здійснюється при температурі 700-800 °С, синтез аміаку NН3 при тиску 35-40 МПа і 400 °С, окислення аміаку при виробництві азотної кислоти при 750-800 °С, синтез хлористого водню НСL при 1000-1200 °С, хлорування метану при 400-450 °С, отримання метилового спирту СН3ОН при 375-400 °С, крекінг нафтопродуктів вище 450 °С. В усіх наведених прикладах поверхню апаратів піддається впливу агресивного газового середовища, що має призвести до утворення на металі оксидних або сольових сполук.
1.2. Структура металів і її вплив на корозійні процеси
Механізм утворення поверхневих сполук, їх адгезія до металу і властивості впливають на процес корозії. У свою чергу ці показники багато в чому визначаються структурою і складом металу. Більшість металів за винятком металевих стекол мають кристалічну структуру. У вузлах кристалічної решітки розташовані позитивно заряджені іони, а електрони вільно переміщуються в металі.
Найменша частина просторової решітки, якій притаманні всі властивості симетрії решітки в цілому, називається елементарною граткою. Якщо цей осередок є кубом, то і відповідна їй гратка буде кубічною. Простою кубічною граткою називається така решітка, у якої атомами або іонами зайняті лише вершини її елементарних осередків. Такий тип решітки мають, наприклад, кристалі кухонної солі NaСL. Грати, у якій крім вершин атомом або іоном зайнятий центр, називається об'емноцентрованою. Таку кристалічну будову мають літій, натрій, калій, ванадій, хром, залізо (при температурах до 900 °С). Гранецентрованою називається така решітка, у якої матермальнимі частками зайняті центри граней. Такий тип кристалічної решітки мають алюміній, нікель, мідь, свинець, срібло, золото, платина, залізо (в інтервалі температур 900-1400°С). Гексагональна решітка має в основі шестикутник. За таким принципом кристалізуються берилій, марганець, кадмій, титан і ін. Розрізняють також щільноупаковані кристалографічні площини і грати.
У ряді випадків кристалографічна структура визначає корозійну стійкість металів і їхніх сплавів. Реальні металеві матеріали, як правило, є полікристалічними, тобто складаються з безлічі окремих кристалів, які в загальному випадку мають неправильну форму і називаються кристалітів або зернами. На відміну від ідеальних кристалів, в яких атоми кристалічної решітки розташовані строго періодично, реальні кристалі завжди мають порушення регулярності структури (разупорядоченності), які називаються дефектами. Основними причинами відсутності у реальних конструкційних металевих матеріалів ідеального кристалічного стану є нерівноважні умови кристалізації металу, присутність в його складі легуючих і домішкових елементів, деформація кристалічної решітки внаслідок впливу на неї в процесі виготовлення виробів механічних, термічних, радіаційних та інших факторів. В даний час існує декілька способів класифікації дефектів металевих конструкційних матеріалів:
• за морфологічними ознаками - зовнішні, внутрішні, впровадження та ін;
• за походженням (генетичними ознаками) - ливарні, зварювальні, термічні, деформаційні, корозійні та ін;
• за структурними ознаками - тріщини, пори, надлишкові фази, неметалеві включення, межі зерен і др;
• на геометричні розміри-макро-(> 1 мм), мікро-(~ 200-1000 мкм) і субмікро-(~ 0,1-200 мкм) дефекти;
• по геометричних ознаками - точкові, лінійні, двомірні.
Дефекти кристалічних решіток змінюють задані властивості металів, впливають на його хімічні і електрохімічні характеристики. Дефекти структури, що виходять на поверхню металу, мають підвищену реакційною здатністю і вони є першими осередками корозії. Сторонні домішки концентруються у лінійних дислокацій і дірок на межі зерен. Ці сегрегації можуть збільшувати окислення металу, полегшувати утворення піттінгів. Будь-який вид неоднорідності підсилює як хімічну, так і електрохімічну корозію. Існує чотири основні типи точкових дефектів - вакансії, домішкові атоми заміщення і впровадження, дислоковані атоми, дефекти Френкеля. Вакансії (рис. 1.1, а) є найбільш часто зустрічаються точковими дефектами і являють собою вільні вузли в кристалічній решітці.
а |
б |
в |
г |
Рисунок 1.1. Точкові дефекти в кристалах:
а - вакансія; б - дислокований атом; в - дефект Френкеля; г - домішкові атоми впровадження. Стрілками указані напрямки зміщення атомів в кристалічній решітці.
Утворенню вакансій, в першу чергу, сприяють теплові коливання атомів. Вакансії виникають також при впливі на метал механічних напруг, радіоактивного випромінювання та ін При утворенні вакансій кристалічна решітка спотворюється, і найближчі до неї сусідні атоми зміщуються від свого рівноважного стану. Наприклад, для металів з гранецентрваними кубічними (ГЦК) гратами такий зсув для найближчих сусідніх атомів становить 0,84% міжатомної відстані (в сторону вакансії), для другого шару атомів - 0,25% (у бік від вакансії), для третього шару - 0,03% (у бік вакансії). Технічно чисті метали, до яких відносяться конструкційні матеріали, завжди містять в структурі домішкові атоми впровадження та / або заміщення (рис. 1.1, г), що є дефектами не тільки фізичної, але і хімічної природи. Домішкові атоми завжди розташовуються у вузлах кристалічної решітки, заміщуючи атоми основного металу. Домішкові атоми впровадження розташовуються в міжвузлях кристалічної решітки (рис. 1.1, г). При утворенні сплавів атоми впровадження з'являються в тому випадку, якщо відношення атомних діаметрів розчиненого і основного металів не перевищує 0,59. До схожих дефектів відносяться дислоковані атоми (рис. 1.1, б) - атоми основного металу, зміщені зі своїх рівноважних положень у міжвузольний простір. Переважними місцями розташування дислокованих атомів є порожнечі найбільшого обсягу, оскільки в цьому разі спотворення решітки будуть мінімальні. Утворення вакансій і дислокованих атомів може відбуватися одночасно. У цьому випадку утворюються парні дефекти, звані дефектами Френкеля (рис. 1.1 в). Енергія, необхідна для їх утворення, істотно вище, ніж енергія, необхідна для утворення індивідуальних вакансій або дислокованих атомів, внаслідок чого концентрація дефектів Френкеля в металевих матеріалах набагато нижче, ніж інших точкових дефектів. Точкові дефекти грають істотну роль у процесах дифузії іонів металу при утворенні поверхневих оксидних плівок. При легуванні іони легуючого компонента можуть входити в грати основного металу, утворюючи тверді розчини заміщення або витіснення. Лінійними (одновимірними) дефектами кристалічної решітки є дислокації. Дислокації виникають як в процесі затвердіння охолоджуваного металу, так і при механічних або інших впливах на метал. У конструкційних матеріалах дислокації утворюють суцільні сітки. Залежно від умов виготовлення металевих виробів щільність дислокацій в них може змінюватися від 103-104 см–2 (у добре відпалених матеріалах) до 109-1010 см–2 (у пластично деформованих матеріалах). Середня щільність дислокацій в полікристалічних матеріалах складає 106-108 см–2.
а |
б |
в |
|
г |
Рисунок 1.2. Будова границь в просторовій кубічній решітці:
а - границя скручування; б – двійник з когерентною границею; в, г - границі зерен, що розорієнтовані під великим кутом (г - загальний вигляд).
У реальних металевих матеріалах кількість дислокацій така, що вони утворюють суцільну тривимірну сітку з вузлами, в яких відбувається перетин окремих дислокацій. Відстань між вузлами сітки дислокацій оцінюється як ~ 10–4 см. До площинних і поверхневих дефектів кристалічної решітки (рис. 1.2 та 2.3) відносяться кордони, що розділяють різноорієнтовані області - межі зерен (рис. 1.2, а, в, г), блоків (разоріентірованних під малими кутами областей одного зерна, рис. 1.3, б), двійників (кристалів, решітки яких є дзеркальним відображенням один одного, рис. 1.2, б), а також межі, що розділяють ділянки решітки з різною упаковкою атомних шарів. Типи кордонів розрізняються кутом розорієнтування Ω (рис. 1.3, а). Величина Ω для блоків зазвичай становить 0,01 рад (~ 1°), для зерен ця величина може досягати десятків градусів. У цьому випадку межі представляють собою широкі смуги порушення кристалічної структури, що забезпечують плавний перехід від однієї орієнтації решітки до іншої. Чим більше величина Ω, тим вище енергія кристалічної решітки. У всіх випадках енергія грати, що містить поверхневі дефекти, више, ніж утієї, що містить лінійні дефекти. Границі, всі атоми яких одночасно належать обом кристалам (зернам), що стикаються називаються когерентнми (рис. 1.2, б), в іншому випадку границя є некогерентною. Дефекти кристалічної рещітки сприяють протіканню в металі процесів дифузії і фазових перетворень. Так, наприклад, добре відомий вакансійний механізм дифузії, коли атоми легуючих або домішкових елементів перерозподіляються в металі внаслідок послідовного переміщення у вакантні вузли. Взаємодія дефектів, приводить до зниження енергії кристалічної решітки. Це явищеє поширеним для металічних матеріалів.
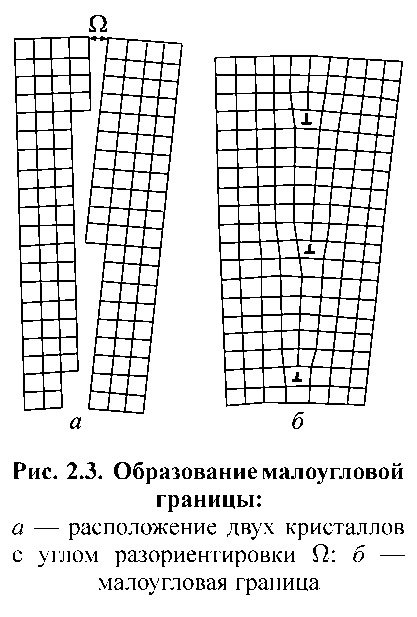
а б
Рисунок 1.3. Утворення границі з малим кутом:
а – розташування двох кристалів з кутом розорієнтування Ω; б - границя з малим кутом.
Основна частина металевих конструкційних матеріалів проводиться шляхом виплавки, технології здійснення якої багатоступінчасті і визначаються необхідними властивостями отриманого матеріалу. Спільною рисою процесів виплавки металів і сплавів є нагрівання рудних матеріалів і напівфабрикатів до високих температур, що перевищують температуру плавлення найбільш тугоплавкого компонента, і наступне охолодження до температури затвердіння і далі до кімнатної температури. Залежність температур плавлення елементів від їх номера в періодичній системі Менделєєва наведена на рис. 1.4. Процес затвердіння рідкого металу супроводжується зміною його агрегатного стану з рідкого на тверде. Структура ближнього порядку, коли впорядковане розташування атомів поширюється тільки на найбільш близьких сусідів (характерно для рідких тіл чи твердих тіл, що знаходяться в аморфному стані), змінюється при цьому на структуру далекого порядку, коли практично у всьому обсязі матеріалу дотримується регулярне розташування атомів (характерно для кристалічних твердих тіл). Об’єм тіла при його затвердінні зменшується на 2 - 6 %, що є наслідком зменшення міжатомних відстаней. Ефект тим більше, чим більш компактна решітка характерна для затверділого металу. Внаслідок зменшення об'єму металу при його затвердінні в структурі реального злитка, як правило, присутні макродефекти - тріщини, раковини, порожнини. Крім макродефектів затверділий метал містить велику кількість мікродефектів - вакансій, дислокацій, дефектів, меж розділення. Будь-який вид неоднорідності, як то по складу, наявності домішок, центрів залишкової напруги, електропровідності окремих ділянок, призводить до збільшення швидкості корозії. Для того, щоб усунути або зменшити ці явища, проводять такі технологічні операції як загартування, відпал та ін. У переважній більшості металеві конструкційні матеріали є багатокомпонентними сплавами, до складу яких входять легуючі (вводяться спеціально для додання матеріалу необхідних властивостей) і домішкові (потрапляють в матеріал з рудними матеріалами в процесі виплавки і металургійних переділів) елементи. Вступаючи один з одним у взаємодію компоненти сплавів можуть утворювати фази - однорідні за структурою (кристалічному будові) та складом (концентрації компонентів) області, обмежені поверхнями розділу. Конструкційні матеріали, як правило, містять декілька фаз, відносна кількість яких може істотно відрізнятися.
1.3. Основи термодинаміки процесів корозії металів
Багато реакцій, що протікають при корозії, є оборотними. Закони термодинаміки дають можливість визначити ймовірність утворення з'єднання в тих чи інших умовах. На цілеспрямованому зсуві рівноваги заснований один з методів захисту металів від газової корозії - створення захисних атмосфер. Для визначення стану речовини в термодинаміці використовують такі поняття, як внутрішня енергія (U), ентальпія (Н), ентропія (S), ізобарно-ізотермічний потенціал (G), хімічний потенціал (μ). Зміна внутрішньої енергії в процесі пов'язане з кількістю виділеної теплоти (Q) і величиною виконаної системою роботи (А):
ΔU = Q – A. (1.1)
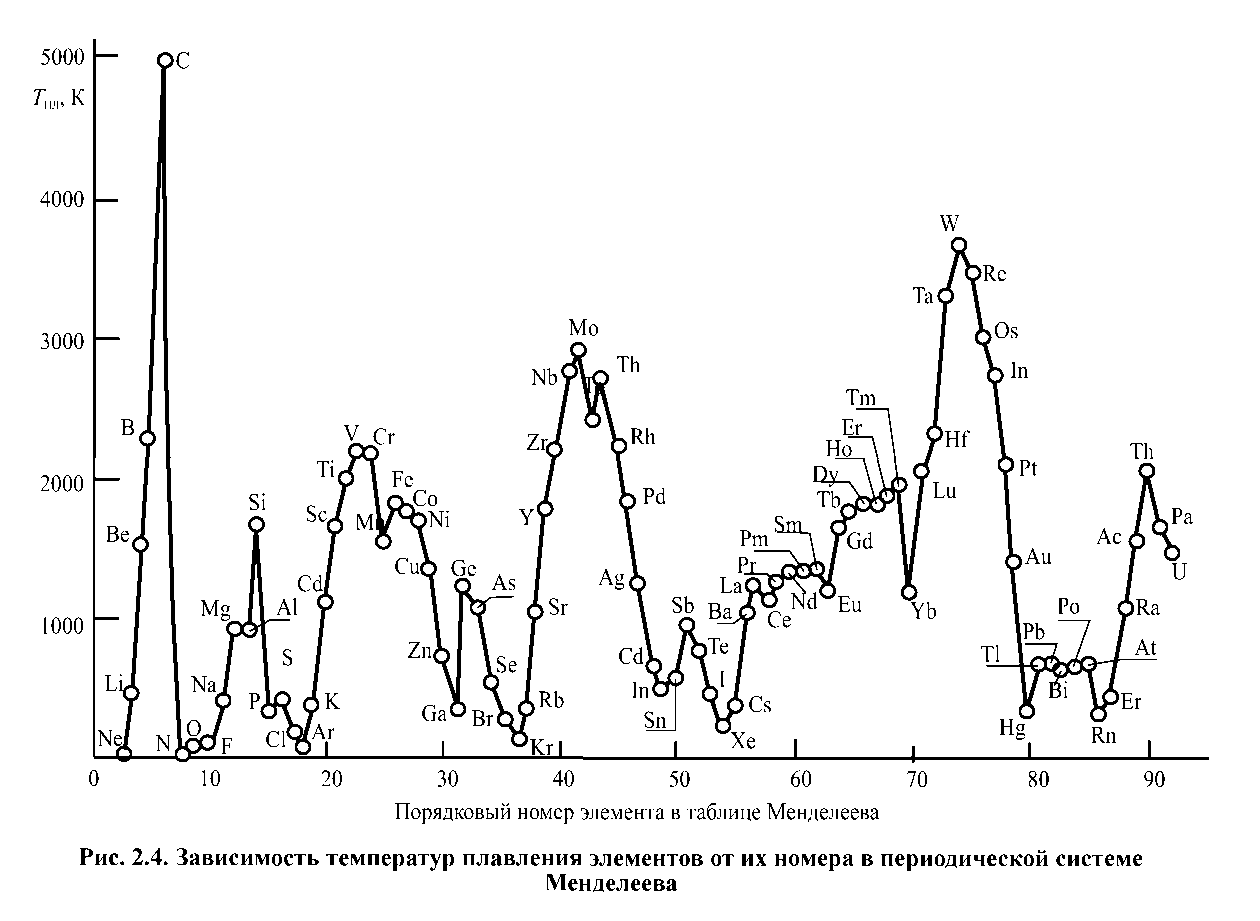
Порядковий номер елемента в таблиці Мендєлєєва
Рисунок 1.4. Залежність температур плавлення елементів від їх номеру в періодичній системі Мендєлєєва.
У випадку проходження хімічної реакції, що протікає при постійному об’ємі системи, зміна внутрішньої енергії дорівнює взятому з оберненим знаком тепловому ефекту реакції. Енергія речовини при постійному тиску характеризується ентальпією (Н). Остання більше внутрішньої енергії на величину роботи, яку може зробити система при постійному тиску:
Н = U + PV. (1.2)
При постійному тиску і за умови, що в ході процесу здійснюється тільки робота розширення
A = PΔV, (1.3)
або
ΔH = ΔU + PΔV. (1.4)
Порівнюючи рівняння (1.1) та (1.2) бачимо, що:
ΔНр = – Q, (1.5)
де ΔНр - ентальпія при постійному тиску.
Рівновага пов'язанa не тільки з різницею в енергії молекул, а й з імовірністю станів вихідних речовин і продуктів реакції, з можливістю протікання реакцій. Величина, яка дозволяє кількісно визначити ймовірність стану, називається ентропією, її зміна позначається ΔS, а розмірність - Дж /(моль∙град.). У хімічних реакціях, що йдуть при постійному тиску, одночасно змінюються і ентальпія і ентропія, а процес протікає в напрямку, при якому зменшується загальна рушійна сила реакції. Рушійна сила називається вільною енергією або ізобаричний потенціалом (ΔG). За міжнародною угодою 1961p. ізобарний потенціал названий «Bільною енергією Гіббса». Його розмірність - Дж / моль. Ізобаричний потенціал є властивістю речовини, що виражає одночасно як його ентальпію (енергію), так і властиву йому ентропію (ступінь безладдя).
Основне рівняння термодинаміки, що пвязує ці величини, має наступний вигляд:
ΔG = ΔH – TΔS. (1.6)
Ізобаричний потенціал пов'язаний з константою рівноваги простим співвідношенням:
ΔG = – RTlnK. (1.7)
Як приклад розглянемо реакцію окислення металу:
Ме + О2
![]() МеО2
МеО2
У газовій атмосфері, що містить кисень, рівняння для ізобарно-ізотермічного потенціалу матиме вигляд:
ΔG = – RT lnK – RT ln aO2, (1.8)
Показуючи значення енергії Гіббса через
величини рівноважного
![]() парціального РО2 тиску кисню,
отримаємо:
парціального РО2 тиску кисню,
отримаємо:
ΔG = – RT ln![]() – RT lnPO2 = – RT ln
– RT lnPO2 = – RT ln![]() .
(1.9)
.
(1.9)
Рівняння дозволяє оцінити можливість перебігу процесу окислення. Якщо РО2 > , то процес окислення можливий, так як в цих умовах ΔG < 0. Якщо РО2 < , то окислення неможливе, бо при цьому ΔG > 0. Цей принцип використовують для запобігання газової корозії в ряді технологічних операцій, наприклад, в металургії. Знижуючи парціальний тиск РО2 в газовому середовищі, оберігають метал від окислення при високих температурах.
1.4. Корозія металів в неелектролітах
Корозія в неелектролітах - це корозія в рідинах, що не проводять електричний струм. До неелектролітів належать, наприклад, бром, розплавлена сірка, багато органічних речовин (бензол, хлороформ, фенол тощо), рідке паливо (нафта, гас, бензин), мастила. Корозія металів і сплавів в безводних розчинах неелектролітів протікає з меншою швидкістю, ніж у розчинах електролітів, і переважно за хімічним механізмом. Проте все ж таки призводить до значних руйнувань металевої апаратури. Розплавлена сірка хімічно активна і реагує майже з усіма металами. В її присутності сильно кородує мідь, олово, свинець, меншою мірою - вуглецева сталь і титан, і незначною мірою - алюміній. Вологий хлор викликає сильну корозію апаратури. У його середовищі стійким є тільки титан і неметалеві матеріали. При зниженні концентрації вологи до 0,04% можливе застосування сталевої апаратури. Для збільшення корозійної стійкості сталевих поверхонь за умови при можливого проскоку недостатньо осушеного хлору рекомендується покривати сталеві деталі захисним шаром нікелю. Так, при товщині шару нікелевого 30 мкм такі деталі зберігають корозійну стійкість при 20 °С в хлорі, вологість якого складає 0,3%. Рідкий бром взаємодіє при кімнатній температурі з багатьма металами. До них відносяться мідь, срібло, алюміній, олово, титан, хром, залізо, вуглецеві сталі і т.д. Для зберігання рідкого брому запропоновані сталеві ємності, гомогенно освинцьовані всередині. Застосовують також покриття з чистого нікелю. Більшість органічних рідин, що не містять води та інших домішок, інертні по відношенню до сталі. Але присутність вологи, навіть у незначних кількостях, створює агресивне середовище, хімічна корозія переходить в електрохімічну, і процес окислення металу прискорюється. Так, сталь в тетрахлориді вуглецю є корозійностійкою. При попаданні слідів вологи відбувається гідроліз ССL4 :
CCL4 + H2O = CCL3OH + HCL
Утворюється агресивне електропровідне середовище, яке викликає сильну корозію сталі. Корозійна активність нафти та продуктів її переробки визначається вмістом у ній сполук сірки - сірководню, і меркаптанів (тіоспиртів із загальною формулою (R-SН)). Ці сполуки викликають корозію кобальту, нікелю, свинцю, олова, міді та інших металів за рахунок утворення на поверхні сульфідів і меркаптидів металу типу RS-Ме-SR. Чим більше в рідких продуктах сірки, тим сильніше корозія. Так, в мазуті, що містить 3,7% сірки, швидкість корозії сталі (0,12% С) в 6 разів більше, ніж в мазуті, що містить 0,5% сірки. Сталь може кородувати при зіткненні з бензинами, так як вуглеводні бензинів окислюються під дією кисню повітря, утворюючи органічні кислоти. Металеві вироби, що працюють в розчинах неелектролітів, готують з матеріалів, стійких в даному середовищі. Високохромисті сталі використовують при виготовленні апаратури для переробки нафти. Широко застосовують нанесення на поверхню сталі захисних покриттів.
Питання для самоперевірки
1. Вкажіть умови, при яких протікає газова корозія.
2. Що називається жаростійкістю і жароміцністю металу?
3. Наведіть визначення хімічного механізму корозії. За яких умов він реалізується в газовій фазі?
4. Які типи кристалічних решіток вам відомі?
5. Які ви знаєте дефекти кристалічних решіток?
6. Які зміни структури металу відбуваються при його затвердінні?
7. Наведіть основне рівняння термодинаміки.
8. Проаналізуйте вплив парціального тиску кисню (Ро2) на можливість протікання реакції окислення металу.
1.5 Основні стадії газової корозії металів
Утворення продуктів корозії здійснюється в результаті протікання ряду послідовних і паралельних реакцій. На рис. 1.5 представлена схема утворення суцільної оксидної плівки при окислюванні металу киснем з газової фази. Процес окислення металу протікає в кілька стадій:
1. іонізація металу і перехід його у формі іонів і електронів в шар оксиду;
2. переміщення іонів металу Меn + і електронів в шарі оксиду;
3. перенос кисню з газового потоку до поверхні оксиду;
4. адсорбція кисню на поверхні;
5. перетворення адсорбованого кисню в іон О2-;
6. переміщення іонів кисню О2-в шарі оксиду;
7. реакція утворення оксиду.
У деяких випадках окремі стадії процесу можуть випадати або трансформуватися. Але загалом всі стадії процесу взаємопов'язані і протікають послідовно. Сумарна швидкість процесу визначається швидкістю найповільнішого реакції.
Наприклад, якщо повільно протікає стадія (3), то процес лімітується зовнішньою дифузією, якщо (1), (2) або (6) - має місце внутрішньодифузійний контроль процесу. Відмінною особливістю газової корозії металу є в окремих випадках затухання процесу в часі. Це відбувається тоді, коли на поверхні металу утворюється захисна плівка. Якщо ця плівка є суцільною і має хорошу адгезію з поверхні, то вона ізолює метал від контакту з агресивним середовищем і корозія припиняється. Першим етапом цього процесу має бути адсорбція окислювача на поверхні, закономірності якої будуть розібрані нижче.
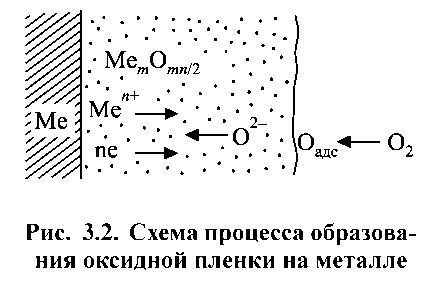
Рисунок 1.5. Схема процесу утворення оксидної плівки на металі.
1.6. Адсорбція газів на поверхні металів
Адсорбцією називають зміну концентрації речовини на межі розділу фаз. Адсорбційна рівновага, тобто рівноважний розподіл речовини між прикордонним шаром і фазами, що межують між собою, є динамічною і швидко встановлюється. Частинки, які знаходяться на поверхні твердого тіла, володіють надлишковою енергією. За рахунок цього молекули навколишнього середовища притягуються до металу і концентруються на його поверхні. Цей процес протікає завжди мимоволі і з позитивним тепловим ефектом. Розрізняють два види адсорбції: фізичну і хімічну. Фізична адсорбція зумовлена вандерваальсовскими силами. Енергія зв'язку між молекулами адсорбату і поверхнею металу невелика (близько 40-50 кДж / моль). Рівновага встановлюється швидко. Адсорбовані речовини можуть бути легко видалені з поверхні. Фізична адсорбція найбільш чітко проявляється при низьких температурах, близьких до температури конденсації адсорбата. Хемосорбції називається процес адсорбції, що супроводжується хімічною реакцією між молекулами адсорбованої речовини і металом. Енергія зв'язку між атомами оцінюється величинами 150-160 кДж / моль. Зв'язок, що виникає між металом і окислювачем, має іонний характер. Метал віддає атому адсорбованого речовини електрони. Процес хемосорбції протікає дуже швидко (частки секунди). Зовнішня поверхня адсорбованої плівки при цьому заряджається негативно, а внутрішня - позитивно. Кількість адсорбованого речовини, віднесене до одиниці поверхні, залежить від температури середовища і концентрації адсорбату в газовій або рідкій фазі. Функціональна залежність між рівноважною кількістю адсорбата на поверхні твердого тіла і концентрацією або тиском Р (якщо адсорбат є газом) при Т = соnst; називається ізотермою адсорбції. Вперше теоретичне обгрунтування ізотерми адсорбції було дано Ленгмюром. Їм було зроблено декілька припущень, що спрощують модель процесу. Передбачалося, що:
- поверхню адсорбенту енергетично однорідна;
- частинки адсорбату на поверхні ніяк не взаємодіють один з одним;
- на один активний центр поверхні припадає одна частинка адсорбованої речовини;
- може утворюватися тільки мономолекулярний адсорбційний шар.
Швидкість процесу адсорбції vад буде прямо пропорційною до тиску газу Р і величині вільної поверхні металу (Θ):
vад = Кад∙Р(1 – Θ), (1.10)
де Кад – константа, що характеризує швидкість пороцесу адсорбції.
Швидкість зворотного процесу - десорбції - буде прямо пропорційною поверхні, що зайнята реагуючими молекулами:
vдес = Кдес∙Θ, (1.11)
де Кдес - константа, що характеризує процес десорбції, а Θ - доля поверхні металу, зайнята частинками адсорбата.
При встановленні рівноваги швидкість адсорбції є рівною швидкості десорбції:
vад = vдес.
Адсорбція може бути мономолекулярною і полімолекулярною. В останньому випадку на поверхні адсорбенту утворюється кілька шарів. Перший мономолекулярний шар обумовлений силами взаємодії між поверхнею твердого тіла і адсорбатом. Другий і наступні шари утримуються ван-дер-ваальсовскими силами. Шари адсорбату розподіляються по поверхні нерівномірно. На деяких ділянках їх може бути два або три шари. Одночасно можуть залишитися ділянки, закриті моношаром або зовсім вільні від адсорбату (рис. 1.6).

Рисунок 1.6. Схема заповнення поверхні адсорбенту при моношаровій адсорбції.
1.7. Утворення оксидів на поверхні металу
Молекули О2 адсорбуються на поверхні металу оборотно. Кількість адсорбата на одиницю поверхні зростає із збільшенням співвідношення Ро2/Рs де Ро2 - тиск кисню над адсорбатом, а Рs - тиск насиченої пари кисню при досліджуваної температурі. Як видно з рис. 1.7 вид експериментальної залежності подібний з ізотермою на рис. 1.8. Спочатку відбувається мономолекулярна адсорбція, а починаючи з деякого значення Ро2/Рs, має місце багатошарова фізична адсорбція. Швидкість адсорбції, як правило, зростає в часі і відбувається тим швидше, чим вище температура. На рис. 1.8 наведено кінетичні криві адсорбції кисню на сріблі. Існує думка, що спочатку утворюється адсорбційнний шар, який пізніше перетворюється на шар оксиду. Перші порції кисню поглинаються з виділенням значної кількості теплоти а, отже, зі зниженням ізобарного потенціалу, тобто самовільно. Тепловий ефект адсорбції кисню має той же порядок, що й теплота утворення оксиду. Тому адсорбцію кисню можна розглядати як хімічну взаємодію О2 з поверхнею металу. Наступні порції кисню поглинаються з меншим тепловим ефектом.
Маса поглиненого кисню m, мкг |
|
Об’єм плоглиненого кисню V, см3 |
|
Рисунок 1.7. Ізотерма адсорбції кисню на алюмінії при 77 К. |
Рисунок 1.8. Кінетика адсорбції кисню на сріблі для ріхних температур. |
||
Хімічний зв'язок між адсорбованим киснем і металом має іонний характер. Електрони металу притягуються до атомів кисню. Останні перетворюються на негативні часточки О2–. Поки на поверхні є тільки моношар кисню, утворення оксиду як нової фази не відбувається. Оксид буде сформований в тому випадку, коли взаємне розташування катіонів металу і аніонів О2– відповідатиме структурі кристалічної решітки оксиду. Існує думка , що перехід від хемосорбованого шару кисню до оксиду відбувається легше, якщо існує крісталохімічна відповідність між гратами металу та оксиду і відстань між іонами металу в оксиді і в решітці металу близькі між собою. Адсорбовані іони О2– можуть проникати під поверхню металу і формувати оксид в глибині. Схеми будови хемосорбованого шару і оксиду металу представлені на рис. 1.9. Утворення хемосорованого шару кисню відбувається швидко. Стадія проникнення іонів кисню вглиб і формування оксиду протікає зазвичай у 104-105 повільніше. Тонкий шар оксиду (у кілька десятків ангстрем) має мелкокристаллическую структуру. При підвищенні температури на ньому виникають окремі більші зародки. З плином часу зародки захоплюють всю поверхню металу і первинна дрібнокристалічна плівка оксиду повністю перекристалізовується в більш крупні кристалі.
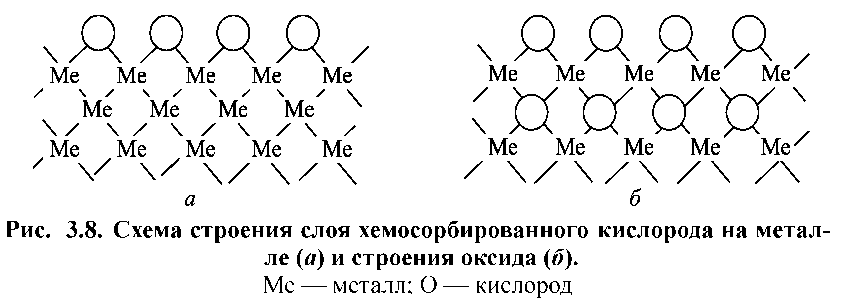
а б
Рисунок 1.9. Схема будови шару хемосорбованого кисню на металі (а) та будови оксиду (б): Ме – метал; О – кисень.
В атмосферних і промислових умовах більшість металів покрито плівкою продуктів корозії. Жаростійкість металів при цьому визначається властивостями плівок.
Поверхнева плівка, яка утворюється на металі, визначає його корозійну стійкість в агресивному середовищі. Плівки класифікують залежно від їх товщини. Розрізняють :
• тонкі (невидимі) плівки товщиною від мономолекулярного шару до 40 нм;
• середні плівки (видимі завдяки інтерференційному забарвленню як кольори мінливості), мають товщину 40-500 нм;
• товсті (видимі) плівки товщиною більше 500 нм.
Товщина утворюваних плівок багато в чому визначається умовами окислення.
Продукти корозії, які утворюються на поверхні металу, можуть гальмувати подальший процес корозії. Однією з основних умов, що характеризують цю здатність, є суцільність одержуваної плівки. Критерій суцільності вперше був сформульований Пілінгом і Бедворсом. Умова суцільності виконується тоді, коли молекулярний об'єм хімічного поверхневого з'єднання (наприклад, оксиду) більше об'єму металу, витраченого на утворення молекули оксиду. Співвідношення об'ємів утвореного оксиду і вихідного металу може бути легко підраховано.
Припустимо, що окислюється 1 грам-атом металу. Його об'єм можна визначити за формулою:
VМе =
![]() , (1.12)
, (1.12)
де АМе - атомна маса металу; ρМе - щільність металу.
Об’єм утвореного оксиду дорівнюватиме:
Vок =
![]() , (1.13)
, (1.13)
де Мок - молекулярна маса оксиду; n - число атомів металу в молекулі оксиду; ρок - щільність оксиду.
Співвідношення між об’ємом оксиду і об’ємом металу:
![]() (1.14)
(1.14)
Очевидно, що при Vок / VMе > 1 утворюється суцільна плівка, при Vок / VMе <1 суцільна плівка не утворюється.
Значення зазначеного співвідношення для деяких оксидів металів наведено в табл. 1.1. На підставі даних таблиці можна визначити метали, оксиди яких не утворюють суцільної плівки.
Таблиця 1.1
Співвідношення об’ємів оксиду і вихідного металу
Метал |
Оксид |
Vок / VMе |
Метал |
Оксид |
Vок / VMе |
К |
К2O |
0,45 |
А1 |
А12O3 |
1,28 |
Na |
Nа2O |
0,55 |
Zn |
ZnO |
1,55 |
Li |
Li2O |
0,59 |
Ag |
Ag2O |
1,58 |
Са |
СаО |
0,63 |
Ni |
NiО |
1,65 |
Sr |
SrО |
0,66 |
Сu |
СuО |
1,74 |
Мg |
МgO |
0,79 |
Сг |
Сr2O3 |
2,07 |
Ва |
ВаО |
0,73 |
Fe |
Fе2O3 |
2,14 |
Сd |
СdO |
1,21 |
W |
Wo3 |
3,35 |
Приклад: Метали К, Nа, Li, Са, Sr, Мg, Ва - представники лужних і лужноземельних металів, - мають відношення Vок / VMе <1 - за умовою суцільності вони утворюють рихлі пористі плівки.
Суцільність плівки є необхідною, але недостатньою умовою для прояву захисних властивостей. Реально, коли Vок∙VМе–1 >> 1, може відбуватися таке зростання внутрішніх напружень, яке призводить до спучування і відшарування плівки, що знижує її захисні властивості. Орієнтовно можна вважати, що достатньо хорошими захисними властивостями володіють плівки на металах, що задовольняють умові:
2,5 > Vок / VMе > 1.
Додатковими умовами, що забезпечують захисні властивості плівки, є їх хороша адгезія до металу і фізико-хімічні властивості. Так, наприклад, при окислюванні міді при 500 °С утворюється плівка, яка легко відшаровується від металу. Тому мідь не використовується як жаростійкий матеріал. Поверхнева плівка повинна бути міцною, еластичною і мати близький з основним металом коефіцієнт термічного розширення.
1.8. Кінетика газової корозії металів
Швидкість корозії визначають кількісно, вивчаючи в часі зміну будь-якого показника корозійного процесу. Найбільш часто при вивченні корозії використовують такі показники:
• зміна товщини плівки утворених продуктів корозії (глибинний показник Кn, мм / рік);
• зміна маси зразка металу (масовий показник Кm±, г / (м2∙год.);
• об’єм поглиненого або виділеного в процесі корозії металу газу (об'ємний показник КV, см3 / (см2∙год.).
У процесі вивчення кінетики встановлюють функціональну залежність між вибраним показником процесу і часом:
ПОКАЗНИК = f (τ). (1.15)
Отримане рівняння називають кінетичним. Швидкість газової корозії найчастіше виражають через швидкість росту оксидної плівки:
v =
![]() ,
(1.16)
,
(1.16)
де v - швидкість процесу; h - товщина оксидної плівки; τ - час процесу.
Існує кілька варіантів залежності швидкості росту плівки в часі.
1.8.1. Лінійний закон зростання плівки
Розглянемо випадок, коли плівки не утворюють суцільного і щільного шару (Vок / VMе <1) не є захисними, окислючий газ може вільно проникати через них до поверхні металу і вступати з ним в хімічну реакцію. Схематично такий процес представлений на рис. 1.10.
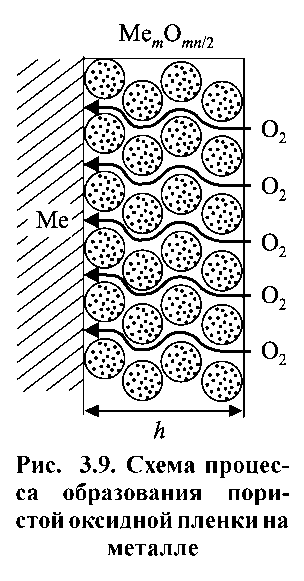
Рисунок 1.10. Схема процесу утворення пористої оксидної плівки на металі.
Швидкість реакції в цьому випадку не залежить від товщини плівки і може бути виражена рівнянням:
= kcC0 , (1.17)
де h - товщина плівки на металі; τ - час корозії металу; kс - константа швидкості хімічної реакції; С0 - концентрація окислювача на поверхні металу.
Після розділення змінних та інтегрування отримаємо:
h = K1τ + Ah , (1.18)
де К1 = kcС0 - величина, постійна для даної концентрації окислювача; Ah - постійна інтегрування, чисельно рівна товщині плівки перед дослідом.
У більшості дослідів значення постійної є близьким до нуля, і тоді рівняння (1.18) приймає вигляд:
h = K1τ. (1.19)
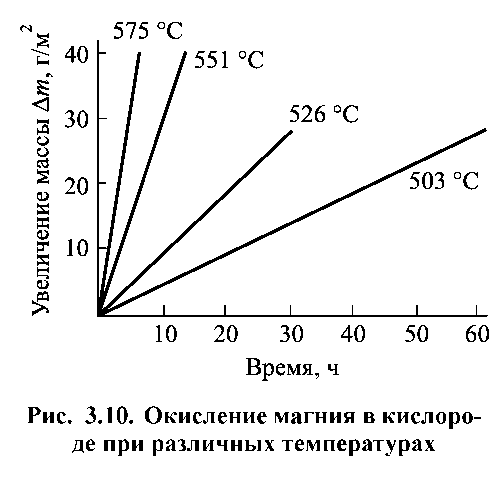
Таким чином, зростання пористої (незахисної) плівки контролюється швидкістю хімічної реакції окислення (кінетичний контроль) і протікає в часі за лінійним законом. Лінійний закон спостерігається при високотемпературному окислюванні на повітрі лужних і лужноземельних металів, а також металів, оксиди яких переходять в газоподібний стан при високих температурах (наприклад вольфрам, молібден). Як приклад на рис. 1.11 наведені експериментальні криві окиснення магнію.
Зростання маси, Δm, г/м3 |
|
Час, год. |
Рисунок 1.11. Окиснення магнію в атмосфері кисню при різних температурах.
1.8.2. Параболічний закон зростання плівок
Параболічний закон окислення металів вперше був встановлений Г. Тамманом для випадку взаємодії срібла з парами йоду. Якщо на поверхні металу утворюється суцільна захисна плівка (Vок / VMе > 1), то процес корозії в часі буде сповільнюватися. На швидкість корозії впливатиме дифузія компоненту через шар плівки і в цьому випадку слід скористатися рівнянням Фіка:
= КД![]() ,
(1.20)
,
(1.20)
де Кд - коефіцієнт дифузії.
Якщо прийняти, що в процесі окислення встановлюється стаціонарний режим дифузії, тобто не відбувається накопичення дифундуючої речовини в будь - якому перетині плівки, то похідну - можна замінити співвідношенням:
=
![]() (1.21)
(1.21)
де С0 - концентрація кисню на зовнішній поверхні плівки на кордоні з повітрям; С1 - концентрація кисню на внутрішній поверхні плівки на границі з металом.
Тоді швидкість корозії на одиницю площі перерізу буде рівною:
= КД . (1.22)
Якщо внутрішня дифузія лімітує швидкість всього процесу, то весь кисень, який досяг металу, встигає вступити в реакцію і С1→0. тоді:
= КД![]() .
(1.23)
.
(1.23)
Після інтегрування отримаємо:
h2 = K2τ (1.24)
В цьому рівнянні:
К2 = 2КД∙С0 (1.25)
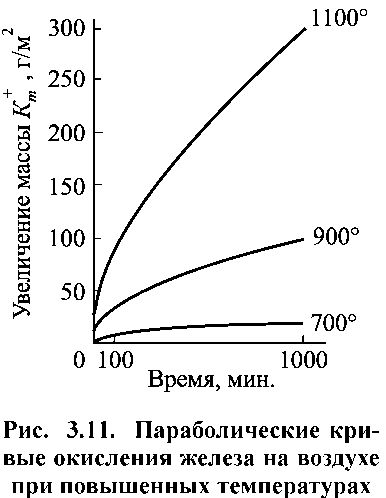
Рівняння (1.24) характеризує параболічний закон зростання плівок. Як приклад на рис. 1.12 наведено експериментальні залежності швидкості окислення заліза при різних температурах.
Параболічний закон зростання оксидної плівки за винятком початкових ділянок, спостерігається при окисленні вольфраму, міді, заліза, нікелю, а також при утворенні галогенних плівок на сріблі.
Зростання маси, Δm, г/м3 |
|
Час, год. |
|
Рисунок 1.12. Параболічні криві окиснення заліза на повітрі при підвищених температурах.
1.8.3. Складні закони зростання плівок
Дифузійно-кінетичний контроль кінетики процесу має місце в тому випадку, коли швидкості дифузії та хімічної реакції окислення порівнянні. Рівняння, яке описує такий процес, носить назву рівняння Еванса і має вигляд:
![]() = С0∙τ .
(1.26)
= С0∙τ .
(1.26)
З введенням прийнятих позначень К1 = kc∙C0 та К2 = 2КД∙С0, маємо:
K1h2 + K2h = K1K2τ . (1.27)
Рівняння відображає складно-параболічний закон зростання плівок. Якщо плівка дуже тонка, що відповідає початковій стадії окислення, то перший член рівняння значно менше другого. Тому можна знехтувати першим членом рівняння, і тоді отримуємо лінійний закон зростання плівки.
Якщо ж товщина плівки велика, то, нехтуючи другим членом рівняння, отримуємо рівняння параболічного закону зростання плівки.
Іноді зростання плівки по товщині відбувається повільніше, ніж це повинно випливати з дифузійного механізму процесу окислення. Згасання процесу корозії в таких випадках пояснюють ущільненням плівки або появою дефектів, які гальмують дифузію. Для ряду металів встановлена логарифмічна залежність швидкості окислення від часу, яка описується рівнянням:
h = ln(kτ) (1.28)
де k - константа.
Логарифмічний закон зростання плівки встановлений експериментально для окислення на повітрі алюмінію та цинку в інтервалі 25 - 225 °С, нікелю до 650 °С, заліза до 375 °С, міді до 100 °С.
Проаналізуємо наведені залежності. Лужні і лужноземельні метали, які мають відношення об’єму оксиду до обсягу металу Vок / VMе менше одиниці, окислюються за лінійним законом. По зменшенню швидкості окислення ці метали розташовують в ряд:
К > Na > Ba > Ca > Mg.
Лінійний хід кінетичної залежності характерний і для металів, оксиди яких леткі при високих температурах. До це групи відносяться метали Мо, Os, Ru, Ir, V, W.
Для ряду технічно важливих металів спостерігається параболічна залежність швидкості окислення в часі. Наближено п зростанню стійкості до газової корозії в атмосфері повітря можна розташувати в ряд такі метали: W < Fе < Co < Сu < Ni. До цієї ж групи належать і Мn, Ве, Zn, Тi.
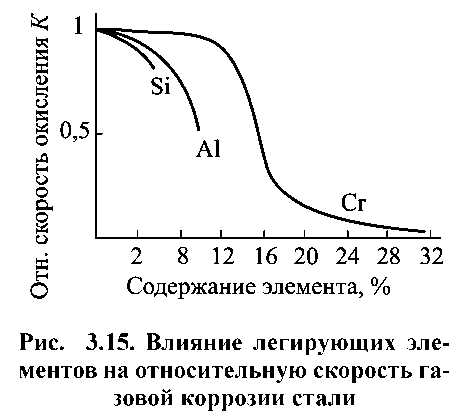
До групи металів, що дають плівки з найбільш високими захисними властивостями і окислюються за логарифмічним законом відностять Si, А1, Сг. Вони розташовані в ряд по зростанню стійкості.
Потрібно відзначити, що окислення деяких металів (Fе, Ni, Сu, А1, Zn, Тi, Та) із зміною зовнішніх умов проходить за різними законами. Можна визначити загальну тенденцію до зниження самогальмування окислення металів із зростанням температури.
1.9. Вплив внутрішніх і зовнішніх факторів на швидкість газової корозії
1.9.1. Вплив складу плівки
Захисні властивості поверхневих плівок залежать від природи і складу сплаву. При високих температурах (вище 800 °С) швидкість окислення сталі зменшується в міру підвищення вмісту в ній вуглецю. Зневуглецювання сталей при цьому також зменшується. Це пов’язано з інтенсифікацією процесу утворення оксиду вуглецю (II) - СО. Сірка, фосфор, нікель і марганець, присутні в сплаві, практично не впливають на високотемпературне окислення заліза, а титан, мідь, кобальт і берилій незначною мірою знижують швидкість газової корозії. Хром, алюміній і кремній сильно уповільнюють окислення заліза через утворення міцних захисних оксидних плівок. Ці елементи широко застосовують для легування сталі з метою підвищення її жаростійкості (рис. 1.13). Хром, введений в сталь у кількості до 30%, значно підвищує її жаростійкість. Алюміній вводять в сталь у кількості до 10%, що ще більше підвищує її жаростійкість.
Відносна швидкість окислення К |
|
Вміст елементу, % |
|
Рисунок 1.13. Вплив легуючих елементів на відносну швидкість газової корозії сталі.
Аналогічною властивістю володіє кремній при введенні його в сталь у кількості до 5%. Однак сталі з високим вмістом алюмінію і кремнію володіють підвищеною крихкістю і твердістю, що ускладнює їх обробку Тому основою жаростійкого легування є система Fе - Сr з додатковим введенням кремнію і алюмінію в кількості до 4-5%. Ванадій, вольфрам і молібден сильно прискорюють окислення сталі при високій температурі. Це обумовлено летючістю і легкоплавкістю утворених ними оксидів.
При високій температурі більш жаростійкою є аустенітна структура сталі. Зі збільшенням змісту фериту жаростійкість двофазних сталей зменшується, а ступінь окислення підвищується. Це пояснюється тим, що на двофазних сталях утворюються плівки з великими внутрішніми напругами, що призводить до їх руйнування.
Деформація металу також сприяє руйнуванню плівки і збільшує швидкість корозії.
1.9.2. Вплив температури
Температура значно впливає на процеси газової корозії. Як було показано раніше, термодинамічна ймовірність здійснення більшості реакцій, які приводять до утворення захисних плівок, з підвищенням температури падає. У той же час зростання температури сприяє збільшенню швидкості реакції. Тому в межах термодинамічної можливості (коли значення енергії Гіббса ΔG0 менше нуля) із збільшенням температури швидкість корозії зростає (рис. 1.14).
Температура впливає на константу швидкості хімічної реакції і на коефіцієнт масопередачі в процесі дифузії. Для обох випадків має місце експоненціальна залежність:
k
= A∙![]() , (1.29)
, (1.29)
де k - константа швидкості хімічної реакції або коефіцієнт дифузії; А – константа, формально рівна k при екстраполяції на 1/Т = 0; Е - енергія активації хімічної реакції або процесу дифузії; R - газова cтала, рівна 8,32 кДж / моль; Т - абсолютна температура.
Якщо прологарифмувати рівняння (1.29), то отримаємо:
lgk
= lgA –
![]() . (1.30)
. (1.30)
Таким чином, температурна залежність у координатах 1/Т - lgk виражається прямою лінією, для якої Е/2,3RT є рівним тангенсу кута нахилу.
При окисленні металів можуть спостерігатися випадки, коли при невисоких температурах процес йде в кінетичної області, тобто лімітується швидкістю хімічної реакції. При підвищенні температури коефіцієнт швидкості хімічної реакції зростає в кілька разів швидше, ніж коефіцієнт дифузії. Це призводить до того, що при певній температурі (для багатьох металів - 800-900 °С) швидкість хімічної реакції зрівнюється із швидкістю дифузії, а потім і перевищує її. Процес починає контролюватися стадією дифузії. На залежності lgk - 1/Т цей ефект буде відзначений зламом, зміною нахилу прямої лінії.
Збільшення маси, Кm+, г/(м3∙год.) |
|
Температура, 0С |
|
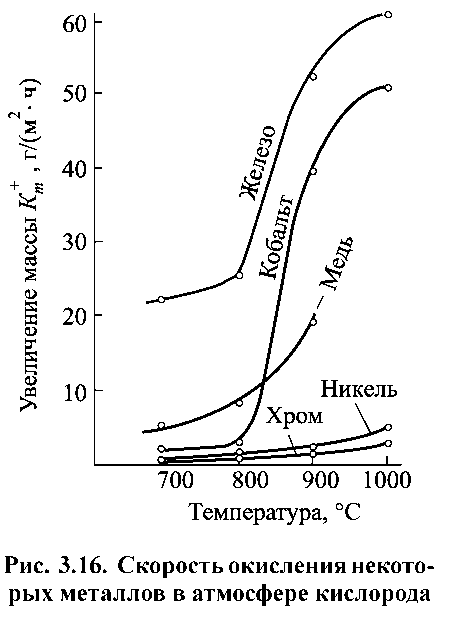
Рисунок 1.14. Швидкість окислення деяких металів ві атмосфері кисню.
Температура може також впливатина склад утворюваних плівок. На рис. 1.15 приведена температурна залежність окислення заліза на повітрі, а в табл. 1.2 - склад утворених плівок.
Таблиця 1.2
Склад оксидних плівок на залізі в залежності віл температури
Температура, °С |
Склад плівки |
Закон зростання |
< 400 |
Fе2O3 |
Логарифмічний |
400-575 |
Fе3O4; Fе2O3 |
Параболічний |
575-730 |
FеО; Fе3O4; Fе2O3 |
Параболічний |
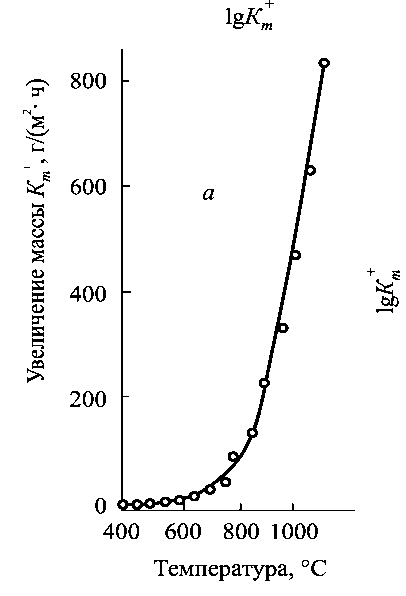
Як показують експериментальні дані (рис. 1.15), в координатах lgКm+ - 1/Т можна відмітити чотири ділянки (обмежені штриховою лінією) зі зміною нахилу. Три нижні ділянки відповідають зміни складу оксидної плівки і кінетичному закону зростання. Верхня ділянка, при температурі понад 800 °С може бути пов'язана зі зміною лімітуючої стадії процесу. Коливання температури при нагріванні металу, поперемінне нагрівання та охолодження, збільшують швидкість окислення металів. У оксидної плівці виникають термічне напруження, утворюються тріщини і вона починає відшаровуватися від металу.
Збільшення маси, Кm+, г/(м3∙год.) |
|
Температура, 0С |
|
Рисунок 1.15. Температурна залежність окислення заліза в координатах lgКm+ - температура.
1.9.3. Вплив тиску і складу газу
Якщо парціальний тиск окислювача нижче тиску дисоціації утвореного з'єднання, то, як було показано раніше, термодинамічно окислення металу припиняється. Якщо окислення металу лімітується хімічною реакцією, то швидкість корозії збільшується пропорційно кореню квадратному від величини тиску кисню. Якщо швидкість реакції визначається процесом дифузії в захисній плівці, то чіткої залежності від тиску газу не спостерігається.
Істотне збільшення швидкості окислення металу з підвищенням вмісту і концентрації кисню в газовому середовищі спостерігається тільки при невисокій концентрації кисню в будь – якій нейтральній атмосфері. Подальше збільшення парціального тиску кисню в газовій суміші не супроводжується пропорційним збільшенням швидкості газової корозії. Наприклад, швидкість окислення заліза і міді при 800-1000 °С в чистому кисні приблизно вдвічі більше, ніж на повітрі, хоча парціальний тиск кисню змінюється в п'ять разів. Швидкість окислення металів в розглянутих випадках контролюється дифузією катіонів у захисній плівці. На лімітуючої стадії парціальний тиск кисню безпосереднього впливу не чинить.
Великий вплив надають домішки. Забруднення повітря СО2, SО2, парами води викликає підвищення швидкості газової корозії низьковуглецевої сталі в 1,3-2,0 рази. При збільшенні вмісту оксиду вуглецю (II) - СО - швидкість окислення сталі знижується. Це явище пов'язують з тим, що при великих концентраціях СО на границі сталь-газ встановлюється рівновага: 2СО ↔ С + СО2. Утворений при цьому атомарний вуглець дифундує в сталь з утворенням карбіду заліза - цементиту. Відбувається коксування сталі. Аналогічний процес при високих температурах може мати місце і в атмосфері вуглеводнів. Наприклад, в середовищі метану встановлюється рівновага:
СН4 ↔ С + 2Н2
а також відмічається коксування сталі.
В процесі горіння палива можливим є утворення оксиду ванадію. Зола з V2O5 попадає на поверхню сталевих деталей і сприяє підвищенню швидкості окисленню сталі. Це явище отримало назву ванадієвої корозії. Причина ванадієвої корозії заключається в легкоплавкості оксиду ванадію та його здатності розчиняти залізо і оксидні плівки з утворенням з’єднань ванадію:
Fe2O3 + V2O5 = 2FeVO4
4Fe + 3V2O5 = 2Fe2O3 + 3V2O3
Утворені FeVO4 і V2O3 беруть участь у наступних реакціях:
V2O3 + O2 = V2O5
6FeVO4 + 4Fe = 5 Fe2O3 + 3 V2O3
Аналогічним чином оксид п’ятивалентного ванадію реагує з оксидами нікелю і хрому. При цьому захисна плівка руйнується, в ній утворюються пори і швидкість корозії металу збільшується.
В техніці апаратура, виготовлена із сталі і чавуну, часто піддається впливу температури та інших газів: СО2, SО2, парів води. Проведені дослідження показали, що при 900 °С швидкість окислення заліза змінюється в ряду:
Н2О > СО2 > О2 > SO2
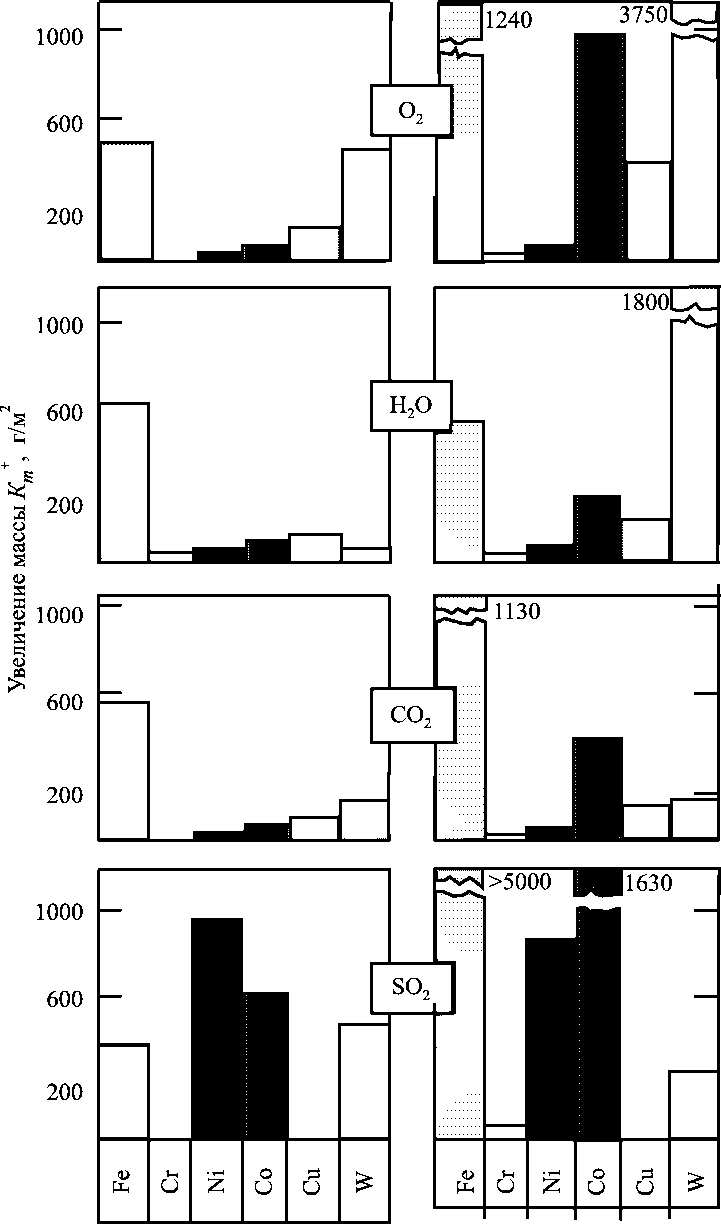
Вплив складу газового середовища на прикладі О2, Н2О, СО2 і SО2 і температури на корозію окремих металів показано на рис. 1.16.
Залізо виявляє досить високу корозію у всіх досліджених газових середовищах, що значно зростає в інтервалі 700-900 °С.
Хром має високу жаростійкість у всіх чотирьох атмосферах.
Нікель відносно стійкий в середовищі О2, Н2О і СО2, але сильно кородує в атмосфері SО2.
Кобальт найбільшу швидкість корозії має в середовищі SО2, що значно зростає при переході від температури 700 °С до 900 °С.
Мідь найбільш швидко кородує в атмосфері кисню, але стійка в середовищі SО2.
Прийнято вважати, що відмінності в швидкості корозії металів в різних газах значною мірою визначаються захисними властивостями утворених на металі плівок продуктів корозії.
1.10. Теорії жаростійкого легування
В багатьох хімічних процесах металеві конструкції і вироби експлуатуються в жорстких умовах, при підвищених температурах, великих тисках, високій агресивності середовища. Чисті метали, як правило, не є корозійностійкими і вимагають додаткових заходів захисту. Сучасна техніка протикорозійного захисту має ряд ефективних способів для збільшення стійкості металів і терміну їх експлуатації. Щодо умов газової корозії одним з найбільш часто використовуваних способів є жаростійке легування з метою одержання сплавів, що володіють підвищеною корозійною стійкістю.
В даний час існує три найбільш обґрунтовані теорії жаростійкого легування, які не суперечать, а швидше доповнюють одна одну.
Відповідно до першої теорії, розробленої Вагнером і Хауффе, невелика добавка легуючого елемента окислюється і, розчиняючись в оксиді основного металу, зменшує число дефектів у кристалічній решітці основного металу. Це призводить до впорядкування структури і знижує швидкість дифузії іонів в захисній плівці. Дана теорія має досить обмежену сферу застосування. Якщо швидкість окислення металу визначається не дифузією іонів або при легуванні в оксидній плівці утворюється нова фаза, то зазначені вище припущення теорії жаростійкого легування незастосовні.
Згідно другої теорії, розробленої А.А. Смирновим, Н.Д. Томашовим і ін., на поверхні металу утворюється захисний оксид легуючого елемента, який перешкоджає окисленню основного металу. Стосовно до цієї теорії легуючий компонент повинен володіти перерахованими основними властивостями:
Збільшення маси, Кm+, г/(м3∙год.) |
|
700 0С 900 0С |
|
Рисунок 1.15. Швидкість газової корозії деяких металів в атмосферах О2, Н2О, СО2 та SO2 за 24 години при 700 і 900 0С.
1. Оксид легуючого елемента повинен задовольняти умові суцільності, тобто відношення об’ємів оксиду і металу має бути більше одиниці: Vок / VMе > 1. У табл. 1.3 наведені узагальнені дані по деяких властивостях оксидів хрому, алюмінію і кремнію. Ці елементи є основними добавками для підвищення жаростійкості заліза. Як показують дані таблиці ця умова для вищеназваних елементів виконується.
2. Легуючий елемент повинен утворювати оксид з високим електричним опором. Великий омічний опір (низька електропровідність) є однією з основних умов для формування захисних властивостей плівки, тому що при цьому рух іонів у шарі оксиду ускладнюється.
3. Енергія утворення оксиду легуючого елемента повинна бути більше енергії утворення оксиду основного металу.
Ця умова забезпечує стійкість оксиду легуючого компонента в присутності основного металу. Оксид компонента добавки виявляється більш стійким, ніж оксид основного металу. Якщо ця умова не дотримується, то оксид легуючого елемента буде відновлюватися основним металом.
Наведені в таблиці 1.3 дані по теплотам утворення оксидів заліза, Аl2O3, Сг2О3 і SiO2 підтверджують сформульоване вище правило. Більше того, якщо спочатку утворюється змішаний оксид, то надалі відповідно до умов термодинамічної рівноваги, він переходить у чистий оксид легуючого компонента.
Наприклад, при окисленні заліза легованого алюмінієм, має місце утворення оксиду заліза FeО. Але далі можливий процес:
3FeO + 2Al = Al2O3 + 3Fe/
4. Розмір іонів легуючого елемента повинен бути менше за розмір іона основної металу (див. табл. 1.3). Це полегшує дифузію легуючого елемента до поверхні сплаву, на якому утворюється захисна плівка.
Таблиця 1.3
Деякі властивості оксидів елементів, що підвищують жаростійкість заліза
Властивості |
Оксид |
||||
FеО |
Fе2O3 |
А12O3 |
Сг2O3 |
SiO2 |
|
Відношення Vок / VMе |
- |
2,14 |
1,28 |
2,07 |
1,9 |
Електропровідність, Ом–1∙см–1 при 1000 °С (порядок значения) |
102 |
- |
10–7 |
10–1 |
10–6 |
Іонний
радіус |
0,75 |
- |
0,54 |
0,6 |
0,41 |
Теплоти утворення: кДж/моль кДж/атом |
269,2 269,2 |
801.8 400,9 |
1674,7 837,4 |
1122,0 561,0 |
818,2 818,2 |
5. Оксиди легуючих компонентів повинні мати високі температури плавлення і сублімації та не утворювати низькоплавкої евтектики. Ця вимога забезпечує збереження оксиду при високих температурах у твердій фазі. Перехід оксиду в рідкий стан полегшив би протікання в ньому дифузійних процесів. Часткова сублімація оксиду збільшила б пористість плівки, що сприяє зниженню її захисних властивостей.
6. Легуючий компонент і основний метал повинні утворювати твердий розчин при даному складі сплаву. Тільки за цієї умови вдається забезпечити суцільну плівку оксиду легуючого компоненту по всій поверхні сплаву.
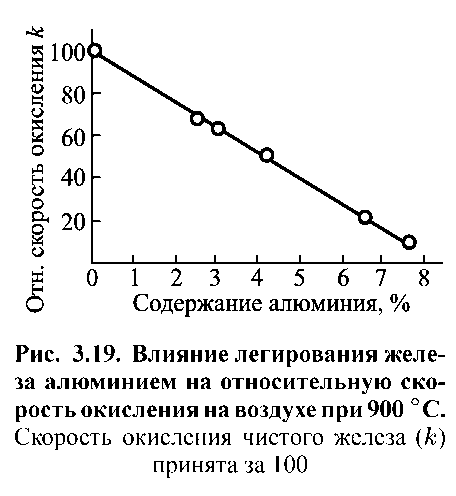
Ця теорія жаростійкого легування знаходиться в хорошій злагоді з цілим рядом практичних даних. Експериментально було встановлено наявність захисного шару оксиду, переважно утвореного легуючим компонентом сплаву (хрому або алюмінію) для ряду жаростійких залізних сплавів. На рис. 1.16 показано значне зниження швидкості окислення заліза від концентрації легуючої добавки - алюмінію.
Відносна швидкість окислення k |
|
Вміст алюмінію, % |
|
Рисунок 1.16. Вплив легування заліза алюмінієм на відносну швидкість окислення на повітрі при 900 0С (швидкість окислення чистого заліза (k) прийнята за 100%).