
- •23.. Теорема Нернста
- •25.Фазовое равновесие
- •26.Условие равновесия фаз химически однородного вещества
- •17.Термод. Смысл химического потенциала
- •18. Общие критерии термод устойчивости. Принцип Ле-Шателье-Брауна.
- •19. Молекулярные силы и отступления от законов идеальных газов
- •20. Уравнение Ван-Дер-Ваальса
- •28. Фазовые переходы первого и второго рода
- •16.Соотношения Максвелла
25.Фазовое равновесие
Важнейшим вопросом в учении о фазах является выяснение условий, при которых система, состоящая из двух или нескольких фаз, находится в равновесии. Последнее включает в себя механическое и тепловое равновесия. Для теплового равновесия необходимо, чтобы все фазы системы имели одну и ту же температуру. Необходимым условием механического равновесия является равенство давлений по разные стороны границы раздела соприкасающихся фаз. Впрочем, последнее условие строго справедливо только в случае плоских границ раздела. В случае границ оно нарушается действием сил поверхностного натяжения. Так, на поверхности раздела жидкости и ее пара при равновесии существует разность давлений Р2 — Р\ = сгК, где К= 1/Ri + 1/R2 — средняя кривизна этой поверхности
Равенство давлений и температур еще не означает, что система находится в равновесии, так как соприкасающиеся фазы могут превращаться друг в друга. Такие превращения называются фазовыми превращениями. При фазовых превращениях одни фазы растут другие уменьшаются и даже могут совсем исчезнуть. Состояние равновесия характеризуется тем, что массы всех фаз системы остаются неизменными. Следовательно, должно быть выполнено еще одно необходимое условие равновесия — равновесие по отношению к взаимным превращениям фаз. Это основное условие в учении о равновесии фаз и фазовых превращениях.
Насы́щенный пар — это пар, находящийся в термодинамическом равновесии с жидкостью или твёрдым телом того же состава. Давление насыщенного пара связано определённой для данного вещества зависимостью от температуры. Когда внешнее давление падает ниже давления насыщенного пара, происходит кипение (жидкости) или возгонка (твёрдого тела); когда оно выше — напротив, конденсация или десублимация.
26.Условие равновесия фаз химически однородного вещества
1. Условие равновесия фаз можно получить из теорем термодинамики. При равновесии системы температуры и давления всех ее фаз одинаковы. Если их поддерживать постоянными, то тер-модинамический потенциал системы может только убывать. При равновесии он принимает минимальное значение. Рассмотрим систему, состоящую из двух фаз 1 и 2, которые могут превращаться друг в друга. Пусть m1 — масса первой, а m2 — масса второй фазы. Обозначим через φ1 и φ2 удельные термодинамические потенциалы вещества в этих фазах. Термодинамический потенциал всей системы представится в виде Ф = φ1m1+ φ2m2 - Пусть давление и температура системы поддерживаются постоянными. Тогда при фазовых превращениях величины φ1 и φ2 не будут изменяться, так как они являются однозначными функциями только температуры и давления. Не будет, разумеется, изменяться и полная масса вещества m = m1 + m2- Могут изменяться только массы m1 и m2- И эти изменения должны происходить в таком направлении, чтобы термодинамический потенциал Ф принял наименьшее значение, возможное в рассматриваемых условиях. Если φ1 > φ2 то всякое превращение фазы 1 в фазу 2 сопровождается уменьшением Ф. Это превращение и будет происходить, пока вся фаза 1 не перейдет в более устойчивую фазу 2. Тогда система сделается однофазной, а ее термодинамический потенциал достигнет минимального значение φ2- Наоборот, если <Pi < ^2; то фаза 2 в конце концов превратится в фазу I. Только при условии V^T) = <р2{Р,Т) A12.1) фазы будут находиться в равновесии друг с другом. Таким образом, условием равновесия фаз является равенство их удельных термодинамических потенциалов. Внутренняя энергия U и энтропия S тела определены с точностью до произвольных аддитивных постоянных. Поэтому термодинамический потенциал Ф = U - TS + PV и его удельное значение ср(Р,Т) определены с точностью до произвольной линейной функции температуры. Возникающая благодаря этому неоднозначность должна быть исключена из условия A12.1). Для этого достаточно условиться определять удельные термодинамические потенциалы (φ1(Р, Т) и (φ2(Р, T) путем интегрирования выражения: dφ = — sdT + vdP исходя из одного и того же состояния. Смысл условия A12.1) состоит в том, что при любых фазовых превращениях величина удельного термодинамического потенциала всегда изменяется непрерывно. В этом отношении он отличается от других физических величин — удельного объема, удельной энтропии и теплоемкости, диэлектрической и магнитной проницаемостей, электрической проводимости и пр., которые при фазовых превращениях, как правило, меняются скачкообразно.
2.
Применим условие A12.1) к процессам
превращения жидкости в пар и обратно.
Возьмем какую-либо изотерму вещества,
подчиня- ющегося уравнению Ван-дер-Ваальса,
при температуре ниже крити- ческой
(рис. 133 а). Жирные ветви изотермы EG и LD
изображают

Рис.
устойчивые состояния вещества: газообразное и жидкое. Участок GA соответствует перенасыщенному пару, участок LB — перегретой жидкости. Они изображены тонкими сплошными линиями. Штриховой линией представлена ветвь АС В, точки которой изображают абсолютно неустойчивые состояния вещества. Жирный горизонтальный участок LCG представляет изотерму вещества в двухфазном состоянии.. То же самое, и притом более полно, можно сделать с помощью условия A12.1). Когда точка, изображающая состояние вещества, перемещается вдоль изотермы, то ввиду постоянства температуры (dT = 0) для изменения удельного термодинамического потенциала можно написать
![]() Поскольку
независимой переменной теперь является
i3, удобнее повернуть координатные оси
так, чтобы ось давлений стала
горизонтальной, а ось объемов —
вертикальной (рис. б). Исследуем изменение
функции (р(Р, Т) при перемещении
изображающей точки вдоль теоретической
изотермы EACBD (рис. а). На участке ЕА
дифференциал dP положителен, а потому
потенциал φ возрастает. На участке АС
В dP меняет знак, а (р начинает убывать.
При дальнейшем изменении состояния
вещества вдоль изотермы BD потенциал
(р снова начинает монотонно возрастать.
Величина ср будет проходить через те
же значения, которые она принимала
раньше на ветви АЕ. Отсюда следует, что
существует такая изобара GL, в точках
которой L и G значения удельного
термодинамического потенциала φ
одинаковы:
Поскольку
независимой переменной теперь является
i3, удобнее повернуть координатные оси
так, чтобы ось давлений стала
горизонтальной, а ось объемов —
вертикальной (рис. б). Исследуем изменение
функции (р(Р, Т) при перемещении
изображающей точки вдоль теоретической
изотермы EACBD (рис. а). На участке ЕА
дифференциал dP положителен, а потому
потенциал φ возрастает. На участке АС
В dP меняет знак, а (р начинает убывать.
При дальнейшем изменении состояния
вещества вдоль изотермы BD потенциал
(р снова начинает монотонно возрастать.
Величина ср будет проходить через те
же значения, которые она принимала
раньше на ветви АЕ. Отсюда следует, что
существует такая изобара GL, в точках
которой L и G значения удельного
термодинамического потенциала φ
одинаковы:
![]()
Следовательно, 
Это
значит, что площади GACG и CBLC, заштрихованные
на рис., одинаковы. Проведем далее
изобары МN и QR левее и правее изобары
GL. Тогда
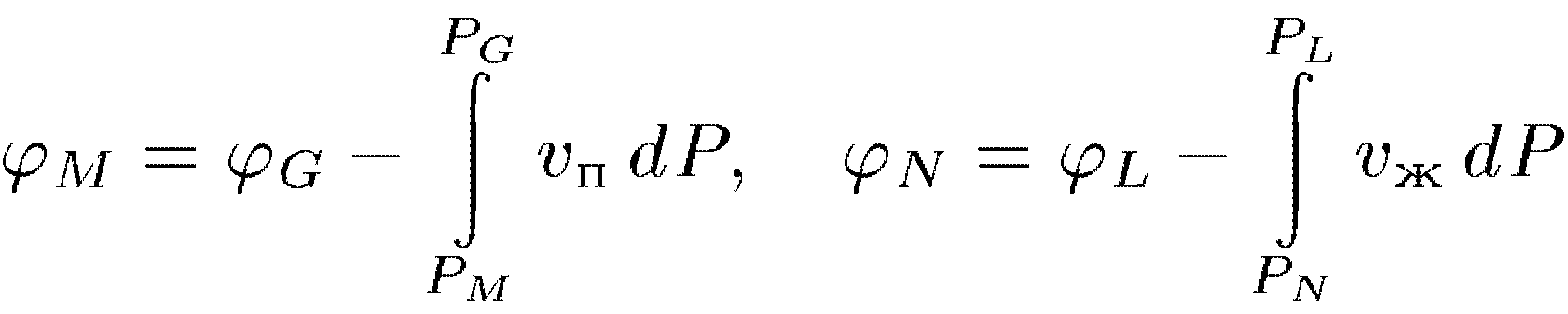
где
Vп
— удельный объем пара,Vж
- жидкости. Так как
![]() ,
а пределы интегрирования одни и те лее,
то
,
а пределы интегрирования одни и те лее,
то
![]() -
Так
-
Так
же
доказывается, что
![]() .
.
Итак, удельный термодинамический потенциал газа на ветви изотермы EG меньше соответствующего удельного термодинамическо- го потенциала жидкости на ветви BL. Поэтому из двух возможных состояний М и N, в которых вещество может существовать при заданных температуре и давлении, газообразное состояние М является более устойчивым. Оно и реализуется в действительности. Наоборот, на ветви LD жидкость имеет меньший удельный термодинамический потенциал, чем газ на участке изотермы GA. Из двух возможных состояний вещества R и Q, в которых давления и температуры одинаковы, жидкое состояние R здесь более устойчиво, чем газообразное Q. Если жидкость и газ в таких состояниях граничат между собой, то газ будет конденсироваться в жидкость, пока все вещество не окажется в жидком состоянии. В точках G и L удельные термодинамические потенциалы газа и жидкости одинаковы. Поэтому состояния G и L одинаково устойчивы. Газ в состоянии G и жидкость в состоянии L находятся в фазовом равновесии друг с другом. Такой газ является насыщенным паром этой жидкости.
