
ИХТ / ХТОСА / Технология энергоемких материалов(Юдин) / Еще некоторые материалы / УВ из нефти и кокса
.pdf
мусороперерабатывающие заводы способны добывать такое ценное сырье как синтез газ в процессе утилизации отходов.
3.5. Применение синтез-газа и СО.
Сегодня синтез-газ используется в химической промышленности для получения метанола, в оксосинтезе, и для производства синтетического жидкого топлива. Кроме этого, он также используется в качестве экологически чистого источника тепла и энергии.
3.5.1. Гидроформилирование.
Процессы гидроформилирования (оксосинтез) — реакции образования альдегидов взаимодействием ненасыщенных соединений с СО и Н2 в присутствии катализатора:
RCH |
|
CH |
2 |
RCH2CH2CHO + RCHCH3 |
|
||||
|
||||
|
|
|
|
CHO
Вкачестве растворителей обычно используют алифатические, циклоалифатические и ароматические углеводороды, а также простые эфиры. Катализаторами служат карбонилы некоторых металлов VIII группы Периодической системы (главным образом Со и Rh), активность которых растет в ряду: Fe <Os < Ru <Ir< Co < Rh. Кобальт можно использовать также в виде металла, гидроксида или соли органической или неорганической к-ты. В реакционной среде карбонилы металлов образуют гидридокарбонилы (например, [НСо(СО)4]), непосредственно участвующие в реакции.
Взависимости от природы реагентов и катализаторов оптимальные температура и давление колеблются в пределах соответственно 100-180 °С
и2-30 МПа. С повышением парциального давления СО скорость реакции проходит через максимум.
Использование при гидроформилировании добавок триалкил(арил)фосфинов или триалкил(арил)фосфитов позволяет снизить давление и увеличить выход неразветвленных альдегидов. При этом в реакции генерируются карбонилфосфиновые комплексные катализаторы,
63
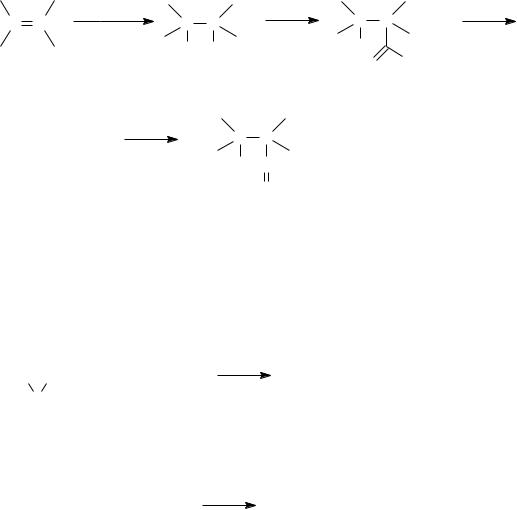
напр. [HCo(CO)3PR3], [HRh(CO)2(PAr3)2], которые термостабильнее и обладают более низкой кислотностью, чем гидридокарбонилы металлов.
В случае гидроформилирования диенов на кобальтовых катализаторах гидрируется одна двойная связь и образуется моноальдегид, при использовании родиевых катализаторов образуется диальдегид.
Механизм гидроформилирования включает стадии образования алкилметалл-карбонила (формула I) и ацилметаллкарбонила (II), например:
|
HCo(CO)4 |
CO |
|
H2 |
C C |
C |
C |
C |
C |
|
H |
Co(CO)4 |
H |
Co(CO)4 |
|
|
I |
O |
|
|
|
|
|
|
|
|
|
|
II |
C C
HCH O
Идут также и побочные реакции - восстановление альдегидов до спиртов, образование ацеталей и кетонов, полимеризация и другие. Некоторые из них, например, восстановление альдегидов до спиртов, используют в промышленности.
В реакцию, подобную гидроформилированию, вступают эпоксиды и карбонильные соединения, например:
H2C |
|
CH2 + CO + H2 |
|
CH2CH2CHO |
|
||||
|
|
|||
|
O |
OH |
||
а также насыщенные спирты с образованием спиртов или альдегидов, содержащих на одну группу СН2 больше, чем в исходном соединении:
C H OH + |
CO + H |
C3H7OH |
|
2 |
5 |
2 |
|
Гидроформилирование используют в промышленности для получения альдегидов, из которых синтезируют главным образом спирты и карбоновые кислоты. Так, из этилена получают пропионовую к-ту, из пропилена - бутанол, из олефинов, содержащих в молекуле 6-20 атомов углерода (они образуются при крекинге парафинов), - спирты, используемые для синтеза ПАВ. Разработаны также способы
64

гидроформилирования акрилонитрила с последующим получением из образующегося альдегида β-аминопропионовой кислоты:
CH2 CHCN + CO + H2
CHCN + CO + H2  OHCH2C CH2CN
OHCH2C CH2CN
1 O2
2 H2
H2NCH2CH2COOH
3.5.2. Реакции карбонилирования.
Карбонилирование - присоединение оксида углерода к молекуле органического соединения в присутствии катализатора. В реакцию с СО обычно вводят ненасыщенные соединения (ацетилены, олефины или их производные) и нуклеофилы, содержащие подвижный атом водорода (вода, спирты, аммиак, меркаптаны и др.). Процесс, как правило, осуществляют в жидкой фазе в среде спирта, карбоновой к-ты, эфира, пиридина при 80-300 °С и 5-30 МПа. Катализатор - чаще всего соли, карбонилы или другие комплексные соединения Со, Ni, Rh и Pd.
Взаимодействие органических веществ (главным образом ненасыщенных) с СО и Н2О называется гидрокарбонилированием. По этой реакции из олефинов образуются карбоновые кислоты (1), а при использовании в качестве катализатора комплексов Fe(CO)5 с основаниями - спирты, из диенов - дикарбоновые кислоты (2), из ацетиленов –α,β- ненасыщенные карбоновые кислоты (3), из формальдегида - гликолевая к- та (4), из ацетальдегида - молочная (5):
RCH |
|
|
CH |
+ |
CO |
+ |
H2O |
RCH2CH2COOH |
(1) |
||||||
|
|
||||||||||||||
|
|
|
|||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
CH |
CH |
CH2 |
+ |
CO + |
H2O |
HOOC(CH2)4COOH |
(2) |
||||||||
CH2 |
|
|
|
|
|
|
|
|
|
|
|||||
RC |
|
|
|
CH |
+ |
CO |
+ |
H2O |
RCH |
|
CHCOOH |
(3) |
|||
|
|
|
|
||||||||||||
|
|
|
|
||||||||||||
|
|
HOCH2COOH |
(4) |
||||||||||||
|
|
|
|||||||||||||
CH O |
+ |
CO |
+ |
H2O |
|
||||||||||
|
|
||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH CHO |
+ |
CO |
+ |
H2O |
|
CH CHCOOH |
(5) |
||||||||
3 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|||
При реакции олефинов с СО и спиртами образуются сложные эфиры (6), с нитросоединениями - карбаматы (7):
65

RCH |
|
CH |
+ CO |
+ R OH |
RCH2CH2COOR1 |
|
(6) |
|
|
|
|||||||
|
|
|||||||
2 |
|
1 |
|
|
|
|
||
|
RNO |
+ 3CO |
+ R OH |
RNHCOOR |
+ |
2CO2 |
(7) |
|
2 |
|
1 |
|
1 |
|
|
||
Кважным реакциям, включающим взаимодействие субстрата только
сСО, относятся карбонилирование нитросоединений, в результате которого образуются изоцианаты (8), реакция СО с метанолом с образованием в зависимости от используемого катализатора и условий процесса уксусной кислоты(9) или метилформиата (10) и карбонилирование метилацетата, приводящее к уксусному ангидриду (11):
RNO |
+ |
3CO |
|
|
|
|
RNCO + 2CO2 |
(8) |
|
2 |
|
|
|
|
|
|
|
|
|
CH3OH |
+ |
CO |
Co(CO)4 |
+ CoJ2 |
CH3COOH |
(9) |
|||
|
|
|
|
||||||
250 |
оС, 63,7 МПа |
||||||||
|
|
|
|
|
|||||
CH OH |
+ |
CO |
|
NaOH |
HCOOCH3 |
(10) |
|||
|
|
|
|
||||||
3 |
|
|
|
|
|
|
|
|
|
CH3COOCH3 |
+ CO |
|
|
|
(CH3CO)2 |
(11) |
|||
Взаимодействие олефина с СО и О2 (так называемое окислительное карбонилирование) осуществляется с образованием ненасыщенных кислот:
RCH=CH2 + СО + 1/2O2 → RCH = CHCOOH
Механизм карбонилирования в присутствии кобальтовых катализаторов часто такой же, как при гидроформилировании. В случае использования соединений рения на промежуточной стадии образуется комплекс катализатора с СО.
Карбонилирование широко применяют в промышленности, главным образом для получения с высокими выходами (до 99%) уксусной кислоты из метанола с использованием родиевых или кобальтовых катализаторов, а также спиртов из олефинов на катализаторе на основе карбонила железа.
Перспективно получение уксусного ангидрида из метанола и пропионовой кислоты из этилена с применением соответственно родиевых и палладиевых катализаторов.
66
4. ВОДОРОД, ПРОИЗВОДСТВО И СИНТЕЗЫ НА ЕГО ОСНОВЕ
Водород — бесцветный газ, не имеющий запаха. При температуре ниже -240 °C (критическая температура водорода) он под давлением сжижается; температура кипения жидкого водорода -252,8 °C (при нормальном атмосферном давлении). Если быстро испарять эту жидкость, то получается твердый водород в виде прозрачных кристаллов, плавящихся при -259,2 °C.
Водород — самый легкий из всех газов, он в 14,5 раза легче воздуха; масса 1 л водорода при нормальных условиях равна 0,09 г. В воде водород растворим очень мало, но в некоторых металлах, например, в никеле, палладии, платине растворяется в значительных количествах.
4.1. Методы получения водорода
В промышленности водород получают главным образом из природного газа. Этот газ, состоящий в основном из метана, смешивают с водяным паром и с кислородом. При нагревании смеси газов до 800-900 °C в присутствии катализатора происходит реакция, которую схематически можно изобразить уравнением:
2CH4 + O2 + 2H2O → 2CO2 + 6H2
Наряду с парокислородной конверсией метана получил широкое распространение и способ парокислородной газификации тяжёлых нефтяных остатков (мазута). При этом первоначально происходит частичное сгорание углеводородов до СО и СО2, а далее происходит их конверсия водяным паром.
Разделение СО2 и Н2 осуществляется с помощью растворов карбонатов (сода, поташ) или этаноламинами.
Другой метод - метод «водяного газа» дает значительную часть общего производства водорода. Его сущность заключается в реакции паров воды с коксом с образованием смеси CO и H2. Реакция эндотермична (ΔH = 121,8 кДж/моль), и ее проводят при 1000° С. Нагретый кокс обрабатывают паром; выделяющаяся очищенная газовая смесь содержит некоторое количество водорода, большой процент CO и небольшую примесь CO2. Для повышения выхода H2 монооксид CO удаляют
67
дальнейшей паровой обработкой при 370 °C; при этом он конвертируется в СО2. В настоящий момент в ИПХФ РАН в Черноголовке разрабатывается технология газификация угля в сверхадиабатическом режиме. Эта технология позволяет переводить уголь в синтез-газа с КПД 98%.
Большое количество водорода получается в процессах каталитического риформинга. Технический водород содержит от 65 до 95% собственно водорода и может непосредственно использоваться для очистки нефтяных фракций от сернистых соединений.
Водород как побочный продукт получается при частичном окислении и термическом крекинге углеводородов в процессе производства сажи:
CnH2n+ 2  nC + (n+1) H2
nC + (n+1) H2
Не потерял своего значения и способ получения водорода путём электролиза, по которому, несмотря на большие энергозатраты, водород получается с содержанимем 99,5-99,9 %.
Для получения сверхчистого водорода используются мембранная технология.
4.2. Синтезы на основе водорода
Почти половина (45-47 %) мирового производства водорода идет на получение аммиака. Следующим по объёму «потребителем» водорода является гидрокрекинг и гидроочистка (35-37 %).
Здесь мы не будем касаться процессов с использованием синтез-газа, так как они рассмотрены ранее (раздел 3), но заметим, что в этих процессах так же участвует водород.
В промышленности органического синтеза гидрированию подвергаются самые разные классы соединений, в частности:
арены:
68
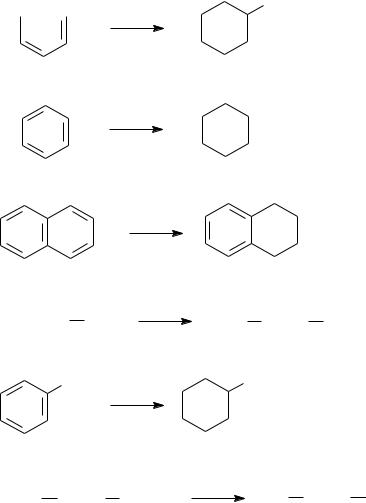

 OH H2, Ni
OH H2, Ni
H2, Ni
H2, Ni
нитрилы:
NC-(CH2)4- CN H2, Co
нитросоединения:
NO2 H2, Cu
сложные эфиры:
ROOC (CH2)4- COOR
OH
H2N (CH2)6 NH2
NH2
H2
HO (CH2)6 OH
69
5. АЦЕТИЛЕН, ЕГО СВОЙСТВА, ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ
5.1. Свойства ацетилена
Ацетилен представляет собой углеводород ряда алкинов, общая формула которых: СnН2n-2. Его химическая формула С2Н2, структурная формула: НС≡СН.
При атмосферном давлении и нормальной температуре ацетилен - бесцветный газ. Технический ацетилен вследствие присутствия в нем примесей, на пример фосфористого водорода и сероводорода, имеет резкий специфический запах. При 20°С и 760 мм рт. ст. плотность ацетилена ρ = 1,091 кг/м3.
При атмосферном давлении ацетилен сжижается при температуре - 82,4...-83,6°С. При температуре -85°С и ниже ацетилен переходит в твердое состояние, образуя кристаллы плотностью 0,76 кг/м3. Жидкий и твердый ацетилен легко взрывается от трения, механического или гидравлического удара и действия детонатора.
Полное сгорание ацетилена происходит по реакции С2Н2+2,5О2 = 2СО2+Н2О+Q (1)
Из уравнения реакции (1) следует, что для полного сгорания одного объема ацетилена требуется 2,5 объема кислорода. Высшая теплотворная способность ацетилена при 0°С и 760 мм рт. ст. равна Qв=58 660
кДж/м3 (14 000 ккал/м3), низшая теплотворная способность при тех же условиях может быть принята Qн=55 890 кДж/м3 (13 500 ккал/м3).
Экзотермический распад ацетилена происходит по реакции: С2Н2 → 2С+Н2 - Hо298 = 225, 8 кДж/моль.
Ацетилен широко используют в химической промышленности в качестве основного исходного вещества для получения ряда важнейших продуктов органического синтеза: синтетического каучука, пластмасс, растворителей, уксусной кислоты и многих других.
Ацетилен - универсальное и самое распространенное горючее, используемое в процессах газопламенной обработки. При сгорании с кислородом он дает пламя с наиболее высокой температурой, равной 3150°С. Достигнуть столь высокой температуры пламени при использовании других горючих газов не удается.
70
При использовании ацетилена необходимо учитывать его взрывные свойства, для того чтобы обеспечить полную безопасность работ. Следует всегда иметь в виду, что ацетилен (как и водород) относится к наиболее взрывоопасным газам. Температура самовоспламенения ацетилена находится в пределах 240-630°С и зависит от давления и присутствия в нем различных веществ.
Повышение давления существенно снижает температуру самовоспламенения ацетилена. Присутствие в ацетилене твёрдых частиц увеличивает поверхность контакта и тем понижает температуру самовоспламенения. Практически в зависимости от давления допустимо нагревание ацетилена до следующих температур: при абсолютном давлении 0,1 МПа (1 кгс/см2) - до 300°С, при абсолютном давлении 0,25 МПа (2,5 кгс/см2) - до 150-180°С, при более высоких давлениях - до
100°С.
Один из важных показателей взрывоопасности горючих газов и паров - величина энергии зажигания. Ацетилен имеет наименьшую энергию зажигания и в отношении взрывоопасности подобен водороду.
5.2. Хранение и транспортировка ацетилена
Хранение и транспортировка ацетилена осуществляются под давлением в баллонах, заполненных специальной пористой массой, пропитанной ацетоном - хорошим растворителем ацетилена, что позволяет существенно увеличить количество ацетилена, накачиваемого в баллон. Кроме того, ацетон снижает взрывоопасность ацетилена. Ацетон удерживается в порах массы и распределяется по всему объему баллона, это увеличивает поверхность его контакта с ацетиленом при растворении и выделении из раствора. Ацетилен, отпускаемый потребителям в баллонах, называется растворенным ацетиленом (ГОСТ 5457-60). Максимальное давление ацетилена при заполнении баллона составляет 2,5 МПа (25 кгс/см2), при отстое и охлаждении баллона до 20°С оно снижается до 1,9 МПа (19 кгс/см2). При этом давлении в 40-литровый баллон вмещается 5- 5,8 кг ацетилена по массе (4,6-5,3 м3 газа при 20 °С и 760 мм рт. ст.).
При абсолютном давлении 0,1 МПа (1 кгс/см2) и 20°С в 1 кг ацетона растворяется 27,9 кг ацетилена или в 1 л ацетона растворяется 20 л
71
ацетилена. Растворимость ацетилена возрастает в ацетоне примерно прямо пропорционально давлению. С понижением температуры растворимость ацетилена в ацетоне растет.
В качестве пористых масс применяют такие высокопористые вещества, как: инфузорную землю, (кизельгур, диатомит), пемзу, асбест, древесный и активированный уголь, силикат кальция, углекислый магний и другие похожие вещества.
5.3. Методы получения ацетилена 5.3.1. Производство ацетилена из карбида кальция
Один из основных способов получения ацетилена основан на реакции взаимодействия карбида кальция с водой. Карбид кальция СаС2 - твердое вещество кристаллического строения, имеющее в изломе темно-серый или коричневый цвет. Плотность химически чистого СаС2 при температуре 18 °С равна 2,22 г/см3.
Реакция образования карбида кальция из окиси кальция и углерода является эндотермической и протекает при температуре 1900-2300°С по уравнению:
CaO+3C → CaC2+CO - Hо298 = -452,5 кДж/моль (108 ккал/моль)
Для получения 1 кг СаС2 теоретически требуется затратить 7060 кДж теплоты или более 3000 кВт/час электроэнергии.
Технический карбид кальция содержит 70—75% химически чистого СаС2, 1.7—24% СаО и различные примеси: окислы магния, алюминия, железа, соединения серы, фосфора, ферросилиций, углерод и др. Карбид кальция чрезвычайно активно вступает во взаимодействие с водой, разлагаясь при этом с образованием газообразного ацетилена и гидроксида кальция (гашеной извести). Разложение карбида кальция водой протекает экзотермически:
СаС2 + 2Н2О → С2Н2 + Са(ОН)2 + 127,4 кДж/моль Теоретически, количество ацетилена, получаемое при разложении 1 кг
химически чистого СаС2, равно 372,5 л/кг. Практически же из 1 кг технического продукта получается 230-280 л ацетилена.
Экзотермичность реакции разложения карбида кальция создает опасность перегрева в зоне реакции. В связи с этим необходимо осуществлять ее при избытке воды и обеспечивать отвод теплоты реакции. Особенно опасны местные перегревы карбида кальция, так как при этом температура в месте его разложения может достигать 700-800 °С. При такой температуре возможна полимеризация, разложение и взрыв ацетилена, особенно при попадании воздуха
72
