
ИХТ / ХТОСА / Технология энергоемких материалов(Юдин) / Еще некоторые материалы / УВ из нефти и кокса
.pdf
положение меняется на обратное, причем при 800 оК и выше расщепление является уже практически необратимым процессом.
Для олефинов склонность к расщеплению проявляется при более высокой температуре, чем для парафинов.
Cm+nH2(m+n) → CmH2m + CnH2n
В системе обратимых реакций пиролиза олефина и его димеризации (полимеризации) перемена знака ΔGo для низших олефинов происходит только при 750-800 оК. Это указывает на термодинамическую возможность их полимеризации при термическом и каталитическом пиролизе, но с преобладанием расщепления при более высоких температурах.
Известные законы термодинамики позволяют оценить роль давления при термическом расщеплении нефтепродуктов. Повышение давления способствует смещению равновесия в сторону полимеризации олефинов и алкилирования парафинов, поскольку данные реакции протекают с уменьшением объема. В связи с этим высокое давление препятствует глубокому расщеплению сырья и снижает образование углеводородов и особенно олефинов. Очевидно, понижение давления и повышения температуры должны действовать в обратном направлении.
Парафиновые углеводороды Алканы разлагаются согласно молекулярным реакциям:
C |
H |
C6H14 |
+ |
|
C H |
12 |
(1) |
|
|||
12 |
|
26 |
|
|
|
|
6 |
|
|
||
C H |
14 |
C H |
6 |
+ |
|
C4H8 (2) |
|
||||
6 |
|
2 |
|
|
|
|
|
|
|
||
C3H8 |
C2H4 |
+ |
|
CH |
4 |
|
(3) |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
C4H10 |
C2H4 |
+ |
|
C H |
6 |
(4) |
|
||||
|
|
|
|
|
|
|
2 |
|
|
|
|
C3H8 |
C H |
6 |
+ |
H |
и |
|
C4H10 |
C4H8 + H2 (5) |
|||
|
|
|
3 |
|
2 |
|
|
|
|
||
C2H6 |
C H |
+ |
H |
2 |
|
|
(6) |
|
|||
|
|
|
2 |
4 |
|
|
|
|
|
|
|
Равновесное дегидрирование алканов С3-С4 может пройти до конца при температуре 800-850 С, а дегидрирование этана – лишь при 900-950 оС. Реакции расщепления алканов могут завершаться при более низкой температуре, порядка 250-450 С (Рисунок 1), причем, чем больше атомов
13
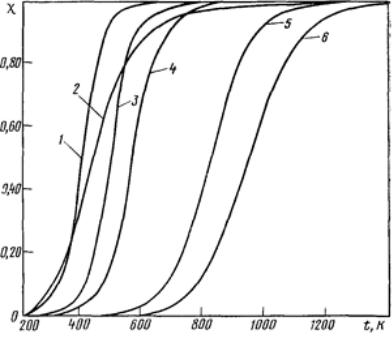
углерода в молекуле исходного углеводорода, тем более низкой температуре соответствует его полное равновесное расщепление:
Рис.1. - Температурная зависимость равновесной степени превращения по реакциям дегидрирования и расщепления; номера кривых соответствуют номерам реакций из текста выше.
Одной из реакций пиролиза алканов является разложение их на углерод и водород. С повышением температуры равновесная степень разложения алканов и олефинов по этой реакции возрастает, а ацетилена падает. Поэтому при температуре 1400 С ацетилен становится термодинамически более устойчивым, чем этилен. Стабильность углеводородов к разложению по этому направлению также уменьшается с увеличением числа атомов углерода в молекуле. Практически в условиях пиролиза, т.е. при малом времени пребывания сырья в зоне реакции, распад алканов и олефинов на С и Н, несмотря на его большую равновесную вероятность, осуществляется из-за кинетических ограничений в небольшой степени.
С увеличением температуре в результате первичной реакции повышаются выходы низших олефинов, метана и водорода и снижается выход алканов, что проиллюстрировано на рисунке 2.
14
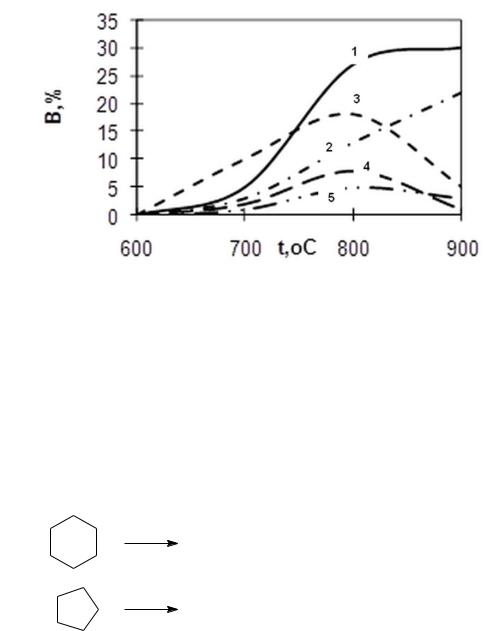
Рис. 2. Зависимость выходов продуктов пиролиза прямогонного бензина в изотермическом реакторе от температуры:
1 – С2Н4; 2 – СН4; 3 – С3Н6; 4 – С4Н8; 5 – С4Н6
Нафтеновые углеводороды.
Нафтеновые углеводороды (циклопентан и циклогексан) более устойчивы к действию температуры, чем нормальные пентан и гексан. Для пиролиза циклопентана и циклогексана при температуре 750-800°С характерны реакции разрыва кольца и дегидрогенизации.
C2H6 + C4H6
C2H4 + C3H6
Ароматические углеводороды.
Ароматические углеводороды образуются в процессе пиролиза, а также в небольших количествах присутствуют в сырье. Их особенностью является большая прочность связи С-С. Поэтому бензольные соединения, как правило, не распадаются на более мелкие молекулы. При наличии боковой цепи в молекуле бензола легко протекает реакция деалкилирования.
Пиролиз этана, пропана, бутана.
При пиролизе этана основной реакцией является реакция дегидрирования:
15
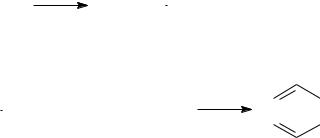
С2Н6 → С2Н4 + H2
также имеет место реакция образования метана: 2С2Н6 → 2СН4 + С2Н4
Пиролиз пропана в основном происходит по следующим реакциям:
1.С3Н8 → С2Н4 + СН4
2.С3Н8 → С3Н6 + H2
3.2С3Н8 → С2Н4 + С2Н6 + CH4
Пиролиз н-бутана характеризуется следующими первичными реакциями:
1.С4Н10 → СН4 + С3Н6
2.С4Н10 → С2Н6 + С2Н4
3.С4Н10 → 2С2Н4 + H2
4.С4Н10 → С4Н8 + H2
Основной реакцией процесса пиролиза является реакция разложения углеводородов на молекулы с меньшим числом атомов углерода. Но эти молекулы не остаются инертными - они вступают в разнообразные реакции между собой и с первоначальными углеводородами, в том числе: в реакции уплотнения (полимеризации, конденсации), в результате которых из нескольких молекул образуется новая молекула больше, чем молекула исходного углеводорода. Осколки молекул могут также распадаться дальше, вплоть до разложения на углерод (нефтяной кокс) и водород.
Следовательно, в ходе процесса пиролиза осуществляется целый ряд последовательных и параллельных реакций.
Конденсация:
2CH |
|
CH |
CH2 |
|
CH CH |
|
CH2 + H2 |
|
|
|
|||||
|
|||||||
|
|
|
|||||
2 |
2 |
|
|
|
|
|
|
Продуктом реакций конденсации олефинов и дивинила обычно являются ароматические углеводороды:
CH |
|
CH CH |
|
CH |
2 |
+ |
CH |
2 |
|
CH |
2 |
|
|
+ 2 H2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Получающиеся ароматические углеводороды также могут конденсироваться. В конечном итоге эти реакции ведут к образованию кокса.
Полимеризация:
16
C2H4  C4H8
C4H8
Распад олефинов.
C3H6  C2H2 + CH4
C2H2 + CH4
Таким образом, чтобы получить наибольший выход олефинов, необходимо остановить процесс до развития вторичных реакций. Для этого пирогаз на выходе из змеевика резко охлаждают до температуры
350-470 °С.
Этот процесс называется закалкой пирогаза и производится в закалочно-испарительных аппаратах.
Процесс пиролиза идет с поглощением тепла:
Qp бензина = 270-300 ккал/кг
Qp этана = 900 ккал/кг
При пиролизе этана, наблюдается интенсивное образование кокса и значительное сокращение пробега печи. Поэтому, на этановой печи приемущественно производится совместный пиролиз этана с бензином, при этом используют бензин, содержащий достаточное количество серы, так как сера подавляет активные центры на поверхности змеевиков, изготовленных из высоколегированной стали с большим содержанием никеля, который является катализатором коксообразования. В результате этого скорость коксообразования резко падает. Таким образом, сернистые соединения являются ингибиторами для вредных реакций, протекающих в пиролизных змеевиках с образованием кокса.
1.3.2. Факторы, влияющие на процесс пиролиза
На процесс пиролиза влияют следующие основные факторы:
1.Температура
2.Время контакта
3.Давление.
4.Разбавление водяным паром
5.Материал, из которого выполнен змеевик печи
1. Температура является основным из факторов, определяющих характер процесса пиролиза. При повышении температуры резко повышается скорость реакций пиролиза, а иногда и меняется их характер.
17
При температурах порядка 800°С увеличение температуры на 15-25°С ускоряет пиролиз бутана, пропана и этана в два раза.
С повышением температуры скорость первичных реакций распада растет быстрее, чем скорость вторичных. На этом основан высокотемпературный скоростной пиролиз. В этом процессе вторичные реакции, т.е. реакции полимеризации и конденсации образующихся олефинов значительно отстают от первичных, поэтому олефины сохраняются и выход их по отношению к сырью возрастает, а выход смолы и кокса снижается.
2.Время контакта существенно влияет на выход кокса. С увеличением времени контакта за счет уменьшения скорости подачи сырья
впиролизный змеевик резко увеличивается коксообразование, что ведет к ухудшению условий передачи тепла к сырью, что негативно сказывается процессе в целом и его направлении.
3.Давление. Снижение давления способствует образованию газообразных продуктов и увеличению выхода этилена и пропилена, т.к. пиролиз углеводородов сопровождается увеличением объема реакционной смеси. Увеличение давления способствует реакциям полимеризации и конденсации, что приводит к увеличению выхода смол, кокса и снижению выхода олефинов.
4.Разбавление водяным паром при пиролизе снижает парциальное давление углеводородов, что ведет к углублению процесса распада углеводородов. Кроме того, образующийся кокс вступает в реакцию с водяным паром, что снижает коксообразование. Также водяной пар, разбавляя реагирующие вещества, снижает долю реакций полимеризации и конденсации. Расход пара разбавления определяется экономическими факторами, при повышении расхода пара происходит удорожание процесса. При пиролизе бензина расход пара составляет до 50% от массы сырья, при пиролизе этана - 30%, при пиролизе бутана - 40-50%.
5.Материал, из которого выполнен змеевик печи, также играет существенную роль для процесса пиролиза. Каталитическое действие на образование кокса оказывает никель (Ni) железо (Fe) и кобальт (Со). Количество хрома (Cr) в стали уменьшает каталитическое действие никеля.
18
Обработка внутренней поверхности труб радиации меркаптанами уменьшает скорость коксообразования в 30-40 раз при 100ррм серы; при меньшем содержании серы необходимо обеспечить ее дополнительное введение.
1.3.3. Технологическое оформление процессов термической деструкции нефти
Главным аппаратом термического крекинга и пиролиза нефтяных фракций является трубчатая печь; схемы движения потоков сырья и топочных газов могут быть различными. Но при любом конструкционном решении все они строятся по одному принципу: предварительный подогрев сырья отходящими газами в конвективной камере и зона крекинга (пиролиза) в радиантной части печи. Вариант схемы трубчатой печи приведён на рисунке 3.
19
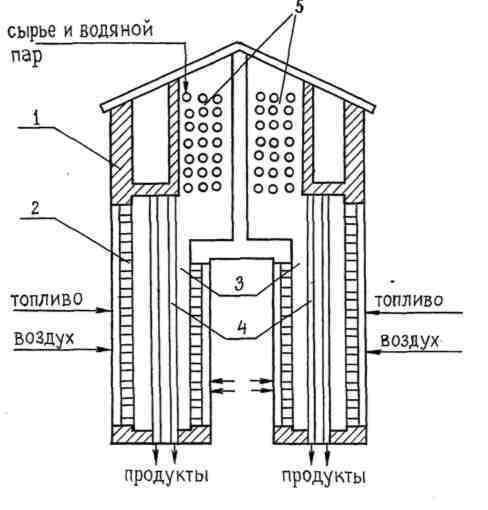
Рис. 3. Схема печи пиролиза. 1 - корпус; 2 - панельные горелки; 3 - радиантные камеры;4 - вертикальные трубы; 5 - конвекционная камера.
На современных высокопроизводительных этиленовых установках (ЭП-300 и ЭП-450 производительностью соответственно 300 и 450 тыс. т этилена в год) применяют мощные пиролизные печи, специально сконструированные для условий интенсивного высокотемпературного нагрева (до 870-920 °С) с временем пребывания сырья в реакционных змеевиках в пределах 0,01-0,1 с. Они характеризуются вертикальным расположением труб радиантных змеевиков в виде однорядного экрана с двухсторонним облучением панельными горелками беспламенного горения (или с факельными горелками с настильным пламенем). Проход по трубам радиантного змеевика организован в виде нескольких (от 4 до 12) параллельных потоков (секций). Каждая секция состоит из нескольких
20
жаропрочных труб (от 3 до 12) длиной от 6 до 16 м и диаметром 75-150 мм.
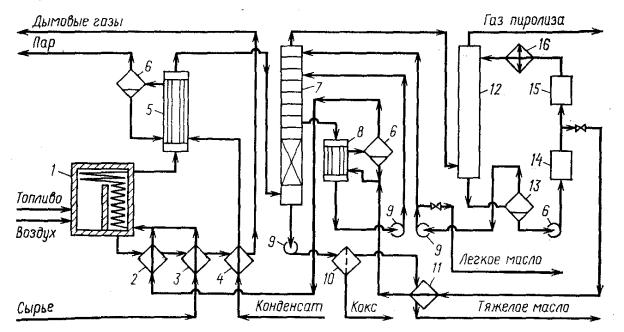
Принципиальная схема процесса пиролиза бензина приведена на рисунке 4.
Рис. 4. Технологическая схема пиролиза бензина.
1 – печь пиролиза; 2, 3, 4, 11 – теплообменники; 5,8 – котлы утилизаторы; 6 – пароприёмник; 7 – колонна тяжёлой фракции; 9 – насосы; 10 – фильтр; 12 – колонна лёгкой фракции; 13 – сепаратор; 14 – блок очистки оборотной воды; 15 – блок рекуперации тепла оборотной воды; 16 – холодильник.
1.3.4. Каталитический крекинг
Крекинг нефтяного сырья в присутствии катализаторов, или, коротко, каталитический крекинг - в настоящее время один из основных методов производства базовых компонентов автомобильных бензинов. Применение катализатора в крекинг-процессе вносит значительные изменения как в механизм протекающих превращений углеводородов, так и в состав получаемых продуктов. Преимущества каталитического крекинга заключаются, во-первых, в том, что в результате общего ускорения процесса удается несколько снизить температуру крекинга и проводить процесс при низком давлении; во-вторых, и это главное, селективное действие катализатора ускоряет такие реакции, которые
21
приводят к накоплению в крекинг-бензине аренов, изоалканов и изоалкенов обладающих большими октановыми числами. Процесс проводят в паровой фазе при 450 - 525 °С под давлением не выше 0,15 МПа в присутствии алюмосиликатного катализатора.
1.3.4.1. Теоретические основы и химизм каталитического крекинга
В настоящее время почти все установки каталитического крекинга переведены на работу с синтетическими кристаллическими алюмосиликатными катализаторами - цеолитами.
Цеолитами называются природные и искусственные алюмосиликаты, обладающие чрезвычайно тонкопористой структурой. Они представляют собой водные алюмосиликаты натрия, кальция и других металлов. Все цеолиты имеют кристаллическое строение с четко выраженной структурой. Их общее свойство - наличие мельчайших полостей, сообщающихся между собой через «окна» (поры). Их общий объем может достигать половины всего объема кристалла. Именно благодаря этому обезвоженные цеолиты являются прекрасными адсорбентами. Но в отличие от других адсорбентов (активный уголь, силикагель, оксид алюминия и др.) размер пор у цеолитов очень мал и все поры имеют одинаковый диаметр. Для разных типов синтетических цеолитов размер пор колеблется от 0,3 до 1,3 нм. Следовательно, поры цеолита имеют молекулярные размеры, благодаря чему цеолиты обладают как бы просеивающими свойствами, т. е. могут пропускать в полости кристалла и адсорбировать молекулы только определенного размера, не превышающие диаметра пор данного цеолита.
Содержание самих цеолитов в цеолитсодержащих катализатоpax невелико (3-15 %). В процессе приготовления катализатор модифицированные металлами (хромом, рением, платиной, палладием и др.) цеолиты вводят в матрицу (подкладку) неорганических оксидов (SiO2, Аl203, глины и др.).
Особенностью катализаторов каталитического крекинга является их быстрая дезактивация. Поры катализатора закоксовываются через 10-15 минут работы. Поэтому необходимо крекинг все время чередовать с регенерацией катализатора. Каталитические процессы с частой сменой
22
