
- •Белки, их строение и биологическая роль
- •Строение белков. Первичная структура.
- •Вторичная структура
- •Третичная структура
- •Понятие о нативном белке
- •Классификация. Биологические и химические свойства белков
- •Физико-химические свойства белков
- •Биохимия сложных белков
- •Некоторые особенности строения миоглобина и гемоглобина
- •Гемаглобинопатии
- •Ферменты
- •Механизм действия ферментов. Основные черты ферментативного катализа, его этапы.
- •1. Частичный протеолиз (Трипсиноген------ Трипсин)
- •Факторы, оказывающие влияние на активность ферментов.
- •Конкурентное ингибирование.
- •Неконкурентное ингибирование.
- •Биохимия нуклеотидов и нуклеиновых кислот. Матричные биосинтезы.
- •Характеристика репликации.
- •Транскрипция. Трансляция.
- •1).Инициация
- •1. Обмен веществ включает в себя 3 этапа:
- •Организация цпэ (по рис.1)
- •Функции дыхательной цепи:
- •Дыхательный контроль.
- •Токсичное действие кислорода. Защита от токсичного действия кислорода.
- •Обмен углеводов.
- •Функции углеводов.
- •Всасывание углеводов в кишечнике.
- •Метаболизм глюкозы.
- •Гликолиз (дихотомический процесс).
- •Биомедицинское значение ферментативных реакций гликолиза.
- •Суммарная реакция и выход энергии при гликолизе.
- •Пентофозофосфатный путь ( пфп).
- •Биомедицинское значение.
- •Общая схема биохимических реакций пфп.
- •Медицинское значение.
- •Глюконеогенез.
- •Биомедицинское значение.
- •Биомедицинское значение.
- •Биосинтез гликогена.
- •Обмен фруктозы и галактозы.
- •Обмен липидов.
- •Функции липидов в организме.
- •Переваривание и всасывание жиров.
- •Желчные кислоты.
- •Всасывание продуктов гидролиза.
- •Биосинтез кетоновых тел.
- •Распад кетоновых тел.
- •Биосинтез высших жк.
- •Синтез жиров (таг).
- •Отличие действия инсулина в жировой ткани и печени:
- •Синтез холестерина.
- •Биосинтез Хс.
- •Ферменты.
- •Регуляция синтеза нуклеотидов.
- •Синтез пиримидиновых нуклеотидов.
- •Регуляция.
- •Катаболизм.
- •Катаболизм пуриновых нуклеотидов.
- •Регуляция обмена веществ. Гормоны (химические посредники).
- •1. По химической структуре:
- •2. По механизму действия;
- •3. По влиянию на организм:
- •Синтез и секреция гормонов.
- •Механизм действия гормонов белково-пептидной природы через вторичных посредников.
- •Эффекты, осуществляемые через ц амф.
- •Кальций как вторичный посредник.
- •Биохимия печени
- •Обезвреживающая функция печени
- •Обезвреживание веществ
- •Отличие этих цепей от цпэ
- •Удф-глюкуронилтрансферазы
- •Биохимия крови
- •Белки плазмы крови
- •Сывороточный альбумин
- •Глобулины
- •Конверсия метгемоглобина
- •Биосинтез тема и его регуляция
- •Гемостаз
- •1 Фаза: первичный гемостаз.
- •2 Фаза: гемокоагуляция
- •Фибрина
- •Противосвертывающая система
- •Биохимический_анализ
- •Гормоны
- •Липотропины
1. Частичный протеолиз (Трипсиноген------ Трипсин)

4. Аллостерическая ( фосфофруктокиназа, изицитратдегидрогеназа)
«Ферменты - основа жизни» (Павлов)
В обмене веществ ферменты играют первостепенную роль. В основе заболеваний лежит изменение какой-либо ферментативной реакции, если ингибировать хотя бы 1 фермент наступает смерть.
Факторы, оказывающие влияние на активность ферментов.
Биологические: вид (животное), если человек, то учитывается пол и возраст, физиологическое состояние организма, условия питания, окружающая среда и эмоциональные факторы.
Физико-химические: концентрация фермента и, главным образом, субстрата, температуры, рН и ингибиторы. Наибольший клинический интерес представляет температура, рН и ингибиторы.
1). Концентрация субстрата
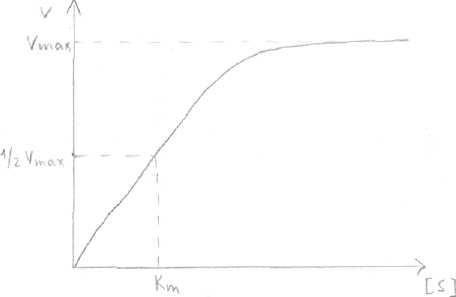
По сути дела Km составляет l/2Vmax .
Для того, чтобы определить скорость реакции можно пользоваться уравнением:
V=Vmax*(S)/(S)+Km
Концентрация фермента не оказывает влияния на процесс.
2). Температура
Ферменты имеют белковую природу и являются термолабильными. В некотором
ограническом интервале температур (от 0°до 25° С) скорость ферментативной реакции
повышается, с ростом температуры (на 10°С) скорость повышается примерно в 2 раза.
При дальнейшем повышении температуры скорость реакции постепенно понижается,
высокие температуры приводят к денатурации фермента - белка и необратимой утрате
ферментативной активности. Для большинства ферментов оптимум температурный
приближается к нормальной температуре тела.
В первые часы повышенной температуры вырабатывается фермент интерферон,
выполняющий защитные функции. Пониженные температуры используют в
трансплантации, искусственном оплодотворении.
Растительные ферменты менее чувствительны к температуре.
3). Влияние рН на активность ферментов.
а) значение рН, которое соответствует максимальной активности фермента, необязательно совпадает со значением рН, характерным для нормального внутри - и внеклеточного окружения этого фермента;
б) всё-таки большинство ферментов имеют оптимум рН, близкий к рН окружающей среды;
в) у многих ферментов оптимум рН приближается к ИЭТ;
г) для каждого фермента существует своё значение рН, при котором он проявляет максимальную активность;
д) «Значение рН внутри клетки является, возможно, одним из самых важных элементов регуляции клеточного метаболизма».

 Пепсин
Пепсин
ТРИПСИН
/

величина рК (константа диссоциации) ионизированных групп активного центра фермента, которые участвуют в связывании субстрата;
величинами рК ионизированных групп самого субстрата;
величинами рК функциональных групп фермента, которые отвечают за катализ;
величинами рК других участков молекул ферментов (аллостерические центры)
4). активаторы и ингибиторы.
Активирование или ингибирование различных ферментов веществами эндогенного и экзогенного происхождения является значимым фактором регуляции обмена веществ. Ингибиторы подразделяются на обратимые и необратимые. В свою очередь обратимое ингибирование бывает 3-ёх видов: аллостерическое, конкурентное и неконкурентное. Примером необратимого ингибирования может быть действие высоких температур, резкое изменение рН, приводящее к денатурации фермента или действие тяжёлых металлов, соединений мышьяка, которые связываются с ферментом или с фермент-субстратным комплексом в АЦ или блокируют функциональные группы молекул фермента, удаленных от АЦ. В наибольшей степени ингибирующему действию тяжелых металлов подвергаются тиоловые ферменты.
Диизопропилфторфосфат - это вещество образует сложный эфир с остатком серина в молекуле ацетилхолинэстеразы. Вследствие этого утрачивается способность нейрона проводить нервные импульсы (относится к сильным нервнопаралитическим средствам). Терапевтическое действие аспирина связано с ингибированием одного из ферментов, участвующего в биосинтезе простогландинов (обладает гормональными свойствами, является клеточным метаболитом).
