
МІНІСТЕРСТВО ОСВІТИ НАУКИ І КУЛЬТУРИ УКРАЇНИ
ЗАПОРІЗЬКИЙ НАЦІОНАЛЬНИЙ УНІВРСИТЕТ
Кафедра менеджменту організації
ІНДИВІДУАЛЬНА РОБОТА
З дисципліни
«ЦИВІЛЬНИЙ ЗАХИСТ»
На тему:
“ХЛОР ВАРІАНТ 9 ”
Підготував студент 6-го курсу
Гр.7-3612-1-6
Гулевский Д.В.
Перевірила Кузьміна М. А.
Запоріжжя 2012
ЗМІСТ
ВСТУП……………………………………………………………………….……3
1.Основні властивості……………………………………………………..4
2.Вибухо – і пожежонебезпечність…………………………………….…6
3.Небезпека для людини…………………………………………….…….6
4.Ступінь захисту……………………………………………………….…8
5.Дезактивація………………………………………………………….….9
6.Перша медична допомога при отруєнні аміаком(долікарська)….….10
Практична частина…………………………………………………….…12
Список використаних джерел………………………………….……15
ВСТУП
До об’єктів, які виробляють, використовують або зберігають СДОР відносяться: підприємства харчової і м’ясо-молочної промисловості, які мають холодильні установки, у яких використовується як холодогент аміак; водопровідні та очисні споруди. на яких застосовуються хлор; залізничні станції, які мають колії відстою пересувного складу з СДОР; склади і бази з запасами СДОР, інші об’єкти.
В наслідок аварії виникає зона хімічного зараження, яка включає ділянку розливу і територію над якою розповсюдились пари СДОР у вражаючих концентраціях.
Глибина і ширина зони зараження залежить від кількості СДОР, їх фізичних властивостей і токсичності, метеоумов і рельєфу місцевості.
По токсичних властивостях СДОР в основному являються речовинами загально отруйної і удушливої дії. Вони викликають отруєння організму і ураження органів дихання. При попаданні на тіло людини рідини речовин виникають ураження поверхні шкіри.
1.Основні властивості.
За поширеністю в природі хлор близький до фтору на його частку доводиться 0,02% від загального числа атомів земної кори. Людський організм містить 0,25 вагу. % Хлору.
Природний хлор складається з суміші двох ізотопів - 35 Сl (75,5%) та 37 Сl (24,5%). Він був вперше отриманий (дією МnО 2 на соляну кислоту) в 1774 р., але встановлення його елементарної природи пішло лише в 1810 р. Подібно фтору, основна маса хлору надійшла на земну поверхню з гарячих надр Землі. Навіть в даний час з вулканічними газами щорічно виділяються мільйони тонн і НСl і НF. Ще набагато більш значним було таке виділення в минулі епохи.
Первинна форма знаходження хлору на земній поверхні відповідає його надзвичайному розпорошення. У результаті роботи води, протягом багатьох мільйонів років руйнувала гірські породи і вимиває з них все розчинні складові частини, з'єднання хлору накопичувалися в морях. Всихання останніх призвело до утворення в багатьох місцях земної кулі потужних покладів NаС1, який і є вихідним сировиною для отримання сполук хлору.
Будучи
найбільш практично важливим з усіх
галоидов,
хлор
у величезних кількостях використовується
для вибілювання тканин і паперової
маси, знезараження питної води (приблизно
1,5 г на 1 м 3)
і в інших галузях техніки. Щорічне
світове споживання хлору обчислюється
мільйонами
тонн.
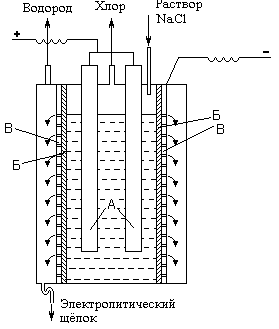 Рис.
.
Принципова
схема електролізера
для отримання хлору.
Рис.
.
Принципова
схема електролізера
для отримання хлору.
Основним промисловим методом отримання хлору є електроліз концентрованого розчину NаС1. Принципова схема електролізера показана на рис. VII-5 (А - аноди, Б - діафрагма, В - катод). При електролізі на аноді виділяється хлор (2С1 - - 2е - = С1 2), а в при катодному просторі виділяється водень (2Н + + 2е - = Н 2) утворюється NаОН.
При практичному здійсненні електролізу розчину NaCl витрата електроенергії на одержання 1 т хлору становить близько 2700 кВт · год Отриманий хлор під тиском згущується в жовту рідина вже при звичайних температурах. Зберігають і перевозять його в сталевих балонах, де він поміщений під тиском близько 6 атм. Балони ці повинні мати забарвлення захисного кольору із зеленою поперечною смугою у верхній частині. Для лабораторного отримання хлору зазвичай користуються дією MnO 2 або КМnO 4 на соляну кислоту:
МnО 2 + 4 НСl = МnСl 2 + Сl 2 + 2 Н 2 О
2 КМnO 4 + 16 НCl = 2 КCl + 2 МnСl 2 + 5 Сl 2 + 8 Н 2 О
Друга реакція протікає значно енергійніше перші (що вимагає підігрівання).
Вільний хлор є жовто-зелений газ, що складається з двохатомних молекул. Під звичайним тиском він зріджується при -34 ° С і твердне при -101 ° С. Один обсяг води розчиняє близько двох об'ємів хлору. Утворений жовтуватий розчин часто називають «хлорного водою». Критична температура хлору дорівнює 144 ° С, критичний тиск 76 атм. При температурі кипіння рідкий хлор має щільність 1,6 г / см 3, а теплота його випаровування складає 20,5 кДж / моль. Твердий хлор має щільність 2,0 г / см 3 та теплоту плавлення 6,3 кДж / моль. Кристали його утворені окремими молекулами С1 2 (найкоротша відстань між якими дорівнює 334 пм). Зв'язок Сl-Сl характеризується ядерним відстанню 198 пм. Термічна дисоціація молекулярного хлору по рівнянню С1 2 + 242 кДж Û 2 С1 стає помітною приблизно з 1000 ° С.
Атом хлору має в основному стані структуру зовнішнього електронного шару 3s 2 3р 5 і одновалентен. Збудження його до найближчого трехковалентного рівня 3s23р 4 4s 1 вимагає витрати 857 кДж / моль.
Енергія приєднання електрона до нейтрального атома хлору оцінюється в 355 кДж / моль. Спорідненість до електрона хлору (аналогічно і інших галоидов) може бути обчислено за допомогою розгляду реакцій утворення хлористих солей по окремих стадіях. Наприклад, для NаС1 маємо:
1) Nа (т) = Nа (г) - 109 кДж (теплота сублімації)
2) 1 / 2 С1 2 (р) = С1 (г) - 121 кДж (теплота дисоціації)
3) Na (р) = Nа + (р) + е - - 493 кДж (енергія іонізації)
4) С1 (р) + е - = Сl - (р) + Х кДж (шукане спорідненість до електрона)
5) Nа + (р) + Сl - (р) = NаС1 (т) +777 кДж (енергія кристалічної решітки) у сумі: Nа (т) + 1 / 2 С1 2 (р) = NаСl (т) + (Х +777-493-121-109) кДж
З іншого боку, безпосередньо визначена на досвіді теплота освіти NаС1 з елементів дорівнює: Nа (т) + 1 / 2 С1 2 (р) = NаС1 (т) + 410 кДж. Отже, за законом Гесса, Х + 777 - 493 - 121 - 109 = 410, звідки Х = 356 кДж. Іон С1 - - характеризується ефективним радіусом 181 пм і енергією гідратації 351 кДж / моль. Для ковалентного радіуса хлору приймається половина ядерного відстані молекули С1 2, тобто 99 пм.
Розчинність хлору у воді змінюється з температурою наступним чином:
-
Температура, ° С
0
10
15
20
25
30
40
50
60
Розчинність V на 1V H 2 O
4,6
3,1
2,7
2,3
2,0
1,8
1,4
1,2
1,0
Описано два кристалогідрату хлору - С1 2 · 6Н 2 О і С1 2 · 8Н 2 О. У дійсності вони можуть мати змінний склад, так як є клатратами. Значно гірше (приблизно в 4 рази), ніж у воді, розчиняється хлор у насиченому розчині NаС1, яким тому і зручно користуватися при збиранні хлору над рідиною. Найбільш придатним для робіт з ним органічним розчинником є чотирихлористий вуглець (СС1 4), один обсяг якого розчиняє при звичайних умовах близько 50 обсягів хлору
Основним споживачами хлору є органічна технологія (одержання хлорованих напівпродуктів синтезу) і целюлозно-паперова промисловість (відбілювати). Значно менше споживається хлор в неорганічної технології, санітарної техніки та інших областях. Цікаво нещодавно запропоноване використання хлору для обробки металів: під його дією з досить нагрітої (інфрачервоним випромінюванням) поверхні всі шорсткості видаляються у формі летких хлоридів. Такий метод хімічної шліфовки особливо застосуємо до виробів складного профілю. Було показано також, що струмінь хлору легко прорізає досить нагріті листи з жаростійких сплавів.
Хлор має різким запахом. Вдихання його викликає запалення дихальних шляхів. Як засіб першої допомоги при гострих отруєннях хлором застосовується вдихання парів суміші спирту з ефіром. Корисно також вдихання парів нашатирного спирту.
Гранично допустимою концентрацією вільного хлору в повітрі виробничих приміщень вважається 0,001 мг / л. Перебування в атмосфері, що містить 0,01% хлору і вище, швидко призводить до важкого захворювання. Ознакою гострого отруєння є поява болісного кашлю. Постраждалому необхідно перш за все забезпечити повний спокій; корисно також вдихання кисню.
2. Пожежо-і вибухонебезпечність хлору. Негорючий, але пожаронебезпечний, підтримує горіння багатьох органічних речовин. В суміші з воднем вибухонебезпечний. При нагріванні ємності вибухає.
