
- •Статистический характер второго закона термодинамики. Флуктуации.
- •Флуктуации.
- •Энтропия и информация
- •Открытые системы.
- •Процессы переноса тепла и массы.
- •Перенос массы. Диффузия.
- •Принцип локального равновесия
- •Модель хищник-жертва как пример периодических процессов.
- •Круговорот биогенов в экосистемах и поток энергии через них.
Перенос массы. Диффузия.
Процессы диффузии описываются законом
![]()
где с- концентрация вещества, D- коэффициент диффузии.
Принцип локального равновесия
Если процессы, возмущающие равновесие, менее интенсивны, чем процессы, которые формируют равновесие, то можно говорить с определенной степенью точности о локальном равновесии, то есть о равновесии в физически бесконечно малом объеме. Точность такого утверждения будет тем выше, чем меньше отношение скорости изменения состояния за счет внешних условий к скорости восстановления равновесия за счет внутренних релаксационных процессов.
Подчеркнем, что существование локального равновесия еще не означает малости отклонения всей системы от равновесия. Представим себе газ, заключенный между двумя плоскостями, одна из которых поддерживается при температуре 0°С, а другая — при 100°С. Ясно, что эта система с конечным отклонением от равновесия, однако процесс теплопроводности настолько медленный, что в каждом физически бесконечно малом объеме столкновения практически успевают восстановить локальное равновесие.
Идея о локальном термодинамическом равновесии была впервые высказана
И. Пригожиным и оказалась очень плодотворной в термодинамике необратимых процессов.
Это в первую очередь определяется тем, что для неравновесных состояний можно ввести функции состояния, например энтропию, которые будут зависеть от тех же переменных, от которых они зависят, когда система находится в состоянии равновесия.
Это значит, что второе начало термодинамики в форме соотношения Гиббса справедливо и для неравновесных состояний, когда термодинамические функции являются функциями координат и времени.
Обосновать применимость уравнения Гиббса к неравновесным системам в рамках термодинамики необратимых процессов нельзя.
Поэтому принцип локального равновесия является постулатом.
Справедливость этой гипотезы в рамках феноменологического подхода можно оправдать только совпадением результатов теории с экспериментальными данными. Статистическое рассмотрение позволяет получить условия применимости соотношения Гиббса, но только в частном случае разреженного газа. Соотношение Гиббса для разреженного газа справедливо с точностью до членов первого порядка по параметру, равному отношению скорости внешнего воздействия к скорости установления равновесия, и для моментов времени, больших среднего времени свободного пробега.
Таким образом, принцип локального равновесия ограничивает класс систем, доступных термодинамическому рассмотрению. Однако это ограничение наименее сильное из всех условий, накладываемых остальными постулатами неравновесной термодинамики.
В таблице перечислены обобщенные силы, действующие в различных необратимых процессах, и порождаемые ими потоки.
Необратимые процессы |
Потоки |
Силы |
Диффузия |
Jd |
grad C |
Теплоперенос |
Jq |
grad T |
Химическая реакция |
vi |
Е/RТ |
Локальное производство энтропии
Локальное производство энтропии и означает возникновение энтропии внутри малого элементарного объема за счет протекания необратимых процессов.
Можно вычислить dS/dt, т. е. изменение во времени общей энтропии системы.
На основании положений локальной термодинамики можно заключить, что общее изменение
![]()
Здесь
deS/dt -поток энтропии, обусловленный взаимодействием с окружающей средой и
diS/dt -производство энтропии внутри системы.
Из этого уравнения видно, что
общая энтропия данной системы может изменяться, только если существуют потоки энтропии через границы раздела или если она производится внутри системы.
В равновесной системе отсутствуют какие-либо потоки и силы, следовательно,
dSi /dt = 0 и соответственно,
dS/dt = de S/dt.
Мы тем самым подтверждаем хорошо известное, твердо установленное
свойство равновесной системы, согласно которому единственным способом изменения энтропии является пересечение ею границ системы.
Если мы изолируем систему от внешних энтропийных потоков, уравнение можно переписать в виде
![]()
Знак неравенства возникает потому, что энтропия изолированной системы может только увеличиваться.
Предположение о локальном равновесии подсказывает нам, что, если соотношение справедливо для всего объема, оно также справедливо и для любого малого элементарного объема той же системы.
Конвективная неустойчивость Бенара.
самоорганизация в открытой системе.
Явление было открыто Бенаром в 1900 г., хотя все его разнообразие и глубина были осознаны лишь совсем недавно.
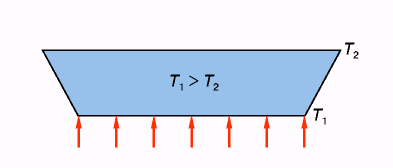
Рис. 2. Эффект Бенара. Сечение сосуда, нагреваемого снизу
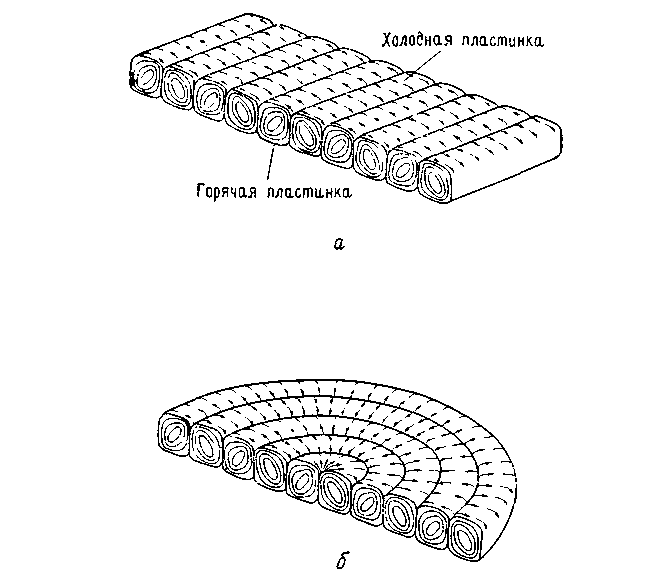
Рис. 6.5. Слой жидкости находится между двумя горизонтальными пластинками с разной температурой (холодная и горячая пластинки). При пороговом значении разности температур ΔТ появляются устойчивые конвективные ячейки, имеющие форму роликов. Соседние «ролики» вращаются в противоположных направлениях.
Жидкость находится между двумя горизонтальными пластинками, не имеющими определенных размеров. Верхняя пластинка нагревается до постоянной заданной температуры Т1 , а нижняя — до Т2, причем T2 >T1 .
При таких граничных условиях в слое жидкости устанавливается стационарный тепловой поток ΔT. Кроме того, при малых значениях ΔT выполняются линейные соотношения между тепловым потоком и температурным градиентом.
Медленно и постепенно будем увеличивать ΔT выжидая, пока в жидкости в ответ на это изменение не установится соответствующий тепловой поток. Когда он достигнет некоторого порогового значения, система переходит в нелинейную область.
До достижения порогового значения жидкость, находящаяся в состоянии покоя, выглядит бесформенной, но при ΔT1 небольшое увеличение ΔT «организует» ее, образуются конвективные ячейки в форме правильных «роликов» макроскопических размеров, как показано на рис. 6.5, а. Движение жидкости более заметно, если в нее добавить порошок алюминия.
На молекулярном уровне движение жидкости обусловлено согласованным движением ансамблей кооперированных молекул. Корреляция между молекулами распространяется на расстояния порядка одного сантиметра, тогда как внутримолекулярные силы притяжения действуют только на расстоянии порядка 10~8 см. Возникает конвекция, в результате которой при круговом движении конвективных ячеек происходит перенос тепла снизу вверх.
В однородной жидкости все точки системы эквивалентны, однако, как видно из рис. соседние ролики движутся в противоположных направлениях. Поэтому локально симметрия жидкости нарушается. Равноценные точки обнаруживаются только на расстоянии двух роликов. Поэтому мы говорим о потере симметрии среды, сопровождающейся возникновением пространственно неустойчивых организованных структур, которые возникают за счет рассеивания энергии в системе.
В цилиндрическом контейнере образуются конвекционные ячейки в форме круглых роликов. Можно также наблюдать квадратные, пятиугольные и шестиугольные ячейки. Последние появляются, если более холодная пластинка удаляется с верха цилиндра. Как общее правило, для данной жидкости и для данного градиента температур может возникнуть большое разнообразие форм, как бы ни видоизменялись геометрические размеры системы.

Рис. Самоорганизация жидкостей. Силиконовое масло равномерно подогревается снизу.
В присутствии алюминиевого порошка на верхней поверхности, соприкасающейся с воздухом, можно наблюдать конвекционные ячейки Бенара.
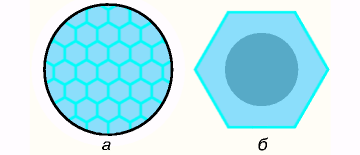
Рис. Эффект Бенара:
а - вид сверху на ячейки,
б - отдельная ячейка.
В затемненном ядре ячейки жидкость движется вверх
Диссипативные системы. Явление самоорганизации.
Когда тепловой поток ΔT достигает порогового значения ΔT1 , возникает явление самоорганизации. Такая последовательность событий — не единственная в своем роде, а зависит от вязкости жидкости и размеров контейнера.
Система Бенара имеет следующие характеристики:
а) это — диссипативная система, находящаяся вдали от термодинамического равновесия;
б) она проявляет свойства самоорганизации;
в) для дискретных значений параметров последовательно появляются различные организованные структуры;
г) в системе наблюдается потеря симметрии среды, сопровождающаяся возникновением пространственно неустойчивых и упорядоченных структур.
Конвекционная ячейка представляет собой диссипативную структуру, в которой демонстрируется определяющая роль сил вязкости в системе, далекой от равновесия.
Термин «диссипативная структура» отражает отличие от равновесных структур, какими являются, например, кристаллы.
Реакция Белоусова—Жаботинского. Химические часы.
Реакция Белоусова — Жаботинского — один из наиболее изученных колебательных химических процессов.
В 1958 г. советский химик Белоусов изучал промежуточную стадию сложного механизма одной химической реакции. Он проводил исследование окисления (сопровождающегося, как известно, потерей электронов молекулами) лимонной кислоты броматом калия. Реакция протекала в водном растворе при избыточном содержании протонов, т. е. в кислой среде, в присутствии ионов церия Се3+, которые играли двойственную роль, будучи катализатором, не расходующимся в реакции, и окрашенным индикатором реакции.
Гомогенный раствор с большой точностью периодически изменяет окраску с бледно-желтой на бесцветную,
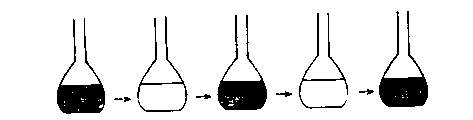
Рис. Химические часы.
Реакционная смесь периодически изменяет окраску с желтой на бесцветную.
В реакционной смеси находятся ионы церия двух типов: ионы Се4+ имеют еле заметную бледно-желтую окраску, в то время как ионы Се3+ интенсивно окрашены в желтый цвет. В зависимости от соотношений концентраций [Се4+]/[Се3+] во времени наблюдается правильный ритм в смене окраски из желтой в бесцветную и наоборот, что наглядно подтверждает возможность колебательного поведения реакции.
Несколькими годами позже Жаботинский повторил и подтвердил опыты Белоусова, заменив лимонную кислоту на другую органическую кислоту — малоновую.
Новость об этой изумительной реакции обошла весь мир, и в нескольких лабораториях, как Советского Союза, так и Соединенных Штатов Америки и Западной Европы, стали интенсивно изучать реакцию, которая сейчас широко известна под названием «реакция Белоусова— Жаботинского».
Серная кислота + малоновая кислота + двойная соль нитрат церия-аммония + бромат натрия
= диоксид углерода + дибромуксусная кислота + броммалоновая кислота + вода
Эта суммарная реакция включает двадцать или даже более элементарных стадий, многие из которых еще полностью не установлены.
Как можно видеть, это — реакция окисления (сгорания) органических веществ броматом в кислом растворе, протекающая в присутствии катализатора до образования продукта— диоксида углерода.
Малоновая кислота может быть заменена на другие органические кислоты; йодные и хлорные производные могут оказывать действие, аналогичное бромату.
Частота химических часов, или число импульсов, изменяющих окраску среды, в минуту, является функцией температуры и начальной концентрации различных компонентов реакционной смеси.
Продолжительность реакции может составлять до 30 мин и более, затем она останавливается из-за недостатка «энергии».
Интерес к химическим колебаниям всегда определялся надеждой понять механизм периодических биологических процессов. Хорошо известно чувство времени у многих биологических объектов, начиная от простейших и кончая высокоорганизованными. Точность хода этих часов бывает поразительна. В некоторых случаях она достигает нескольких минут или даже секунд в сутки.
Загадка биологических часов способствовала резкому увеличению исследований в области химических и биологических колебаний в начале 80-х годов.
