
С (графит) 298 – 2300 к
СО2 (г) 298 – 2500 К
СО (г) 298 – 2500 К
Искомая область температур: 982 ÷ 2300 к

ЗАДАЧА
Рассчитайте Кр и Кс реакции
С(к)
+ СО2(г)
![]() 2СО(г)
2СО(г)
при 298 К и 1000 К. Сделайте вывод о выходе продукта реакции и определите знак энтальпии реакции.
Решение:
Кр
=
 ;
Кс
=
;
Кс
=
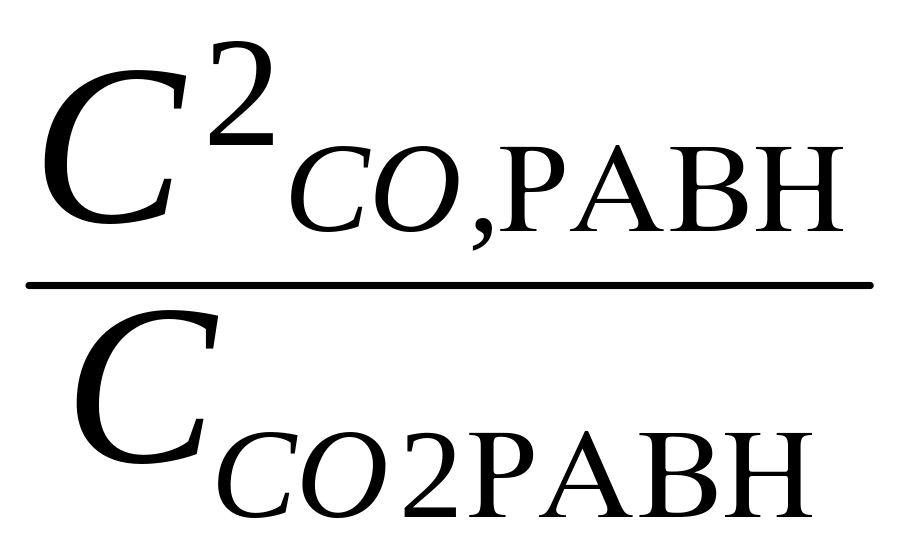
∆r G0Т = –RT lnКр Þ Kp = exp(–∆G0Т /RT)
∆r G0298 = 120,15 кДж; ∆r G01000 = –3,16 кДж
Кр298 = exp(–120 · 103 / 8,31· 298) = ехр( –48,5) = 8 × 10–22
Kp1000 = exp(+3160 / 8,31 · 1000) = ехр(0,38) = 1,46
(Обратите внимание на размерность!)
Кс
=
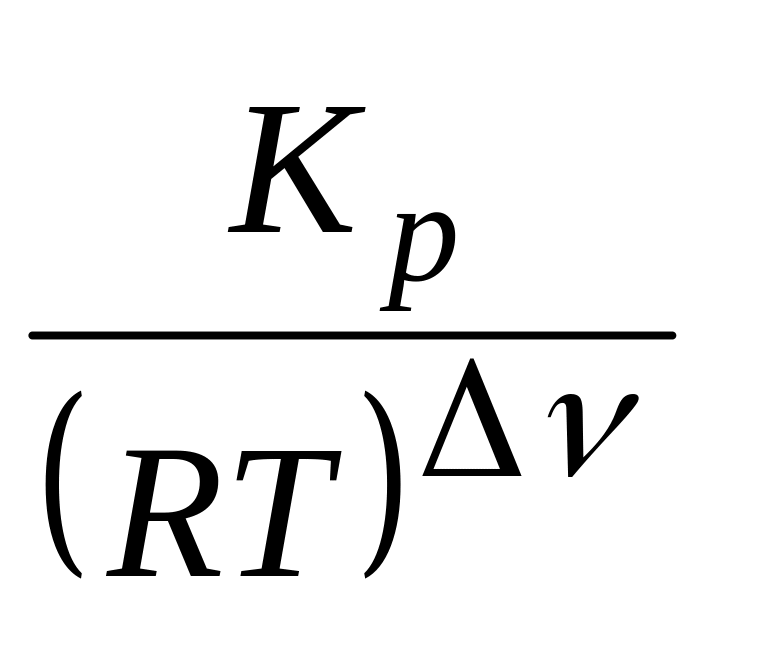 =
=
![]() = 0,018
= 0,018
∆ν = 2-1=1
- изменение числа молей газообразных веществ!
При 298 К: Кр ® 0 Þ в равновесной смеси практически отсутствуют продукты Þ смещение равновесия в сторону исходных веществ
При 1000 К: Кр > 1 Þ в равновесной смеси начинают преобладать продукты, их выход растет с ↑ Т
с ↑ Т значение Кр увеличивается Þ ∆r H0 > 0
З
Для
реакции (Р,Т
= const):
А(г)
Кр
= 0,02 при 400 К и
Кр
=
4,00
при 600 К.

![]() 2В(г)
2В(г)Определите ∆r h0298, ∆r s0298 и Кр при 800 к.
Решение:
Пусть ∆rH0 и ∆rS0 не зависят от температуры
Составим систему из двух уравнений с двумя неизвестными (T1=400 K, T2=600 K):
∆ r
G0Т1
=
∆r
H0298
–T1∆r
S0298
= -RT1lnКр1
r
G0Т1
=
∆r
H0298
–T1∆r
S0298
= -RT1lnКр1
∆r G0Т2 = ∆r H0298 –T2∆r S0298 = -RT2lnКр2
 x
– 400y
= -8,31.400 ln2.10-2
x
– 400y
= -8,31.400 ln2.10-2
x – 600y = -8,31.600 ln4
х = ∆r H0298 = 52833(Дж) = 52,833 кДж;
y = ∆r S0298 = 99,575 Дж/К.
ln![]() =
ln
=
ln![]() =
=
![]() (
(![]() )= 7,95; К800
= 56,55
)= 7,95; К800
= 56,55
ЗАДАЧА
Определите равновесное давление СО2 при Т = 990 К в реакции СаСО3(к) СаО(к) + СО2(г)
Решение:
Кр = рСО2,
Считаем, что ∆r H0 и ∆r S0 не зависят от Т:
∆r G0Т = ∆r H0298 – T∆r S0298 = –RT lnКр
∆r H0298 = ∆f H0298 , СаО + ∆f H0298, СО2 – ∆f H0298, СаСО3 = 178,1кДж;
∆r S0298 = S0298,CаО+ S0298,СО2 - S0298, СаСО3 = 160,5 Дж/К
178,1 · 103 – 990 · 160,5= – 8,31·990 lnКр Þ Кр = 0,1
Кр = рСО2 / 105 = 0,1 Þ рСО2 = 104 Па
ЗАДАЧА
Определить равновесный состав системы
С(к) + СО2(г) 2СО(г)
Т= 1000 К Робщ = 2атм nисх, CO2 = 5 моль
Решение:
Реакция идет при P = const отличным от 1!
Kp =exp(- ∆G0Т /RT)
Kp1000 = exp(+3160/8,31.1000)= ехр(0,38) = 1, 46
Компонент |
С |
СО2 |
2СО |
Начальный состав, моль |
- |
5 |
0 |
Изменение состава, моль |
- |
х |
2 x |
Равновесный состав, моль |
- |
5 – x |
2 x |
Кр
=
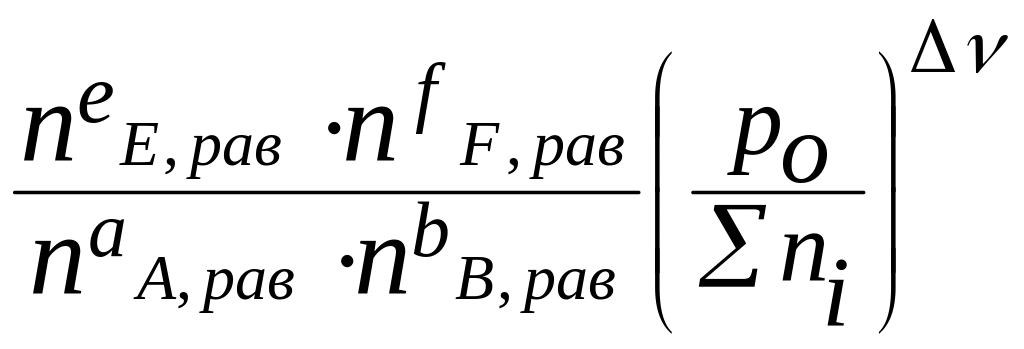 =
=
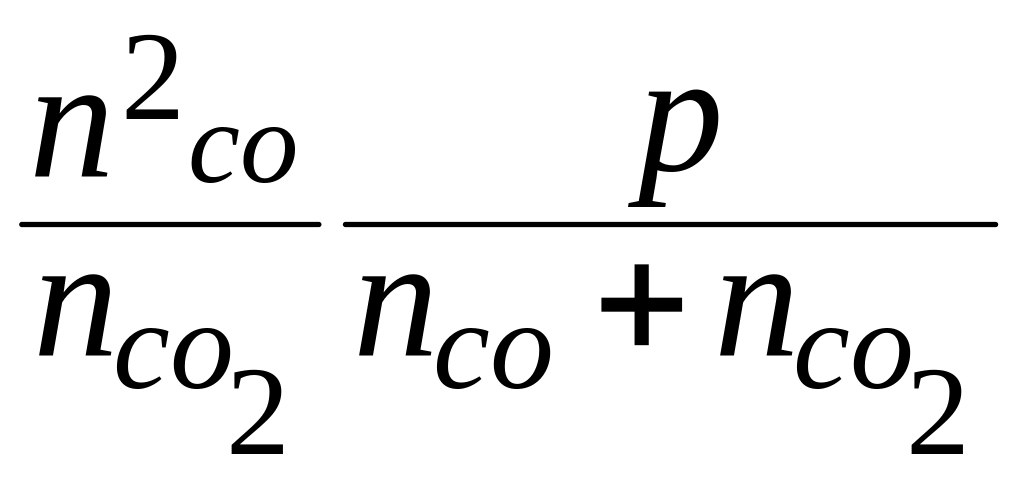 =
=
=
![]() =
1,46
х
= 1,7 моль.
=
1,46
х
= 1,7 моль.
Равновесный: n(СО2) = 5 - 1,7 = 3,3
состав: n(СО) = 2×1,7 = 3,4.
ЗАДАЧА
Определите сравн СО2 и СО для реакции
С(к) + СО2(г) 2СО(г)
Т = 1000 К , Vсосудa = 2 л, mисх (СО2) = 44 г,
Рассчитайте, на сколько изменится давление в системе при равновесии по сравнению с исходным
Решение:
Реакция идет при V = const!
сСО2
=
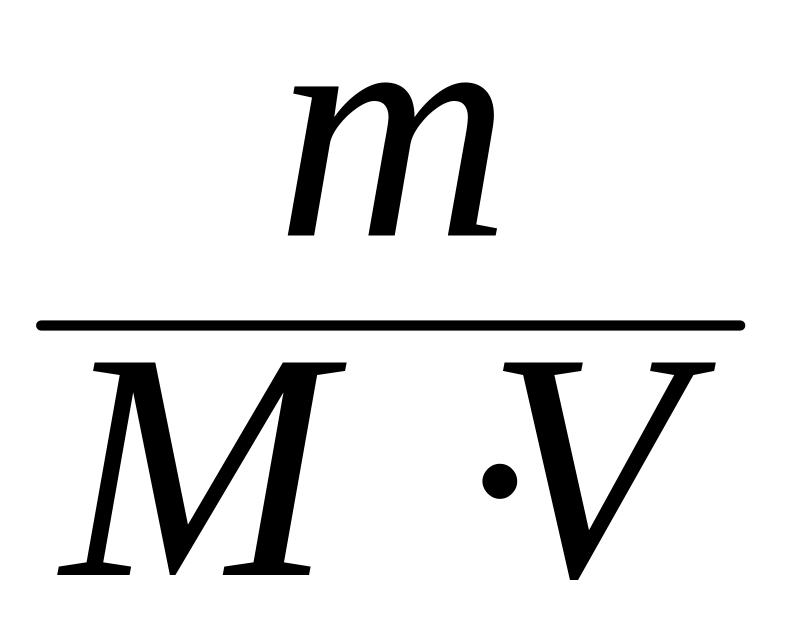 =
=
![]() = 0,5
моль/л;
Кс,
1000
= 0,018
= 0,5
моль/л;
Кс,
1000
= 0,018
Таблица материального баланса:
Компонент |
С |
СО2 |
2СО |
сисх, моль/л |
- |
0,5 |
0 |
Δс, моль/л |
- |
х |
2 x |
сравн, моль/л |
- |
0,5 – x |
2 x |
Кс
=
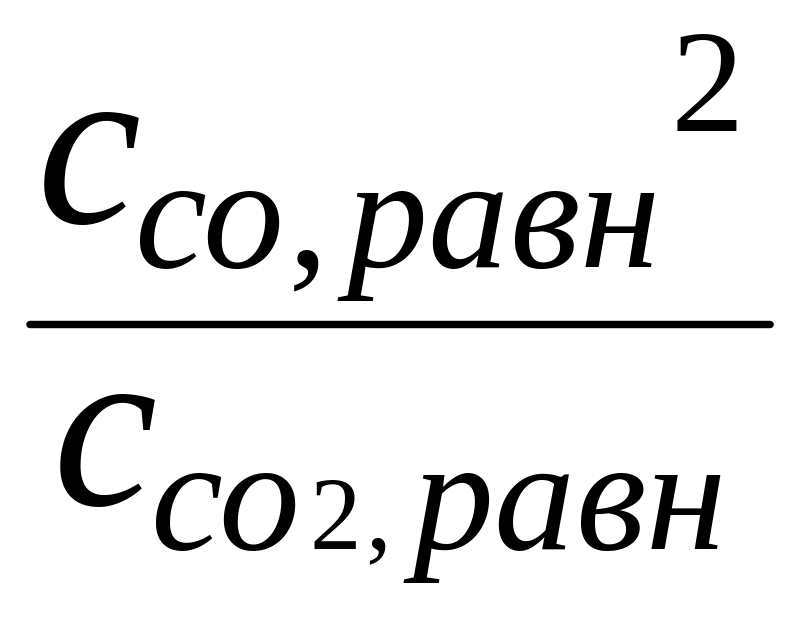 =
=
![]() = 0,018 Þ
х
=
0,0387 моль/л
= 0,018 Þ
х
=
0,0387 моль/л
сСО, равн = 2. 0,0387 = 0,0774 моль/л
сСО2, равн = 0,5 - 0,0387 = 0,4613 моль/л
Р0 = сRT = 0,5.0,082•1000 = 41атм
Рравн = (0,5 – х + 2х)RT = 44,173 атм Þ DР = 3,173атм
ЗАДАЧА
Как увеличить выход продуктов реакции
С(к) + СО2(г) 2СО(г)?
Решение:
Повысить выход продукта СО Þ
сместить равновесие вправо:
↑ Т системы, т. к. ∆r H0298 > 0
↓ Рсистемы , т. к. прямая реакция идет с увеличением
числа молей газообразных веществ
↑ РСО2 и ↓ РСО (выводить продукт из сферы реакции)
